Профилирование экспрессии генов при раке
Рак – это категория заболеваний, характеризующаяся неконтролируемым ростом и пролиферацией клеток. Для развития рака гены , регулирующие клеток рост и дифференцировку необходимо изменить ; эти мутации затем сохраняются в ходе последующих делений клеток и, таким образом, присутствуют во всех раковых клетках. Профилирование экспрессии генов — это метод, используемый в молекулярной биологии для одновременного изучения экспрессии тысяч генов. В контексте рака профилирование экспрессии генов используется для более точной классификации опухолей. Информация, полученная в результате профилирования экспрессии генов, часто помогает предсказать клинический исход пациента.
Фон
[ редактировать ]Онкогенез
[ редактировать ]Онкогенез — процесс, при котором нормальные клетки приобретают свойства раковых клеток, приводящий к образованию рака или опухоли (см.: Онкогенез ). Он характеризуется молекулярным перепрограммированием клетки для неингибированного клеточного деления , что приводит к образованию злокачественной массы. Клетки, образующие эту массу, подвергаются естественному отбору: по мере того, как клетки приобретают мутации, повышающие их выживаемость или репродуктивную способность, они доминируют в растущей опухоли, в то время как другие клетки вытесняются (см.: соматическая эволюция при раке ). Благодаря этим селективным свойствам большинство клеток опухоли имеют общий профиль экспрессии генов.
Профилирование экспрессии генов
[ редактировать ]Профилирование экспрессии генов — это метод, используемый в молекулярной биологии для одновременного изучения экспрессии тысяч генов. Хотя почти все клетки организма содержат весь геном организма, только небольшая часть этих генов экспрессируется в виде информационной РНК (мРНК) в любой момент времени, и их относительную экспрессию можно оценить. Методы включают технологию микрочипов ДНК или методы, основанные на секвенировании, такие как серийный анализ экспрессии генов (SAGE).
В современных исследованиях рака в основном используются микрочипы ДНК, в которых ряды микроскопических пятен заранее определенных ДНК- олигонуклеотидов , известных как зонды, ковалентно прикреплены к твердой поверхности, такой как стекло, образуя так называемый генный чип. ДНК, меченная флуорофорами ( мишень ), готовится из образца, такого как биопсия опухоли, и гибридизуется с последовательностями комплементарной ДНК (кДНК) на генном чипе. Затем чип сканируют на наличие и интенсивность флуоресцентных меток в каждом месте, представляющих гибриды зонда и мишени. Уровень флуоресценции в определенном пятне предоставляет количественную информацию об экспрессии конкретного гена, соответствующего указанной последовательности кДНК. Микрочипы ДНК произошли от Саузерн-блоттинга , который позволяет обнаруживать определенную последовательность ДНК в образце ДНК.
Из-за снижения затрат РНК-секвенирование становится все более распространенным методом определения профиля экспрессии генов рака. Он превосходит методы микрочипов из-за отсутствия предвзятости, свойственной выбору зонда.
Классификация рака
[ редактировать ]Фон
[ редактировать ]
В классификации рака доминируют области гистологии и гистопатологии , целью которых является использование морфологических маркеров для точной идентификации типа опухоли. Гистологические методы основаны на химическом окрашивании тканей такими пигментами, как гематоксилин и эозин на основе микроскопии , а также на визуализации патологом . Идентификация подтипов опухолей основана на установленных классификационных схемах, таких как Международная классификация болезней, опубликованная Всемирной организацией здравоохранения , которая предоставляет коды для классификации заболеваний и широкого спектра признаков, симптомов, отклонений от нормы, жалоб, социальных обстоятельств и внешних причин. травм или заболеваний. Для некоторых типов рака эти методы не позволяют различать подклассы; например, определение подгрупп диффузной крупноклеточной B-клеточной лимфомы (DLBCL) в значительной степени не удалось из-за несоответствий между воспроизводимостью между и внутри наблюдателя. [ 1 ] Более того, клинические исходы опухолей, классифицированных как DLBCL, сильно различаются. [ 1 ] предполагая, что существует несколько подтипов DLBCL, которые невозможно различить на основе этих гистологических маркеров. Классификация опухолей молочной железы на основе этих предикторов также в значительной степени не удалась. [ 2 ] Разработка эффективных методов лечения зависит от точного диагноза; кроме того, неправильный диагноз может привести к страданиям пациентов из-за ненужных побочных эффектов от нецелевого лечения и к увеличению расходов на здравоохранение. Наиболее показательным, пожалуй, является то, что 70-80% больных раком молочной железы, получающих химиотерапию, основанную на традиционных показателях, выжили бы без нее. [ 3 ] [ 4 ]
Следует отметить, что аналогичные закономерности экспрессии генов, связанные с метастатическим поведением опухолевых клеток рака молочной железы, также были обнаружены при раке молочной железы собак, наиболее распространенной опухоли у сук. [ 5 ] [ 6 ]
Ниже представлены способы использования профилирования экспрессии генов для более точной классификации опухолей на подгруппы, часто с клиническим эффектом.
Молекулярная подпись
[ редактировать ]В определенном типе клеток или тканей только небольшая часть геномной ДНК организма будет экспрессироваться в виде мРНК в любой момент времени. Уникальный образец экспрессии генов для данной клетки или ткани называется ее молекулярной сигнатурой. Например, экспрессия генов в клетках кожи будет сильно отличаться от экспрессии генов в клетках крови. Микроматричный анализ может предоставить количественную информацию об экспрессии генов, позволяющую генерировать молекулярные сигнатуры, каждая из которых уникальна для определенного класса опухолей. Эта идея была впервые продемонстрирована экспериментально [ 7 ] в 2000 году исследователями из Стэнфордского университета опубликовано в журнале Nature Genetics . Авторы измерили относительную экспрессию 9703 кДНК человека в шестидесяти линиях раковых клеток, ранее изученных и охарактеризованных в рамках Национального института рака программы развивающей терапии . Алгоритм иерархической кластеризации использовался для группировки клеточных линий на основе сходства, по которому варьируется характер экспрессии генов. В этом исследовании Росса и др. большинство клеточных линий с общими органами происхождения (на основе информации Национального института здравоохранения ) группировались вместе на терминальных ветвях, что позволяет предположить, что раковые клетки, возникающие из одной и той же ткани, имеют много общих молекулярных характеристик. Это позволяет надежно идентифицировать тип опухоли на основе экспрессии генов.
Подкласс опухоли
[ редактировать ]Более важным результатом профилирования экспрессии генов является возможность дальнейшей классификации опухолей на подтипы, имеющие различные биологические свойства и влияющие на прогноз. Например, некоторые диффузные крупноклеточные B-клеточные лимфомы (DLBCL) неотличимы на основе гистологических методов, но клинически гетерогенны: 40% пациентов хорошо реагируют и демонстрируют длительную выживаемость, тогда как остальные 60% этого не делают. [ 8 ]
В 2000 году исследователи из Стэнфорда под руководством Эша Ализаде и его коллег опубликовали результаты. [ 8 ] в Nature с использованием методов профилирования экспрессии для разделения DLBCL на два подтипа: B-подобный DLBCL зародышевого центра и активированный B-подобный DLBCL. Авторы разработали специальные микрочипы, названные «лимфочипы», которые использовались для проверки экспрессии 17 856 генов, преимущественно экспрессируемых в лимфоидных клетках, а также тех, которые играют роль в раке или иммунологии, для 96 образцов лимфоцитов. Алгоритм иерархической кластеризации идентифицировал подмножество опухолей, которые традиционными гистологическими методами были бы названы DLBCL; однако профили экспрессии этих опухолей были гетерогенными. Когда опухоли были повторно кластеризованы на основе экспрессии генов В-клеток зародышевого центра, появилась вторая группа генов, характерных для активированных В-клеток, которые регулирулись противоположно по сравнению с первым набором генов. На основании этих паттернов экспрессии гетерогенный кластер DLBCL был подразделен на B-подобный DLBCL зародышевого центра и активированный B-подобный DLBCL. Различие между этими группами существенно с точки зрения общей выживаемости пациентов: вероятность выживания для пациентов с B-подобными DLBCL зародышевого центра в течение 10 лет составляла около 80%, тогда как у пациентов с активированными B-подобными DLBCL была снижена примерно до 40% в течение более 10 лет. сокращенный восьмилетний период.
Рак молочной железы также трудно отличить по гистологическим маркерам. В исследовании 2000 года, опубликованном в журнале Nature , исследователи из Стэнфорда под руководством Перу охарактеризовали закономерности экспрессии генов в 8102 генах из 65 биопсий, полученных при раке молочной железы. [ 9 ] Целью исследования было выявление закономерностей экспрессии генов, которые можно было бы использовать для описания фенотипического разнообразия опухолей молочной железы путем сравнения профилей биопсий с профилями культивируемых клеточных линий и сопоставления этой информации с клиническими данными. Опухоли были сгруппированы в две основные группы, которые в значительной степени отражали ER -положительные и ER-негативные клинические описания. ER-позитивные опухоли характеризовались высокой экспрессией генов, обычно экспрессируемых в клетках просвета молочной железы. Авторы предполагают, что это различие более высокого порядка может охватывать как минимум два биологически различных типа рака, каждый из которых может требовать уникального курса лечения. В группе ER-негативных были идентифицированы дополнительные кластеры на основании экспрессии Erb-B2 и генов, обогащенных кератином 5 и 17, подобных базальному эпителию. Эти группы отражают различные молекулярные особенности, связанные с биологией эпителия молочной железы, в зависимости от исхода заболевания.
Клиническое применение
[ редактировать ]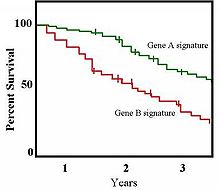
В исследовании 2001 года, опубликованном в Трудах Национальной академии наук , Сёрли и др. [ 10 ] дополнительно стратифицировали классификации, описанные Perou et al. [ 9 ] и изучили клиническую ценность этих подтипов рака молочной железы. Авторы разделили ER-положительные опухоли на две отдельные группы и обнаружили, что классификация опухолей, основанная на экспрессии генов, связана с выживаемостью пациентов. Экспрессия 427 генов была измерена для 78 видов рака и семи доброкачественных образцов молочной железы. После иерархической кластеризации образцы сформировали две группы на самом высоком уровне организации, отражающие ER-положительный и ER-негативный фенотипы; ER-негативный кластер далее стратифицирован на группы, идентичные тем, которые описаны Perou et al. [ 9 ] В отличие от предыдущих результатов, Sørlie et al. [ 10 ] обнаружили, что ER-положительная группа также может быть разделена на три отдельные подгруппы, называемые люминальными подтипами A, B и C, на основе паттернов специфичной для люминала экспрессии генов с разными результатами. Кроме того, после проведения анализа выживаемости авторы обнаружили, что опухоли, принадлежащие к различным группам, показали значительно разные результаты при единообразном лечении. Анализы выживания часто представляются в виде графиков выживания Каплана-Мейера , пример которых показан справа.
Помимо идентификации генов, которые коррелируют с выживаемостью, анализы на микрочипах использовались для установления профилей экспрессии генов, связанных с прогнозом. Принято считать, что адъювантная терапия принесет наибольшую пользу пациентам с опухолями, имеющими плохие прогностические характеристики , поскольку эти методы лечения существенно улучшают общую выживаемость женщин с раком молочной железы. Однако традиционные прогностические факторы, как упоминалось выше, неточны. Исследователи из Нидерландского института рака смогли идентифицировать признаки «хорошего прогноза» и «плохого прогноза» на основе экспрессии 70 генов, что позволило лучше предсказать вероятность развития метастазов в течение пяти лет у пациентов с раком молочной железы. [ 11 ] [ 12 ] Метастазирование предполагает распространение рака из одного органа в другие по всему телу и является основной причиной смерти онкологических больных. В то время как исследование в Нидерландском институте рака применялось только к пациентам с раком молочной железы, исследователи из Массачусетского технологического института выявили молекулярную характеристику метастазов, которая применима к аденокарциномам в целом. [ 13 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б «Проект классификации неходжкинских лимфом: клиническая оценка классификации неходжкинских лимфом Международной группы по изучению лимфомы» . Кровь . 89 (11): 3909–3918. 1997. дои : 10.1182/blood.V89.11.3909 . ПМИД 9166827 .
- ^ МакГуайр В.Л. (1991). «Прогностические факторы рака молочной железы: рекомендации по оценке» . Журнал Национального института рака . 83 (3): 154–5. дои : 10.1093/jnci/83.3.154 . ПМИД 1988696 .
- ^ Совместная группа ранних исследователей рака молочной железы (1998). «Полихимиотерапия раннего рака молочной железы: обзор рандомизированных исследований». Ланцет . 352 (9132): 930–942. дои : 10.1016/S0140-6736(98)03301-7 . S2CID 38457555 .
- ^ Фу Икс (1998). «Тамоксифен при раннем раке молочной железы: обзор рандомизированных исследований». Ланцет . 351 (9114): 1451–1467. дои : 10.1016/S0140-6736(97)11423-4 . ПМИД 9605801 . S2CID 46287542 .
- ^ Клопфляйш Р., Ленце Д., Хуммель М., Грубер А.Д. (2010). «Метастатические карциномы молочной железы собак можно идентифицировать по профилю экспрессии генов, который частично совпадает с профилями рака молочной железы человека» . БМК Рак . 10 :618. дои : 10.1186/1471-2407-10-618 . ПМЦ 2994823 . ПМИД 21062462 .
- ^ Клопфляйш Р., Ленце Д., Хуммель М., Грубер А.Д. (2010). «Метастатический каскад отражен в транскриптоме метастатического рака молочной железы собак». Ветеринарный журнал . 190 (2): 236–243. дои : 10.1016/j.tvjl.2010.10.018 . ПМИД 21112801 .
- ^ Росс Д.Т.; и др. (2000). «Систематические изменения в моделях экспрессии генов в линиях раковых клеток человека» . Природная генетика . 24 (3): 227–235. дои : 10.1038/73432 . ПМИД 10700174 . S2CID 1135137 .
- ^ Jump up to: а б Ализаде А.А.; и др. (2000). «Отличные типы диффузной крупноклеточной В-клеточной лимфомы, выявленные с помощью анализа экспрессии генов». Природа . 403 (6769): 503–511. Бибкод : 2000Natur.403..503A . дои : 10.1038/35000501 . ПМИД 10676951 . S2CID 4382833 .
- ^ Jump up to: а б с Перу CM; и др. (2000). «Молекулярные портреты опухолей молочной железы человека» . Природа . 406 (6797): 747–752. дои : 10.1038/35021093 . ПМИД 10963602 . S2CID 1280204 .
- ^ Jump up to: а б Сёрли М. и др. (2001). «Модели экспрессии генов карциномы молочной железы различают подклассы опухолей с клиническими последствиями» . Труды Национальной академии наук . 98 (19): 10869–10874. Бибкод : 2001PNAS...9810869S . дои : 10.1073/pnas.191367098 . ПМК 58566 . ПМИД 11553815 .
- ^ вант Веер ЖЖ ; и др. (2002). «Профилирование экспрессии генов предсказывает клинический исход рака молочной железы». Природа . 415 (6871): 530–536. дои : 10.1038/415530a . hdl : 1874/15552 . ПМИД 11823860 . S2CID 4369266 .
- ^ ван де Вийвер М.Дж.; и др. (2002). «Сигнатура экспрессии генов как предиктор выживаемости при раке молочной железы». Медицинский журнал Новой Англии . 347 (25): 1999–2009. doi : 10.1056/NEJMoa021967 . hdl : 1874/15577 . ПМИД 12490681 .
- ^ Рамасвами С. и др. (2002). «Молекулярная подпись метастазов в первичных солидных опухолях». Природная генетика . 33 (1): 49–54. дои : 10.1038/ng1060 . ПМИД 12469122 . S2CID 12059602 .
- Гибсон, Грег; Муза, Спенсер В. (2009). Букварь геномной науки . Сандерленд, Массачусетс: Sinauer Associates, Inc. ISBN 978-0-87893-236-8 .
- Вайнберг, Роберт А. (2007). Биология рака . Нью-Йорк: Garland Science, Taylor & Francisco Group, LLC. ISBN 978-0-8153-4076-8 .
Ресурсы
[ редактировать ]- Инструмент Genevestigator Neoplasm — это бесплатный инструмент с открытым доступом для визуализации экспрессии генов более чем 1000 различных типов и подтипов рака.