Суперсемейство резистентных узелково-клеточных делений
| Суперсемейство пермеаз RND | |
|---|---|
 Кристаллизованный AcrB : белок подкласса HAE-RND, участвующий в оттоке лекарственного средства и амфифильных веществ. | |
| Идентификаторы | |
| Символ | RND_Permease |
| Пфам Клан | CL0322 |
| TCDB | 2.А.6 |
| Суперсемейство OPM | 16 |
| белок OPM | 2гиф |
Транспортеры семейства Resistant-nodulation-division ( RND ) представляют собой категорию бактериальных эффлюксных насосов , особенно выявленных у грамотрицательных бактерий и расположенных в цитоплазматической мембране, которые активно транспортируют субстраты. RND Суперсемейство включает семь семейств: отток тяжелых металлов (HME), гидрофоб / отток амфифилов-1 (грамотрицательные бактерии), семейство экспортеров факторов клубенька (NFE), семейство вспомогательных белков, секретирующих белок SecDF, гидрофоб / семейство оттока амфифилов-2, эукариотических стеринов семейство гомеостаза и семейство оттока гидрофобов/амфифилов-3. [ 1 ] Эти системы RND участвуют в поддержании гомеостаза клетки, удалении токсичных соединений и экспорте детерминант вирулентности . [ 2 ] Они имеют широкий спектр субстратов и при чрезмерной экспрессии могут привести к снижению активности несвязанных классов лекарств. Первые сообщения о бактериальных инфекциях, устойчивых к лекарствам, были зарегистрированы в 1940-х годах, после первого массового производства антибиотиков . [ 3 ] Большинство транспортных систем суперсемейства RND состоят из крупных полипептидных цепей. [ 4 ] Белки RND существуют в основном у грамотрицательных бактерий, но также могут быть обнаружены у грамположительных бактерий , архей и эукариот .
Функция
[ редактировать ]Белок RND определяет субстрат для завершенных транспортных систем, включая ионы металлов , ксенобиотики или лекарства . Транспорт гидрофобных и амфифильных соединений осуществляется подсемейством HAE-RND. При этом истечение тяжелых металлов предварительно образуется HME-RND. [ 5 ]

Механизм и структура
[ редактировать ]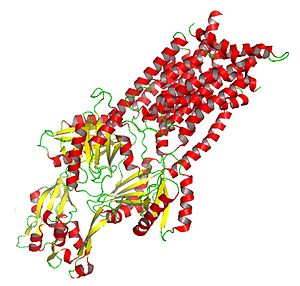
Белки RND имеют большие размеры и могут включать более 1000 аминокислотных остатков. Обычно они состоят из двух гомологичных субъединиц (предполагается, что они возникли в результате события внутригенной тандемной дупликации, произошедшего в первичной системе до расхождения членов семейства), каждая из которых содержит периплазматическую петлю, примыкающую к 12 трансмембранным спиралям . Из двенадцати спиралей имеется один трансмембранный ключ (TMS) на N-конце, за которым следует большой экстрацитоплазматический домен, затем шесть дополнительных TMS, второй большой экстрацитоплазматический домен и пять последних C-концевых TMS. TM4 управляет специфичностью к определенному субстрату в данном белке RND. Следовательно, TM4 может быть индикатором специфичности RND без явного знания остальной части белка. [ 6 ]
Насосы RND представляют собой цитоплазматическую находящуюся часть полного трехчастного комплекса (рис. 1), который распространяется через внешнюю и внутреннюю мембраны грамотрицательных бактерий, также обычно называемый системой оттока CBA. Белок RND связывается с наружным мембранным каналом и периплазматическим адапторным белком, а объединение всех трех белков позволяет системе экспортировать субстраты во внешнюю среду, обеспечивая бактериям огромное преимущество . [ 7 ]
Белок CusA, транспортер члена HME-RND, удалось кристаллизовать, предоставив ценную структурную информацию о насосах HME-RND. CusA существует в виде гомотримера , каждая единица которого состоит из 12 трансмембранных спиралей (TM1-TM12). Периплазматический домен состоит из двух спиралей: TM2 и TM8. Кроме того, периплазматический домен состоит из шести субдоменов: PN1, PN2, PC1, PC2, DN, DC, которые образуют центральную пору и док-домен. Центральная пора образована PN1, PN2, PC1, PC2 и вместе стабилизирует тримерную организацию гомотримера . [ 8 ]
Отток ионов металлов (HME-RND)
[ редактировать ]Семейство HME-RND функционирует как центральный белковый насос протон-субстрата при оттоке ионов металлов, питаемый антипортом . В семейство входят насосы, экспортирующие одновалентные металлы — система Cus, и насосы, экспортирующие двухвалентные металлы — система Czc. [ 5 ]
Устойчивость к тяжелым металлам семейства RND была впервые обнаружена у R. metallidurans через белок CzcA, а затем и CnrA. К наиболее охарактеризованным белкам RND относятся CzcCBA (Cd 2+ , Зн 2+ и Ко 2+ ), CnrCBA (Ni 2+ и Ко 2+ ) и NccCBA (Ni 2+ , Ко 2+ и компакт-диск 2+ ) в Cupriavidus , Czr (Cd 2+ и цинк 2+ устойчивость) у Pseudomonas aeruginosa и Czn (Cd 2+ , Зн 2+ и Ни 2+ устойчивость) у Helicobacter pylori . [ 9 ] Было высказано предположение, что отток ионов металлов происходит из цитоплазмы и периплазмы на основании расположения множественных сайтов связывания субстрата на белке RND. [ 6 ]
CznCBA
[ редактировать ]Система Czn поддерживает гомеостаз к кадмию , цинку и никелю устойчивости ; он участвует в модуляции уреазы и колонизации желудка H. pylori . Белки CznC и CznA играют доминирующую роль в гомеостазе никеля. [ 10 ]
ЧцЦБА
[ редактировать ]Czc придает устойчивость к кобальту , цинку и кадмию . Оперон CzcCBA включает: CzcA (белок, специфичный для семейства RND), белок слияния мембран (MFP) CzcB и белок фактора внешней мембраны (OMF) CzcC, все из которых образуют активный трехчастный комплекс и czcoperon . Экспрессия оперона регулируется ионами металлов. [ 6 ]
Лекарственная устойчивость (HAE-RND)
[ редактировать ]Семейство RND играет важную роль в формировании внутренней и повышенной множественной лекарственной устойчивости грамотрицательных бактерий. Экспорт амфифильных и гидрофобных субстратов регулируется семейством HAE-RND. В E. coli были идентифицированы пять насосов RND: AcrAB, AcrAD, AcrEF, MdtEF и MdtAB. Хотя неясно, как трехсторонний комплекс работает у бактерий, были предложены два механизма: модель мостика адаптера и модель обертывания адаптера . [ нужна ссылка ]
Участие HAE-RND в детоксикации и экспорте органических субстратов позволило недавно охарактеризовать конкретные насосы из-за их растущей медицинской значимости. Половина устойчивости к антибиотикам, продемонстрированной у in vivo, больничных штаммов Pseudomonas aeruginosa была связана с белками, выделяющими RND. P. aeruginosa содержит 13 транспортных систем RND, включая одну HME-RND и остальные HAE-RND. Среди наиболее идентифицированных — белки Mex: MexB, MexD и MexF, которые детоксицируют органические вещества . Предполагается, что системы MexB демонстрируют субстратную специфичность к бета-лактамам ; в то время как MexD-система выражает специфичность к соединениям цефема. [ 6 ]
Кишечная палочка – AcrB
[ редактировать ]У E. coli множественная лекарственная устойчивость развивается по разным механизмам. Особое беспокойство вызывает способность механизмов оттока обеспечивать устойчивость широкого спектра. Откачивающие насосы RND обеспечивают экструзию целого ряда компаундов. пять белковых переносчиков в клетках E. coli , принадлежащих к подсемейству HAE-RND: Классифицированы [ 11 ] включая белок оттока множества лекарств AcrB, белок внешней мембраны TolC и периплазматический адапторный белок AcrA. [ 12 ] Белки TolC и AcrA также используются в трехчастном комплексе в других идентифицированных белках оттока RND. [ 11 ] Система оттока AcrAB-TolC отвечает за отток противомикробных препаратов, таких как пенициллин G , клоксациллин , нафциллин , макролиды , новобиоцин , линезолид и антибиотики фузидовой кислоты . Другие субстраты включают красители, моющие средства, некоторые органические растворители и стероидные гормоны . Пути, по которым липофильные домены субстрата и насосы РНД полностью не определены. [ нужна ссылка ]
Кристаллизованный белок AcrB дает представление о механизме действия белков HAE-RND и других белков семейства RND. [ 6 ]
Отток множественных лекарств (Mdt)
[ редактировать ]Mdt(A) представляет собой эффлюксный насос, обеспечивающий устойчивость к различным лекарствам. Он экспрессируется в L.lactis , E.coli и различных других бактериях. В отличие от других белков RND, Mdt(A) содержит предполагаемый сайт связывания АТФ и два C-мотива, консервативные в его пятом TMS. Mdt эффективен в обеспечении устойчивости бактерий к тетрациклину , хлорамфениколу , линкозамидам и стрептомицину . Источник энергии активного истечения Mdt(A) в настоящее время неизвестен. [ 13 ]
Ссылки
[ редактировать ]- ^ Ценг Т.Т., Гратвик К.С., Коллман Дж., Парк Д., Нис Д.Х., Гоффо А., Сайер М.Х. (август 1999 г.). «Суперсемейство пермеаз RND: древнее, повсеместное и разнообразное семейство, включающее белки болезней и развития человека». Журнал молекулярной микробиологии и биотехнологии . 1 (1): 107–25. ПМИД 10941792 .
- ^ Койн С., Розенфельд Н., Ламберт Т., Курвален П., Перишон Б. (октябрь 2010 г.). «Сверхэкспрессия насоса деления резистентных узелково-клеточных клеток AdeFGH обеспечивает множественную лекарственную устойчивость у Acinetobacter baumannii» . Антимикробные средства и химиотерапия . 54 (10): 4389–93. дои : 10.1128/AAC.00155-10 . ПМЦ 2944555 . ПМИД 20696879 .
- ^ Раут, Мэтью Дэвид, «Структура, функции и регуляция белков экспорта нескольких лекарств среди суперсемейства RND у грамотрицательных бактерий» (2010). Выпускные и диссертационные работы. Бумага 11401. http://lib.dr.iastate.edu/etd/11401
- ^ «2.A.6 Суперсемейство резистентных узловато-клеточных клеток (RND)» . База данных классификации транспортеров .
- ^ Jump up to: а б Мораледа-Муньос А., Перес Х., Экстремера А.Л., Муньос-Дорадо Х. (сентябрь 2010 г.). «Дифференциальная регуляция шести систем оттока тяжелых металлов в ответ Myxococcus xanthus на медь» . Прикладная и экологическая микробиология . 76 (18): 6069–76. Бибкод : 2010ApEnM..76.6069M . дои : 10.1128/AEM.00753-10 . ПМЦ 2937488 . ПМИД 20562277 .
- ^ Jump up to: а б с д и Нис Д.Х. (июнь 2003 г.). «Устойчивость к тяжелым металлам, опосредованная оттоком, у прокариот» . Обзоры микробиологии FEMS . 27 (2–3): 313–39. дои : 10.1016/s0168-6445(03)00048-2 . ПМИД 12829273 .
- ^ Никайдо Х (2011). «Строение и механизм многолекарственных откачивающих насосов типа РНД». Достижения энзимологии и смежных областей молекулярной биологии . Том. 77. Уайли. стр. 1–60. дои : 10.1002/9780470920541.ch1 . ISBN 9780470920541 . ПМК 3122131 . ПМИД 21692366 .
- ^ Лонг Ф., Су CC, Циммерманн М.Т., Бойкен С.Е., Раджашанкар К.Р., Джерниган Р.Л., Ю Э.В. (сентябрь 2010 г.). «Кристаллические структуры эффлюксного насоса CusA предполагают транспорт металлов, опосредованный метионином» . Природа . 467 (7314): 484–8. Бибкод : 2010Natur.467..484L . дои : 10.1038/nature09395 . ПМК 2946090 . ПМИД 20865003 .
- ^ Валенсия Е.Ю., Браз В.С., Гуццо К., Маркес М.В. (апрель 2013 г.). «Два белка RND, участвующие в оттоке тяжелых металлов у Caulobacter crescentus, принадлежат к отдельным кластерам внутри протеобактерий» . БМК Микробиология . 13:79 . дои : 10.1186/1471-2180-13-79 . ПМК 3637150 . ПМИД 23578014 .
- ^ Сталер Ф.Н., Оденбрейт С., Хаас Р., Вильрих Дж., Ван Влит А.Х., Кастерс Дж.Г., Кист М., Бересвилл С. (июль 2006 г.). «Новый металлический эффлюксный насос Helicobacter pylori CznABC необходим для устойчивости к кадмию, цинку и никелю, модуляции уреазы и колонизации желудка» . Инфекция и иммунитет . 74 (7): 3845–52. дои : 10.1128/IAI.02025-05 . ПМЦ 1489693 . ПМИД 16790756 .
- ^ Jump up to: а б Анес Дж., Маккаскер, член парламента, Фэннинг С., Мартинс М. (2015). «Все тонкости откачивающих насосов RND в Escherichia coli» . Границы микробиологии . 6 : 587. дои : 10.3389/fmicb.2015.00587 . ПМК 4462101 . ПМИД 26113845 .
- ^ Никайдо Х., Такацука Ю. (май 2009 г.). «Механизмы многолекарственных откачивающих насосов RND» . Biochimica et Biophysical Acta (BBA) - Белки и протеомика 1794 (5): 769–81. дои : 10.1016/j.bbapap.2008.10.004 . ПМК 2696896 . ПМИД 19026770 .
- ^ Перретен В., Шварц Ф.В., Тойбер М., Леви С.Б. (апрель 2001 г.). «Mdt(A), новый эффлюксный белок, придающий Lactococcus Lactis и Escherichia coli множественную устойчивость к антибиотикам» . Антимикробные средства и химиотерапия . 45 (4): 1109–14. doi : 10.1128/AAC.45.4.1109-1114.2001 . ПМК 90432 . ПМИД 11257023 .