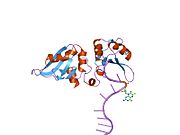
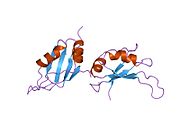
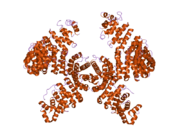HNRP1
| HNRP1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
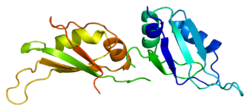 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | HNRNPA1 , ALS19, ALS20, HNRPA1, HNRPA1L3, IBMPFD3, HNRNP A1, HNRNP-A1, UP 1, Гетерогенный ядерный рибонуклеопротеин A1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Омим : 164017 ; MGI : 104820 ; Гомологен : 134664 ; GeneCards : hnrnpa1 ; OMA : hnrnpa1 - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викидид | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Гетерогенный ядерный рибонуклеопротеин А1 является белком , который у людей кодируется hnrnpa1 геном . [ 4 ] Мутации в HNRNP A1 являются причинными для амиотрофического бокового склероза и синдрома мультисистемной протеинопатии .
Функция
[ редактировать ]Этот ген принадлежит к подсемейству A/B повсеместно экспрессированного гетерогенных ядерных рибонуклеопротеинов (HNRNP). HNRNP являются РНК -связывающими белками, и они комплексны с гетерогенной ядерной РНК (HNRNA). Эти белки связаны с пре-мРНК в ядре и, по-видимому, влияют на обработку пре-мРНК и другие аспекты метаболизма мРНК и транспорта. В то время как все HNRNP присутствуют в ядре, некоторые, по -видимому, переключаются между ядром и цитоплазмой. Белки HNRNP обладают различными свойствами связывания нуклеиновой кислоты. Белок, кодируемый этим геном, имеет два повторения квази-RRM-доменов, которые связываются с РНК в N-концевом домене, которые являются ключевыми для специфичности и связывания РНК. Белок также имеет область, богатую глицином аргининовой глицин-глицин (RGG), называемой RGG Box , которая обеспечивает связывание белка и РНК. Это влияет на многие критические гены, которые ответственны за контроль метаболических путей на уровнях транскрипции, посттранскрипции, трансляции и посттрансляции. Это один из наиболее распространенных белков ядра HNRNP -комплексов и локализован в нуклеоплазме. Этот белок, наряду с другими белками HNRNP, экспортируется из ядра, вероятно, связано с мРНК и немедленно повторно импортируется. Его последовательность ядерной локализации M9 (NLS), богатая глицином область ниже по течению от RGG Box, действует как ядерная локализация и сигнал ядерного экспорта. Кодированный белок участвует в упаковке пре-мРНК в частицы HNRNP, транспорт Poly A + мРНК от ядра до цитоплазмы и может модулировать выбор сайта сплайсинга. Множественные альтернативно сплайсированные варианты транскрипта были обнаружены для этого гена, но полностью описаны только два транскрипта. Эти варианты имеют несколько альтернативных сайтов инициации транскрипции и множество сайтов полиа. [ 5 ]
Также известно, что после трансляционных модификаций влияют функцию HNRNP A1. Метилирование остатков аргинина в коробке RGG может регулировать РНК-связывающую активность. Киназы, такие как протеинкиназа C (PKC), митоген-активированные протеинкиназы (MAPK) и рибосомальные S6-киназы (S6K) фосфорилируют сериновые остатки как на терминалах N, так и в C для регулирования функции. Фосфорилирование С-концевой области вызывает цитоплазматическое накопление белка. Однако добавление фрагмента O-глкнацилирования (GLCNAC) к серину или треонине является распространенной и обратимой модификацией, которая ухудшает связывание белка с кариоферином бета (транспортировка-1), что приводит к ядерной локализации HNRNPA1. [ 6 ]
Взаимодействия
[ редактировать ]было показано, что HNRNP A1 взаимодействует с BAT2 , [ 7 ] Структурная конструкция лоскута эндонуклеаза 1 [ 8 ] и IκBα . [ 9 ]
Роль в вирусах
[ редактировать ]HNRNP A1 участвует в жизненном цикле ДНК, РНК положительного смысла и РНК-вирусы отрицательного смысла представляют собой несколько стадий после инфекции. Роль белков в вирусных жизненных циклах варьируется в зависимости от вируса и даже может играть противоречивые роли. В некоторых это способствует репликации вируса, в то время как в других он отменяет ее.
Антивирусный эффект HNRNP A1 присутствует в модели культивирования лимфотропного вируса I-вируса человека (HTLV-1) человека. HNRNP A1 ингибирует связывание белка REX с его элементом ответа в 3 -'длинном терминальном повторении (LTR) всех вирусных РНК. Эктопическая экспрессия HNRNP A1 противоречит посттранскрипционной активности REX посредством конкурентного связывания, вызывая противовирусную реакцию на инфекцию HTLV-1, отрицательно влияя на скорость репликации вируса. В случае вируса гепатита С (ВГС), вируса РНК положительного смысла, HNRNP A1 взаимодействует с важнейшей областью вблизи 3 'конца открытого рамки считывания вируса (ORF), называемой элементом репликации CIS. Когда HNRNP A1 активируется, репликация HCV уменьшается, а когда HNRNPA1 подавляется, репликация HCV увеличивается.
Про-вирусный эффект HNRNP A1 присутствует в модели инфекции вируса вируса Sindbis (положительный смысл РНК). HNRNP A1 был обнаружен в перераспределении в цитоплазматическом сайте репликации вируса, связанной с 5-футовой областью UTR вирусной РНК, способствуя синтезу РНК отрицательной цепь. HNRNP A1 играет аналогичную роль в инфекции вируса эпидемии свиной диареи (PEDV), при которой HNRNP A1 совместно соиммунопреципитаты с белком Nucleocaps PEDV во время инфекции. HNRNP A1 также связан с терминальными последовательностями лидеров и межгенных последовательностей, которые имеют решающее значение для эффективной репликации вируса. Подобные тенденции также наблюдались при инфекциях риновируса (HRV), энтеровируса 71 (EV-71) и птичьего реовируса (ARV).
В случае некоторых вирусов, таких как вирус 1 иммунодефицита человека (ВИЧ-1), в разных исследованиях были представлены противоречивые результаты. Monette et al. Сообщалось о повышенной эндогенной экспрессии HNRNP A1 после ВИЧ-1 инфекции, поскольку повышенные уровни HNRNPA1 считались благоприятными для вируса. Они также обнаружили, что внижение регуляции HNRNPA1 негативно влияет на репликацию вируса. Напротив, Zahler et al. обнаружил, что чрезмерная экспрессия HNRNP A1 in vitro отрицательно влияет на репликацию вируса. В результате роль HNRNPA1 в жизненном цикле ВИЧ-1 несколько противоречива. [ 6 ]
Роль в других заболеваниях
[ редактировать ]Мутации в HNRNP A1 являются причиной амиотрофического бокового склероза и мультисистемной протеинопатии .
HNRNP A1 противоречит клеточному старению и индукции секреторного фенотипа, ассоциированного с старением путем стабилизации OCT-4 и Sirtuin 1 . мРНК [ 10 ] [ 11 ]
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в GRCM38: Ensembl Release 89: Ensmusg00000046434 - Ensembl , май 2017 г.
- ^ «Человеческая PubMed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ «Мышь Pubmed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ Saccone S, Biamonti G, Maugeri S, Bassi MT, Bunone G, Riva S, Della Valle G (март 1992 г.). «Назначение человеческого гетерогенного гена ядерного рибонуклеопротеина A1 (HNRPA1) к хромосоме 12Q13.1 с помощью конкурентной кДНК гибридизации in situ». Геномика . 12 (1): 171–4. doi : 10.1016/0888-7543 (92) 90424-q . PMID 1733858 .
- ^ «Ген Entrez: гетерогенный ядерный рибонуклеопротеин A1 HNRPA1» .
- ^ Jump up to: а беременный Каур Р., Лал С.К. (март 2020 г.). «Многолетние роли гетерогенного рибонуклеопротеина А1 при вирусных инфекциях» . Отзывы о медицинской вирусологии . 30 (2): E2097. doi : 10.1002/rmv.2097 . PMC 7169068 . PMID 31989716 .
- ^ Lehner B, Semple Ji, Brown SE, Counsell D, Campbell RD, Sanderson CM (январь 2004 г.). «Анализ высокопроизводительной двухгибридной системы дрожжей и ее использование для прогнозирования функции внутриклеточных белков, кодируемых в области MHC класса III человека». Геномика . 83 (1): 153–67. doi : 10.1016/s0888-7543 (03) 00235-0 . PMID 14667819 .
- ^ Chai Q, Zheng L, Zhou M, Turchi JJ, Shen B (Dec 2003). «Взаимодействие и стимуляция активности нуклеазы FEN-1 человека гетерогенным ядерным рибонуклеопротеином A1 при обработке альфа-сегмента во время созревания фрагментов Оказаки». Биохимия . 42 (51): 15045–52. doi : 10.1021/bi035364t . PMID 14690413 .
- ^ Hay DC, Kemp GD, Dargemont C, Hay RT (май 2001 г.). «Взаимодействие между hnrnpa1 и ikappabalpha требуется для максимальной активации NF-Kappab-зависимой транскрипции» . Мол Клетка. Биол . 21 (10): 3482–90. doi : 10.1128/mcb.21.10.3482-3490.2001 . PMC 100270 . PMID 11313474 .
- ^ Хан Й, Рампрасат Т, Зум (2020). «β-гидроксибутират и его метаболическое воздействие на возрастную патологию» . Экспериментальная и молекулярная медицина . 52 (4): 548–555. doi : 10.1038/s12276-020-0415-z . PMC 7210293 . PMID 32269287 .
- ^ Stubbs BJ, Koutnik AP, Volek JS, Newman JC (2021). «От кровати до поля битвы: пересечение механизмов корпуса кетона в геросионе с военной устойчивостью» . Геронаук . 43 (3): 1071–1081. doi : 10.1007/s11357-020-00277-y . PMC 8190215 . PMID 33006708 .
Дальнейшее чтение
[ редактировать ]- Ким С., Парк Г.Х., Пайк В.К. (1999). «Последние достижения в метилировании белка: ферментативное метилирование белков, связывающих нуклеиновых кислот». Аминокислоты . 15 (4): 291–306. doi : 10.1007/bf01320895 . PMID 9891755 . S2CID 28412209 .
- Buvoli M, Cobianchi F, Bestagno MG, Mangiarotti A, Bassi MT, Biamonti G, Riva S (1990). «Альтернативный сплайсинг в гене человека для основного белка A1 генерирует еще один белок HNRNP» . Embo j . 9 (4): 1229–35. doi : 10.1002/j.1460-2075.1990.tb08230.x . PMC 551799 . PMID 1691095 .
- Ghetti A, Bolognesi M, Cobianchi F, Morandi C (1991). «Моделирование путем гомологии РНК -связывающего домена в белке A1 HNRNP». Фебс Летт . 277 (1–2): 272–6. doi : 10.1016/0014-5793 (90) 80863-E . PMID 2176620 . S2CID 29915150 .
- Biamonti G, Buvoli M, Bassi MT, Morandi C, Cobianchi F, Riva S (1989). «Выделение активного гена, кодирующего белок HNRNP человека A1. Доказательства альтернативного сплайсинга». J. Mol. Биол . 207 (3): 491–503. doi : 10.1016/0022-2836 (89) 90459-2 . PMID 2760922 .
- Buvoli M, Biamonti G, Tsoulfas P, Bassi MT, Ghetti A, Riva S, Morandi C (1988). «Клонирование кДНК человеческого белка HNRNP A1 выявляет существование множественных изоформ мРНК» . Нуклеиновые кислоты Res . 16 (9): 3751–70. doi : 10.1093/nar/16.9.3751 . PMC 336554 . PMID 2836799 .
- Рива С., Моранди С., Цулфас П., Пандольфо М., Биамонти Г., Меррилл Б., Уильямс К.Р., Малтауп Г., Бейретер К., Верр Х (1986). «Одноцепочечный ДНК-белок млекопитающего I вверх I получен из ядра HNRNP Core A1» . Embo j . 5 (9): 2267–73. doi : 10.1002/j.1460-2075.1986.tb04494.x . PMC 1167110 . PMID 3023065 .
- Epplen C, Epplen JT (1994). «Экспрессия (CAC) N/(GTG) N Простые повторяющиеся последовательности в мРНК человеческих лимфоцитов». Гул Генет . 93 (1): 35–41. doi : 10.1007/bf00218910 . PMID 7505766 . S2CID 22998633 .
- Siomi H, Dreyfuss G (1995). «Домен ядерной локализации в белке HNRNP A1» . J. Cell Biol . 129 (3): 551–60. doi : 10.1083/jcb.129.3.551 . PMC 2120450 . PMID 7730395 .
- Весардт Ф., Биамонти Г., Рива С. (1995). «Нуклео-цитоплазматическое распределение белков HNRNP человека: поиск целевых доменов в HNRNP A1». J. Cell Sci . 108 (2): 545–55. doi : 10.1242/jcs.108.2.545 . PMID 7769000 .
- Раджпурохит Р., Ли С.О., Парк Джо, Пайк В.К., Ким С. (1994). «Ферментативное метилирование рекомбинантного гетерогенного ядерного белка RNP A1. Двойная субстратная специфичность для S-аденозилметионин: гистон-аргинин N-метилтрансфераза» . Дж. Биол. Химический 269 (2): 1075–82. doi : 10.1016/s0021-9258 (17) 42223-x . PMID 8288564 .
- Гамильтон Б.Дж., Надь Э., Малтер Дж.С., Аррик Б.А., Ригби В.Ф. (1993). «Ассоциация гетерогенных ядерных рибонуклеопротеинов A1 и C -белков с повторенными последовательностями Auuua» . Дж. Биол. Химический 268 (12): 8881–7. doi : 10.1016/s0021-9258 (18) 52955-0 . PMID 8473331 .
- Майкл У.М., Чой М., Дрейфусс Г. (1996). «Ядерный экспортный сигнал в HNRNP A1: опосредованный сигналом, зависимый от температуры путь экспорта ядерного белка» . Клетка . 83 (3): 415–22. doi : 10.1016/0092-8674 (95) 90119-1 . PMID 8521471 . S2CID 615927 .
- Black AC, Luo J, Chun S, Bakker A, Fraser JK, Rosenblatt JD (1997). «Специфическое связывание белка связывания полипиримидинового тракта и HNRNP A1 с элементами CRS ВИЧ-1». Вирусные гены . 12 (3): 275–85. doi : 10.1007/bf00284648 . PMID 8883365 . S2CID 11678179 .
- Бональдо М.Ф., Леннон Г., Соарс М.Б. (1997). «Нормализация и вычитание: два подхода для облегчения открытия генов» . Геном Res . 6 (9): 791–806. doi : 10.1101/gr.6.9.791 . PMID 8889548 .
- Сюй Р.М., Джохан Л., Ченг Х, Мэйеда А., Крайнер А.Р. (1997). «Кристаллическая структура человека UP1, домен HNRNP A1, который содержит два мотива распознавания РНК» . Структура 5 (4): 559–70. doi : 10.1016/s0969-2126 (97) 00211-6 . PMID 9115444 .
- Bonifaci N, Moroianu J, Radu A, Blobel G (1997). «Karyopherin Beta2 опосредует ядерный импорт белка, связывающего мРНК» . Прокурор Нат. Академический Наука США . 94 (10): 5055–60. Bibcode : 1997pnas ... 94.5055b . doi : 10.1073/pnas.94.10.5055 . PMC 24630 . PMID 9144189 .
- Shamoo Y, Krueger U, Rice LM, Williams KR, Steitz TA (1997). «Кристаллическая структура двух РНК -связывающих доменов человеческого HNRNP A1 при разрешении 1,75». НАТ Структура Биол . 4 (3): 215–22. doi : 10.1038/nsb0397-215 . PMID 9164463 . S2CID 9381013 .
- Neubauer G, King A, Rappsilber J, Calvio C, Watson M, Ajuh P, Sleeman J, Lamond A, Mann M (1998). «Масс-спектрометрия и поиск датабазы EST обеспечивают характеристику мультибелкового комплекса сплайсосом». НАТ Генет . 20 (1): 46–50. doi : 10.1038/1700 . PMID 9731529 . S2CID 585778 .