Анализ плавления высокого разрешения
В этой статье есть несколько проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалять эти шаблонные сообщения )
|
расплава высокого разрешения ( HRM ) Анализ — мощный метод в молекулярной биологии для обнаружения мутаций , полиморфизмов и эпигенетических различий в образцах двухцепочечной ДНК . Он был открыт и разработан компанией Idaho Technology и Университетом Юты. [ 1 ] Он имеет преимущества перед другими генотипирования технологиями , а именно:
- Это экономически выгодно по сравнению с другими технологиями генотипирования , такими как секвенирование и TaqMan типирование SNP . Это делает его идеальным для крупномасштабных проектов генотипирования.
- Он быстрый и мощный, поэтому способен быстро и точно генотипировать множество образцов.
- Это просто. При хорошем качестве анализа HRM мощное генотипирование может быть выполнено неспециалистами в любой лаборатории, имеющими доступ к аппарату ПЦР в реальном времени с поддержкой HRM.
Метод
[ редактировать ]HRM-анализ проводится на образцах двухцепочечной ДНК. Обычно пользователь использует полимеразную цепную реакцию (ПЦР) перед анализом HRM, чтобы амплифицировать область ДНК, в которой находится интересующая его мутация. В пробирке с образцом теперь имеется множество копий интересующего участка ДНК. Эта амплифицируемая область известна как ампликон. После процесса ПЦР начинается анализ HRM. Этот процесс представляет собой просто точное нагревание ДНК ампликона от примерно 50 ˚C до примерно 95 ˚C. В какой-то момент этого процесса достигается температура плавления ампликона, и две цепи ДНК разделяются или «расплываются».
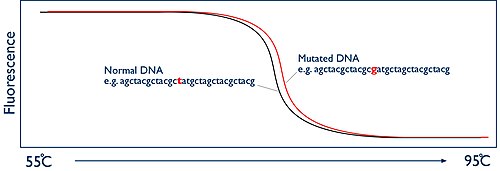
Ключом к управлению человеческими ресурсами является отслеживание этого разделения ветвей в режиме реального времени. Это достигается за счет использования флуоресцентного красителя. Красители, используемые для HRM, известны как интеркалирующие красители и обладают уникальным свойством. Они специфически связываются с двухцепочечной ДНК и при связывании ярко флуоресцируют. В отсутствие двухцепочечной ДНК им не с чем связываться, и они флуоресцируют лишь на низком уровне. В начале анализа HRM в образце наблюдается высокий уровень флуоресценции из-за миллиардов копий ампликона. Но когда образец нагревается и две цепи ДНК плавятся, присутствие двухцепочечной ДНК уменьшается и, следовательно, флуоресценция уменьшается. Аппарат HRM оснащен камерой, которая наблюдает за этим процессом, измеряя флуоресценцию. Затем машина просто отображает эти данные в виде графика, известного как кривая плавления, показывающего уровень флуоресценции в зависимости от температуры:
Сравнение кривых плавления
[ редактировать ]Температура плавления ампликона, при которой две цепи ДНК расходятся, вполне предсказуема. Это зависит от последовательности оснований ДНК. Если вы сравниваете два образца от двух разных людей, они должны дать кривую плавления одинаковой формы. Однако если у одного человека возникнет мутация в участке ДНК, который вы амплифицировали, это изменит температуру, при которой нити ДНК плавятся. Итак, теперь две кривые плавления выглядят по-разному. Разница может быть лишь незначительной, возможно, долей градуса, но поскольку машина HRM имеет возможность отслеживать этот процесс в «высоком разрешении», можно точно документировать эти изменения и, следовательно, определять, присутствует ли мутация или нет. .
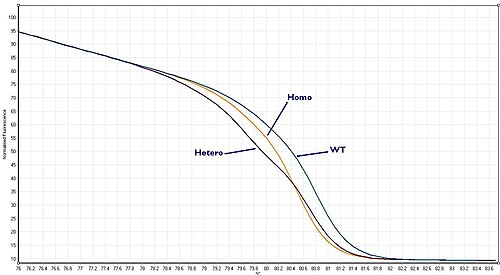
Дикий тип, гетерозигота или гомозигота?
[ редактировать ]Все становится немного сложнее, потому что организмы содержат две ( или более ) копии каждого гена, известные как две аллели . Итак, если образец берется у пациента и амплифицируется с помощью ПЦР, амплифицируются обе копии интересующей области ДНК (аллелей). Итак, если мы ищем мутацию, то есть три возможности:
- Ни один из аллелей не содержит мутаций.
- Тот или иной аллель содержит мутацию
- Оба аллеля содержат мутацию.
Эти три сценария известны как «дикий тип», «гетерозигота» или «гомозигота» соответственно. Каждый из них дает кривую плавления, которая немного отличается. С помощью высококачественного анализа HRM можно различить все три сценария.
Гомозиготные аллельные варианты могут характеризоваться температурным сдвигом на результирующей кривой плавления, полученной с помощью HRM-анализа. Для сравнения, гетерозиготы характеризуются изменениями формы кривой плавления. Это происходит из-за несоответствия пар оснований, возникающего в результате дестабилизированного гетеродуплексного отжига между цепями дикого типа и вариантными цепями. Эти различия можно легко увидеть на полученной кривой плавления, а различия в профилях плавления между разными генотипами можно усилить визуально, создав кривую различия. [ 2 ]
Приложения
[ редактировать ]Типирование SNP/обнаружение точечных мутаций
[ редактировать ]Обычные методы типирования SNP обычно отнимают много времени и стоят дорого, требуя мультиплексирования нескольких анализов на основе зондов или использования микрочипов ДНК. HRM более экономически эффективен и снижает потребность в разработке нескольких пар праймеров и необходимости приобретения дорогих зондов. Метод HRM был успешно использован для обнаружения одиночной замены G на A в гене Vssc (чувствительный к напряжению натриевый канал), который придает . чесоточному клещу устойчивость к акарициду перметрину Эта мутация приводит к изменению кодирования белка (G1535D). Анализ чесоточных клещей, собранных из популяций, предположительно восприимчивых и толерантных к перметрину, с помощью HRM показал отчетливые профили плавления. чувствительных Было обнаружено, что ампликоны клещей имеют более высокую температуру плавления по сравнению с толерантными клещами, как и ожидалось из-за более высокой термостабильности пары оснований GC. [ 3 ]
Было показано, что в области, более актуальной для клинической диагностики, HRM в принципе подходит для обнаружения мутаций в генах предрасположенности к раку молочной железы BRCA1 и BRCA2. В этих генах выявлено более 400 мутаций.
Секвенирование генов является золотым стандартом выявления мутаций. Секвенирование требует много времени и труда, и ему часто предшествуют методы, используемые для идентификации гетеродуплексной ДНК, которые затем еще больше усугубляют эти проблемы. HRM предлагает более быстрый и удобный метод оценки наличия мутаций в закрытой пробирке и дает результат, который можно дополнительно исследовать, если он представляет интерес. В исследовании, проведенном Скоттом и др. в 2006 году, [ 4 ] Для оценки методологии HRM использовали 3 клеточные линии, несущие различные мутации BRCA. Было обнаружено, что профили плавления полученных ПЦР-продуктов можно использовать для определения наличия или отсутствия мутации в ампликоне. Аналогичным образом в 2007 г. Крипуй и др. [ 5 ] показали, что тщательный дизайн анализов HRM (с учетом размещения праймеров) может быть успешно использован для обнаружения мутаций в гене TP53, который кодирует белок-супрессор опухоли p53, в клинических образцах рака молочной железы и яичников. Оба эти исследования подчеркнули тот факт, что изменения профиля плавления могут иметь форму смещения температуры плавления или явного различия в форме кривой плавления. Оба этих параметра являются функцией последовательности ампликона.
Все согласны с тем, что HRM является экономически эффективным методом, который можно использовать в качестве первоначального скрининга образцов, подозреваемых в наличии полиморфизма или мутаций. Это позволит сократить количество образцов, которые необходимо дополнительно исследовать с использованием более традиционных методов.
Тестирование на зиготность
[ редактировать ]В настоящее время существует множество методов, используемых для определения статуса зиготности гена в определенном локусе. Эти методы включают использование ПЦР со специально разработанными зондами для обнаружения вариантов генов (типирование SNP является самым простым случаем). В случаях, когда речь идет о более длительных вариациях, может потребоваться пост-ПЦР-анализ ампликонов. Можно измерить изменения в рестрикции ферментов, электрофоретических и хроматографических профилях. Эти методы обычно требуют больше времени и повышают риск загрязнения ампликонов в лаборатории из-за необходимости работать с высокими концентрациями ампликонов в лаборатории после ПЦР. Использование HRM сокращает время, необходимое для анализа, и риск загрязнения. HRM является более экономичным решением, а элемент с высоким разрешением не только позволяет определять гомо- и гетерозиготность , но также разрешает информацию о типе гомо- и гетерозиготности, при этом разные варианты генов приводят к разным формам кривой плавления. Исследование Gundry et al. 2003, [ 6 ] показали, что флуоресцентное мечение одного праймера (в паре) оказалось более предпочтительным по сравнению с использованием интеркалирующего красителя, такого как SYBR green I. Однако достигнут прогресс в разработке и использовании улучшенных интеркалирующих красителей. [ 7 ] которые уменьшают проблему ингибирования ПЦР и опасений по поводу ненасыщающей интеркаляции красителя.
Эпигенетика
[ редактировать ]Методология HRM также использовалась для обеспечения надежного анализа статуса метилирования ДНК. Это важно, поскольку изменения статуса метилирования генов-супрессоров опухолей, генов, которые регулируют апоптоз и репарацию ДНК, являются характеристиками рака и также влияют на реакцию на химиотерапию. Например, больные раком могут быть более чувствительны к лечению агентами, алкилирующими ДНК , если промотор гена репарации ДНК MGMT пациента метилирован. В исследовании, в котором проверялся статус метилирования промотора MGMT на 19 образцах колоректального кишечника, 8 образцов оказались метилированными. [ 8 ] В другом исследовании сравнивалась прогностическая сила метилирования промотора MGMT у 83 пациентов с глиомой высокой степени злокачественности, полученная с помощью MSP , пиросеквенирования и HRM. Было обнаружено, что метод HRM по крайней мере эквивалентен пиросеквенированию при количественном определении уровня метилирования. [ 9 ]
Метилированную ДНК можно лечить путем бисульфитной модификации, которая превращает неметилированные цитозины в урацил . Следовательно, продукты ПЦР, полученные на основе изначально неметилированной матрицы, будут иметь более низкую температуру плавления, чем продукты, полученные на основе метилированной матрицы. HRM также дает возможность определить долю метилирования в данном образце путем сравнения ее со стандартной кривой, которая создается путем смешивания различных соотношений метилированной и неметилированной ДНК. Это может дать информацию о степени метилирования, которую может иметь опухоль, и, таким образом, дать представление о характере опухоли и о том, насколько далеко она отклоняется от «нормы».
HRM также практически выгоден для использования в диагностике из-за его способности адаптироваться к высокопроизводительному скрининговому тестированию, и, опять же, он сводит к минимуму возможность распространения и загрязнения ампликонов внутри лаборатории благодаря формату закрытой пробирки.
Интеркалирующие красители
[ редактировать ]Чтобы проследить за переходом от дцДНК (двухцепочечной) к оцДНК (одноцепочечной), используются интеркалирующие красители. Эти красители демонстрируют различную флуоресцентную эмиссию, зависящую от их связи с двухцепочечной или одноцепочечной ДНК. SYBR Green I — краситель первого поколения для HRM. Он флуоресцирует при интеркаляции в дцДНК, а не в оцДНК. Поскольку он может ингибировать ПЦР в высоких концентрациях, его используют в концентрациях ниже насыщения. В последнее время некоторые исследователи не рекомендуют использовать SYBR Green I для управления человеческими ресурсами. [ 10 ] утверждая, что необходимы существенные изменения протокола. Это связано с тем, что предполагается, что недостаточная точность может быть результатом «прыжка красителя», когда краситель из расплавленного дуплекса может повторно включиться в области дцДНК, которые еще не расплавились. [ 6 ] [ 10 ] Новые насыщающие красители, такие как LC Green и LC Green Plus, ResoLight, EvaGreen, Chromofy и SYTO 9, доступны на рынке и успешно используются для HRM. Однако некоторые группы успешно использовали SYBR Green I для управления человеческими ресурсами с инструментами Corbett Rotorgene. [ 11 ] и пропагандировать использование SYBR Green I для приложений HRM.
Разработка экспериментов по плавлению с высоким разрешением
[ редактировать ]Анализы плавления с высоким разрешением обычно включают амплификацию кПЦР с последующим построением кривой плавления с использованием флуоресцентного красителя. Из-за чувствительности анализа плавления с высоким разрешением необходимо тщательно учитывать условия циклирования ПЦР, качество матричной ДНК и параметры кривой плавления. [ 12 ] Для получения точных и воспроизводимых результатов условия термоциклирования ПЦР должны быть оптимизированы, чтобы гарантировать, что желаемая область ДНК амплифицируется с высокой специфичностью и минимальным смещением между вариантами последовательностей. Кривая плавления обычно строится в широком диапазоне температур с небольшими (~ 0,3 ° C) приращениями, которые достаточно длинные (~ 10 секунд), чтобы ДНК достигла равновесия на каждом температурном этапе.
Помимо типичных соображений по разработке праймеров , разработка праймеров для анализов плавления с высоким разрешением предполагает максимизацию термодинамических различий между продуктами ПЦР, принадлежащими к разным генотипам. Ампликоны меньшего размера обычно дают большее изменение температуры плавления, чем более длинные ампликоны, но эту изменчивость невозможно предсказать на глаз. По этой причине крайне важно точно предсказать кривую плавления продуктов ПЦР при разработке праймеров, которые будут различать варианты последовательностей. Специальное программное обеспечение, например uMelt. [ 13 ] и дизайнерские подписи , [ 14 ] доступны для помощи в разработке праймеров, которые максимизируют вариабельность кривой плавления специально для анализов плавления с высоким разрешением.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Академическую трактовку истории HRM см. http://www.dna.utah.edu/Hi-Res/TOP_Hi-Res%20Melting.html. Архивировано 13 декабря 2009 г. в Wayback Machine.
- ^ С. Тейлор и др., 2010. Практическое руководство по генотипированию анализа расплава с высоким разрешением. Техническое примечание BioRad 6004.
- ^ Пасай С., Арлиан Л., Морган М. и др. (март 2008 г.). «Анализ расплава высокого разрешения для обнаружения мутации, связанной с устойчивостью к перметрину, в популяции чесоточных клещей». Мед. Ветеринар. Энтомол . 22 (1): 82–8. дои : 10.1111/j.1365-2915.2008.00716.x . ПМИД 18380658 . S2CID 41493770 .
- ^ Джеймс П.А., Доэрти Р., Харрис М. и др. (февраль 2006 г.). «Оптимальный отбор людей для тестирования мутаций BRCA: сравнение доступных методов» . Дж. Клин. Онкол . 24 (4): 707–15. дои : 10.1200/JCO.2005.01.9737 . ПМИД 16446345 .
- ^ Крипуй М., Ахмед А.А., Этемадмогадам Д. и др. (2007). «Плавление высокого разрешения для сканирования мутаций экзонов 5-8 TP53» . БМК Рак . 7 : 168. дои : 10.1186/1471-2407-7-168 . ПМК 2025602 . ПМИД 17764544 .
- ^ Jump up to: а б Гандри К.Н., Вандерстин Дж.Г., Рид Г.Х., Прайор Р.Дж., Чен Дж., Виттвер К.Т. (март 2003 г.). «Анализ плавления ампликонов с мечеными праймерами: метод закрытой пробирки для дифференциации гомозигот и гетерозигот» . Клин. Хим . 49 (3): 396–406. дои : 10.1373/49.3.396 . ПМИД 12600951 .
- ^ Виттвер Коннектикут, Рид Г.Х., Гандри К.Н., Вандерстин Дж.Г., Прайор Р.Дж. (июнь 2003 г.). «Генотипирование высокого разрешения путем анализа плавления ампликонов с использованием LCGreen» . Клин. Хим . 49 (6, часть 1): 853–60. дои : 10.1373/49.6.853 . ПМИД 12765979 .
- ^ Войдач Т.К., Добрович А. (2007). «Плавление с высоким разрешением, чувствительное к метилированию (MS-HRM): новый подход к чувствительной и высокопроизводительной оценке метилирования» . Нуклеиновые кислоты Рез . 35 (6): е41. дои : 10.1093/нар/gkm013 . ПМЦ 1874596 . ПМИД 17289753 .
- ^ Свитцени, Оливье Дж.; Кристманн, Маркус; Ренованц, Мирьям; Гизе, Альф; Соммер, Клеменс; Кайна, Бернд (5 мая 2016 г.). «Метилирование промотора MGMT, определяемое с помощью HRM в сравнении с MSP и пиросеквенированием для прогнозирования ответа глиомы высокой степени» . Клиническая эпигенетика . 8 : 49. дои : 10.1186/s13148-016-0204-7 . ISSN 1868-7083 . ПМЦ 4858829 . ПМИД 27158275 .
- ^ Jump up to: а б Рид Г.Х., Кент Дж.О., Виттвер, Коннектикут (июнь 2007 г.). «Анализ плавления ДНК высокого разрешения для простой и эффективной молекулярной диагностики». Фармакогеномика . 8 (6): 597–608. дои : 10.2217/14622416.8.6.597 . ПМИД 17559349 . как PDF
- ^ Порнпрасерт С., Пхусуа А., Суанта С., Сэтунг Р., Сангуансермсри Т. (июнь 2008 г.). «Обнаружение альфа-талассемии-1 типа Юго-Восточной Азии с использованием гэп-ПЦР в реальном времени с SYBR Green1 и анализа плавления с высоким разрешением». Евро. Дж. Гематол . 80 (6): 510–4. CiteSeerX 10.1.1.509.2403 . дои : 10.1111/j.1600-0609.2008.01055.x . ПМИД 18284625 . S2CID 20502526 .
- ^ Монтгомери Дж.Л., Сэнфорд Л.Н., Виттвер, Коннектикут (2010). «Анализ плавления ДНК высокого разрешения в клинических исследованиях и диагностике». Эксперт преподобный Мол Диагн . 10 (2): 219–240. doi : 10.1586/erm.09.84 . ПМИД 20214540 . S2CID 22170964 .
- ^ Дуайт З., Пале Р., Виттвер, Коннектикут (2011). «uMELT: прогнозирование кривых плавления с высоким разрешением и динамических профилей плавления продуктов ПЦР в богатом веб-приложении» . Биоинформатика . 27 (7): 1019–1020. doi : 10.1093/биоинформатика/btr065 . ПМИД 21300699 .
- ^ Райт Э.С., Вецигян К.Х. (2016). «DesignSignatures: инструмент для разработки праймеров, позволяющий получать ампликоны с разными сигнатурами» . Биоинформатика . 32 (10): 1565–1567. doi : 10.1093/биоинформатика/btw047 . ПМИД 26803162 .