Контрольная точка повреждения ДНК G2-M

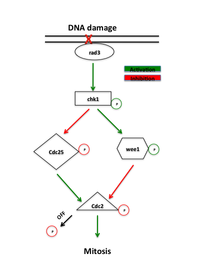
Контрольная точка G 2 повреждения ДНК -M является важной контрольной точкой клеточного цикла в эукариотических организмах, которая гарантирует, что клетки не инициируют митоз до тех пор, пока поврежденная или неполностью реплицированная ДНК не будет достаточно восстановлена. Клетки с дефектной контрольной точкой G 2 -M подвергнутся апоптозу или гибели после клеточного деления, если они войдут в фазу М до восстановления своей ДНК. [1] Определяющей биохимической особенностью этой контрольной точки является активация М-фазы комплексов циклин-CDK , которые фосфорилируют белки, способствующие сборке веретена и переводящие клетку в метафазу . [2]
Активность циклина B-CDK 1
[ редактировать ]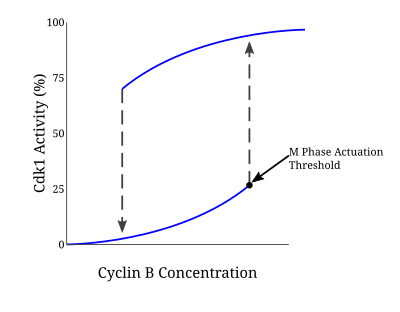
Клеточный цикл управляется белками, называемыми циклин-зависимыми киназами , которые связываются с регуляторными белками циклина на различных контрольных точках клеточного цикла. На разных фазах клеточного цикла происходит активация и/или деактивация специфических комплексов циклин-CDK.
Активность CyclinB-CDK1 специфична для контрольной точки G2/M. Накопление циклина B увеличивает активность циклинзависимой киназы Cdk1, человеческого гомолога Cdc2, поскольку клетки готовятся к вступлению в митоз. Активность Cdc2 дополнительно регулируется фосфорилированием / дефосфорилированием соответствующих активаторов и ингибиторов. Посредством петли положительной обратной связи CyclinB-Cdc2 активирует фосфатазу Cdc25 , которая, в свою очередь, деактивирует ингибиторы CyclinB-Cdc2, Wee1 и Myt1. Cdc25 активирует комплекс за счет удаления фосфатов из активного центра, тогда как Wee1 инактивирует комплекс за счет фосфорилирования остатков тирозина, в частности тирозина-15. [3]
Эта петля дополнительно усиливается косвенно за счет скоординированного взаимодействия киназы Aurora A и кофактора Bora. Во время фазы G2 Бора накапливается и образует активационный комплекс с Авророй А. Этот комплекс затем регулирует активацию Поло-подобной киназы 1 (Plk1). Plk1 фосфорилирует Wee1, направляя его на деградацию через убиквитинлигазный комплекс SCF ( комплекс SCF ), и активирует Cdc25 посредством фосфорилирования с комбинированным действием, активирующим Cdc2. Совместная активность и комплекс Cdc2, Cdc25 и Plk1 с накоплением циклина B активирует комплекс CyclinB-Cdc2, способствуя вступлению в митоз. [4]
Многие белки, участвующие в этой петле положительной обратной связи, управляют активацией комплекса CyclinB-Cdc2, поскольку вступление в митоз требует ответа «все или ничего». Модель Новака-Тайсона — это математическая модель, используемая для объяснения такой регуляторной петли, которая предсказывает необратимый переход в митоз, вызванный гистерезисом. [5] В ходе экспериментов с Xenopus laevis бесклеточными экстрактами яиц такая модель была подтверждена как основа для вступления в митоз. Как только концентрация циклина достигает определенного минимального порога активации, Cdc2 быстро активируется. Он остается в этом состоянии до тех пор, пока активность не упадет ниже отдельного порога инактивации, при котором он резко инактивируется посредством фосфорилирования тирозина с помощью Wee1 и Myt1. В случае нереплицированной ДНК порог концентрации циклина для активации Cdc2 еще больше увеличивается. Благодаря этому механизму существуют два отдельных устойчивых состояния, разделенных нестабильным устойчивым состоянием. Бистабильная и гистерезисная природа CyclinB-Cdc2 обеспечивает строго регулируемый характер контрольной точки G2/M. [6]
Реакция пути на повреждение ДНК
[ редактировать ]Белки, которые локализуются в местах повреждения ДНК в фазе G2, инициируют сигнальный каскад, который регулирует важные компоненты пути, как описано выше, тем самым контролируя вход в митоз посредством активности CyclinB-Cdc2. Негативная регуляция активности CyclinB-Cdc2 приводит к задержке вступления в митоз, что важно для клеток для восстановления любых повреждений ДНК, которые могли накопиться после S-фазы и необходимы для продолжения деления клеток.
Белки, которые функционируют в контрольной точке G2-M, первоначально были идентифицированы при скрининге дрожжей, который искал мутанты, демонстрирующие повышенную чувствительность к радиации, называемые «радными» мутантами. [1] Неэффективная репарация ДНК, поврежденной ионизирующей радиацией или химическими агентами у этих мутантов, выявила белки, необходимые для этого пути. Ранние сигнальные белки пути контрольных точек являются членами семейства фосфатидилинозитол-3-киназ, rad3 у дрожжей и ATR у позвоночных, которые, как полагают, локализуются в участках повреждения ДНК. [7] Rad3 фосфорилирует rad26, который необходим для инициирования, но не поддержания контрольной точки. Rad3 также фосфорилирует ряд других белков, отсутствие которых отменяет репарацию ДНК контрольных точек, включая rad1, rad9, hus1 и rad17. [1] Была выдвинута гипотеза, что rad9, hus1 и rad17 подобны белкам, участвующим в формировании зажима, повышающего процессивность ДНК -полимеразы во время репликации ДНК . [8] В соответствии с этой идеей, rad17 подобен белкам, участвующим в загрузке зажима на ДНК. Это подтверждает модель, согласно которой фосфорилирование с помощью rad3 вызывает рекрутирование этих белков в места повреждения ДНК, где они опосредуют активность ДНК-полимераз, участвующих в репарации ДНК . [1]
Основным эффектором rad3 является киназа Chk1 , которая необходима для ареста G2-M в ответ на агенты, повреждающие ДНК. [9] Chk1 представляет собой эффекторную протеинкиназу, которая поддерживает митотический циклин в неактивном состоянии и фосфорилируется с помощью rad3 между S-фазой и митозом, что указывает на ее специфическую роль в аресте G2. [10] Его активация посредством сверхэкспрессии может вызвать арест независимо от повреждения ДНК. [11] Кроме того, сверхэкспрессия Chk1 спасает радиационную чувствительность rad-мутантов, по-видимому, позволяя репарации ДНК произойти до вступления в митоз. [7]
Наличие повреждения ДНК запускает пути ATM (мутированная телеангиэктазия атаксии) или ATR (атаксия телеангиэктазия и связанная с Rad3) пути, которые активируют киназы Chk2 и Chk1 соответственно. Эти киназы действуют выше Cdc25 и Wee1, прямых регуляторов комплекса CyclinB-Cdc2. Chk1 и Chk2 фосфорилируют Cdc25, ингибируя его фосфорилирующую активность и отмечая его убиквитинированную деградацию. [11] [12] Эти пути также стимулируют супрессор опухоли р53 . p53 регулирует функцию ингибитора Cdk2 p21 и белков 14-3-3 , которые фосфорилируют (и тем самым инактивируют) и изолируют Cdc25 в цитоплазме соответственно. [13] Недавние исследования также показали, что Cdk1 и 14-3-3 позитивно регулируют Wee1 аналогичным образом. Гиперфосфорилирование Wee1 с помощью Cdk1 позволяет связывать 14-3-3, изолируя Wee1 в ядре и повышая его способность фосфорилировать Cdc2. [14] Фосфорилирование Wee1 и Cdc25 предотвращает активацию Cdc2. [12]
Путь ATM/ATR также приводит к негативной регуляции Plk1, что способствует стабильности Wee1. Стабилизация Wee1 и Myt1 обеспечивает арест клеток в G2 и позволяет восстановить ДНК. [13] [15]
В ответе на контрольную точку задействовано множество путей, и, таким образом, нацеливание на Cdc25 не является единственным механизмом, лежащим в основе задержки клеточного цикла, как предполагают некоторые модели. Кооперативность . между позитивной регуляцией Wee1 и негативной регуляцией Cdc25 с помощью Chk1 в ответ на нереплицированную или поврежденную ДНК приводит к сильному аресту G2 [1] [11] [13] [15] Увеличение количества Wee1 и уменьшение количества Cdc25 способствует повышению порога концентрации циклина B в петле гистерезиса, необходимого для перевода клетки в митоз.
Обслуживание КПП
[ редактировать ]Rad3 необходим для активации Chk1 и инициации ареста G2, но считается, что различные белки поддерживают арест G2, чтобы могла произойти достаточная репарация ДНК. Одним из таких белков является rad18 , который необходим для ареста G2, даже когда Chk1 фосфорилирован и активен. Таким образом, rad18 требуется для обслуживания контрольной точки G2/M, а Chk1 требуется для инициирования контрольной точки. [16] Это также подтверждается его дополнительной функцией в репарации ДНК, в частности в поддержании хромосомных структур. Ее необходимость подтверждается тем фактом, что в отсутствие rad18 ДНК не может быть восстановлена, даже если арест G2 продлевается другими способами.
Поддержание такого ареста в фазе G2 дополнительно поддерживается p53 и p21. Было продемонстрировано, что в отсутствие p53 или p21 облученные клетки переходят в митоз. [17] Отсутствие p21 или 14-3-3 не может в достаточной степени ингибировать комплекс CyclinB-Cdc2, тем самым демонстрируя регуляторный контроль p53 и p21 в контрольной точке G2 в ответ на повреждение ДНК. [12] Мутации р53 могут привести к значительному дефициту контрольных точек, что имеет важные последствия при лечении рака.
Деактивация контрольной точки
[ редактировать ]Инактивация Wee1 и Cdc25 отменяет контрольную точку повреждения ДНК G2-M. Отсутствие Wee1 или удаление сайта тирозина-15 устраняет негативную регуляцию активности Cdc2 и заставляет клетки вступать в митоз без завершения восстановления, что эффективно отменяет контрольную точку G2-M. [18] Отсутствие Cdc25 арестовывает клетки в G2, но все же позволяет активировать контрольную точку G2-M, подразумевая, что как активация Wee1, так и деактивация Cdc25 являются важными регуляторными этапами в контрольной точке. [11]
Инактивации Chk1 достаточно, чтобы преодолеть контрольную точку и способствовать вступлению в митоз, независимо от того, устранено ли повреждение ДНК. Тем не менее, мало что еще известно о точном механизме терминации контрольных точек с возможными механизмами, включая протеинфосфатазы, обращающие активирующее фосфорилирование, целевую деградацию убиквитина активирующих белков и антагонисты контрольных точек, способствующие митозу независимыми путями. [10]
Рак
[ редактировать ]Было обнаружено, что многие регуляторы клеточного цикла, такие как Cdks, циклины и p53, имеют аномальную экспрессию при раке. Более конкретно, они участвуют в переходе G2/M путем локализации в центросоме, что, таким образом, приводит к исследованиям по манипулированию такими белками с целью улучшения чувствительности рака к радиации и химиотерапии. [13] Chk1 имеет важное значение для нацеливания лекарств против рака, поскольку его функция действует в ответ на повреждение ДНК. Цитотоксические эффекты химиотерапии в настоящее время изучаются при модуляции перехода G2/M, как в отношении отмены контрольной точки, так и в отношении ее остановки. [19] Многие методы лечения направлены на инактивацию контрольной точки, чтобы заставить клетки с избыточным повреждением ДНК пройти митоз и вызвать клеточную смерть. [12]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Каддихи, Эндрю Р.; О'Коннелл, Мэтью Дж. (2003). «Реакция клеточного цикла на повреждение ДНК в G2». Международный обзор цитологии . 222 : 99–140. дои : 10.1016/s0074-7696(02)22013-6 . ISBN 9780123646262 . ISSN 0074-7696 . ПМИД 12503848 .
- ^ Морган, Дэвид Оуэн (2007). Клеточный цикл: принципы управления . Лондон: New Science Press. ISBN 978-0-19-920610-0 . ОСЛК 70173205 .
- ^ Гулд, КЛ; Медсестра, П. (1989). «Тирозиновое фосфорилирование протеинкиназы cdc2+ делящихся дрожжей регулирует вступление в митоз». Природа . 342 (6245): 39–45. Бибкод : 1989Natur.342...39G . дои : 10.1038/342039a0 . ПМИД 2682257 . S2CID 4287870 .
- ^ Секи, А.; Коппингер, Дж.А.; Джанг, К.-Ю.; Йейтс, младший; Фанг, Г. (20 июня 2008 г.). «Бора и киназа Aurora A совместно активируют киназу Plk1 и контролируют вход в митоз» . Наука . 320 (5883): 1655–1658. Бибкод : 2008Sci...320.1655S . дои : 10.1126/science.1157425 . ПМЦ 2834883 . ПМИД 18566290 .
- ^ Новак, Б.; Тайсон, Джей-Джей (1993). «Численный анализ комплексной модели контроля М-фазы в экстрактах ооцитов Xenopus и интактных эмбрионах». Журнал клеточной науки . 106 (4): 1153–1168. дои : 10.1242/jcs.106.4.1153 . ПМИД 8126097 .
- ^ Ша, Вэй; и др. (сентябрь 2002 г.). «Гистерезис управляет переходами клеточного цикла в экстрактах яиц Xenopus laevis» . Труды Национальной академии наук . 100 (3): 975–980. Бибкод : 2003PNAS..100..975S . дои : 10.1073/pnas.0235349100 . ПМК 298711 . ПМИД 12509509 .
- ^ Jump up to: а б Аль-Ходайри, Ф.; Карр, AM (1992). «Мутанты репарации ДНК, определяющие пути контрольной точки G2 у Schizosaccharomyces pombe» . Журнал ЭМБО . 11 (4): 1343–1350. дои : 10.1002/j.1460-2075.1992.tb05179.x . ПМК 556583 . ПМИД 1563350 .
- ^ Телен, член парламента; Венцловас, К.; Фиделис, К. (1999). «Модель скользящего зажима для белков контрольных точек клеточного цикла семейства Rad1» . Клетка . 96 (6): 769–770. дои : 10.1016/s0092-8674(00)80587-5 . ПМИД 10102265 .
- ^ Уолворт, Н.; Дэйви, С.; Бич, Д. (1993). «Протеинкиназа chkl делящихся дрожжей связывает путь контрольной точки радиации с cdc2». Природа . 363 (6427): 368–371. Бибкод : 1993Natur.363..368W . дои : 10.1038/363368a0 . ПМИД 8497322 . S2CID 4312997 .
- ^ Jump up to: а б Калонж, ТМ; О'Коннелл, MJ (2007). «Отключение контрольной точки повреждения ДНК G2» . Репарация ДНК (Амст) . 7 (2): 136–140. дои : 10.1016/j.dnarep.2007.07.017 . ПМК 2233850 . ПМИД 17851138 .
- ^ Jump up to: а б с д Роли, Дж. М.; О'Коннелл, MJ (2000). «Проверка повреждения ДНК G(2) нацелена как на Wee1, так и на Cdc25» . Журнал клеточной науки . 113 (10): 1727–1736. дои : 10.1242/jcs.113.10.1727 . ПМИД 10769204 .
- ^ Jump up to: а б с д Морган, Дэвид (2007). Принципы контроля клеточного цикла . Новая научная пресса. стр. 227–245.
- ^ Jump up to: а б с д Ван, Ю.; Джи, П.; Лю, Дж.; Броддус, РР; Сюэ, Ф.; Чжан, В. (2009). «Связанные с центросомами регуляторы контрольной точки G2 / M как мишени для терапии рака» . Молекулярный рак . 8 (1): 8. дои : 10.1186/1476-4598-8-8 . ПМК 2657106 . ПМИД 19216791 .
- ^ Ли, Дж.; Кумагай, А.; Данфи, WG (2001). «Положительная регуляция Wee1 белками Chk1 и 14-3-3» . Молекулярная биология клетки . 12 (3): 551–563. дои : 10.1091/mbc.12.3.551 . ПМК 30963 . ПМИД 11251070 .
- ^ Jump up to: а б Харпер, Дж.В.; Элледж, SJ (декабрь 2007 г.). «Реакция на повреждение ДНК: десять лет спустя» . Молекулярная клетка . 28 (5): 739–745. doi : 10.1016/j.molcel.2007.11.015 . ПМИД 18082599 .
- ^ Веркаде, HM; Багг, С.Дж.; Линдси, HD; Карр, AM; О'Коннелл, MJ (1999). «Rad18 необходим для восстановления ДНК и реакций контрольных точек у делящихся дрожжей» . Молекулярная биология клетки . 10 (9): 2905–2918. дои : 10.1091/mbc.10.9.2905 . ПМК 25529 . ПМИД 10473635 .
- ^ Бунц, Ф.; Дютрио, А.; Ленгауэр, К.; Уолдман, Т.; Чжоу, С.; Браун, JP; Седиви, Дж. М.; Кинцлер, К.В.; Вольгештейн, Б. (1998). «Требование к p53 и p21 для поддержания ареста G2 после повреждения ДНК». Наука . 282 (5393): 1497–1501. дои : 10.1126/science.282.5393.1497 . ПМИД 9822382 .
- ^ Лундгрен, К.; Уолворт, Н.; Бухер, Р.; Дембски, М.; Киршнер, М.; Бич, Д. (1991). «Mik1 и wee1 взаимодействуют в ингибирующем фосфорилировании тирозина cdc2». Клетка . 64 (6): 1111–1122. дои : 10.1016/0092-8674(91)90266-2 . ПМИД 1706223 . S2CID 36864093 .
- ^ ДиПаола, Р.С. (2002). «Арестовать или не арестовывать клеточный цикл G2-M». Клинические исследования рака . 8 (11): 3311–3314.