Асимметричное дигидроксилирование Шарплесса
| Асимметричное дигидроксилирование Шарплесса | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Назван в честь | Карл Барри Шарплесс | ||||||||||
| Тип реакции | Реакция присоединения | ||||||||||
| Реакция | |||||||||||
| |||||||||||
| Идентификаторы | |||||||||||
| Портал органической химии | Шарплесс-дигидроксилирование | ||||||||||
| RSC Идентификатор онтологии | RXNO: 0000142 | ||||||||||
Асимметричное дигидроксилирование Шарплесса также называемое бисгидроксилированием Шарплесса ) — это химическая реакция алкена ( с тетроксидом осмия в присутствии хирального хининового лиганда с образованием вицинального диола . Реакция применялась к алкенам практически любого замещения, часто реализуется высокая энантиоселективность , при этом хиральный результат контролируется выбором дигидрохинидина (DHQD) или дигидрохинина (DHQ) в качестве лиганда. Реакции асимметричного дигидроксилирования также обладают высокой сайт-селективностью, обеспечивая продукты, полученные в результате реакции наиболее богатой электронами двойной связи в субстрате. [1] [2] [3]

R L = наибольший заместитель; R M = заместитель среднего размера; R S = наименьший заместитель
Обычно эту реакцию проводят с использованием каталитического количества тетроксида осмия, который после реакции регенерируется с помощью реокислителей, таких как феррицианид калия. [4] [5] или N -метилморфолин- N -оксид . [6] [7] Это резко снижает количество необходимого высокотоксичного и очень дорогого четырехокиси осмия. Эти четыре реагента коммерчески доступны в предварительно смешанном виде (« AD-mix »). Смесь, содержащая (DHQ) 2 -PHAL, называется AD-mix-α, а смесь, содержащая (DHQD) 2- PHAL, называется AD-mix-β. [8]
Такие хиральные диолы важны в органическом синтезе . Введение хиральности в нехиральные реагенты посредством использования хиральных катализаторов — важная концепция органического синтеза . Эта реакция была разработана главным образом К. Барри Шарплессом на основе уже известного рацемического дигидроксилирования Апджона , за которое он был удостоен части Нобелевской премии по химии 2001 года .
Фон
[ редактировать ]Дигидроксилирование алкенов тетроксидом осмия — старый и чрезвычайно полезный метод функционализации олефинов. Однако поскольку реагенты осмия(VIII), такие как четырехокись осмия (OsO 4 ), дороги и чрезвычайно токсичны, стало желательным разработать каталитические варианты этой реакции. Некоторые стехиометрические концевые окислители, которые использовались в этих каталитических реакциях, включают хлорат калия , перекись водорода ( гидроксилирование по Миласу ), N -метилморфолина N -оксид (NMO, дигидроксилирование по Апджону ), трет- гидропероксид бутила ( t BHP) и феррицианид калия (K 3 Fe(CN) 6 ). К. Барри Шарплесс был первым, кто разработал общий и надежный метод энантиоселективного дигидроксилирования алкенов, называемый асимметричным дигидроксилированием Шарплесса (SAD). Низкие уровни OsO 4 в сочетании со стехиометрическим феррицианидным окислителем в присутствии хиральных азотистых лигандов создают асимметричную среду вокруг окислителя.
Механизм реакции
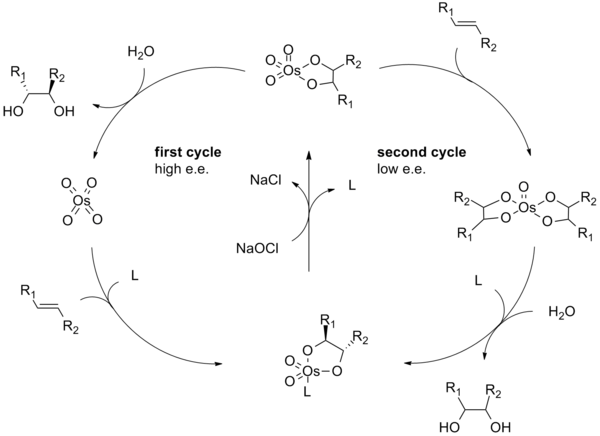
[ редактировать ]Механизм реакции дигидроксилирования Шарплесса начинается с образования комплекса тетраоксид осмия – лиганд ( 2 ). [3+2]-циклоприсоединение к алкену ( 3 ) дает циклическое промежуточное соединение 4 . [9] [10] Основной гидролиз высвобождает диол ( 5 ) и восстановленный осмат ( 6 ). Метансульфонамид (CH 3 SO 2 NH 2 ) был идентифицирован как катализатор для ускорения этой стадии каталитического цикла и часто используется в качестве добавки, позволяющей неконцевым алкеновым субстратам эффективно реагировать при 0 ° C. [8] Наконец, стехиометрический окислитель регенерирует комплекс тетраоксид осмия – лиганд ( 2 ).

Механизм асимметричного дигидроксилирования Шарплесса был тщательно изучен, и был идентифицирован потенциальный вторичный каталитический цикл (см. Ниже). [11] [12] Если промежуточный эфир осмилатного эфира окисляется до того, как он диссоциирует, то образуется комплекс осмий (VIII)-диол, который затем может дигидроксилировать другой алкен. [13] Дигидроксилирования, возникающие в результате этого вторичного пути, обычно имеют более низкую энантиоселективность, чем те, которые происходят в результате первичного пути. Схема, показывающая этот вторичный каталитический путь, показана ниже. Этот вторичный путь можно подавить, используя более высокую молярную концентрацию лиганда.
Дебаты [2+2] против [3+2]
[ редактировать ]В своем первоначальном отчете Шарплесс предположил, что реакция протекает через [2+2] циклоприсоединение OsO 4 к алкену с образованием промежуточного осмаоксетана (см. ниже). [14] Это промежуточное соединение затем подвергнется мигрирующей 1,1-вставке с образованием осмилатного эфира, который после гидролиза даст соответствующий диол. В 1989 году Э. Дж. Кори опубликовал несколько иной вариант этой реакции и предположил, что реакция, скорее всего, протекает через [3+2] циклоприсоединение OsO 4 к алкену с прямым образованием осмилатного эфира. [15] Предложение Кори было основано на предыдущем вычислительном исследовании, проведенном Йоргенсеном и Хоффманном, которое определило, что путь реакции [3+2] является путем с более низкой энергией. Вдобавок Кори предположил, что стерические отталкивания в октаэдрическом промежуточном соединении не благоприятствуют пути [2+2].
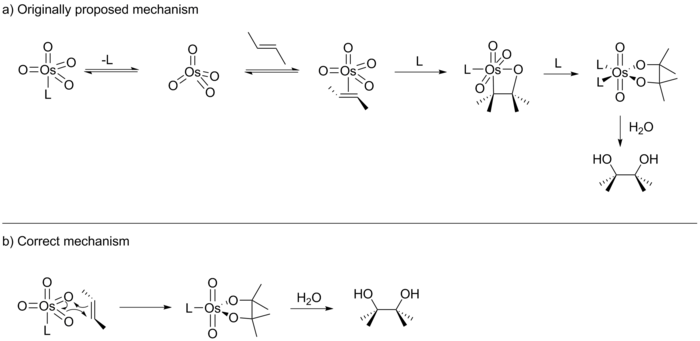
В следующие десять лет Кори и Шарплесс опубликовали множество публикаций, каждая из которых поддерживала свою версию механизма. Хотя эти исследования не смогли различить два предложенных пути циклизации, им удалось пролить свет на этот механизм другими способами. Например, Шарплесс предоставил доказательства того, что реакция протекает по ступенчатому механизму. [16] Кроме того, Шарплесс и Кори показали, что активный катализатор обладает U-образным хиральным карманом связывания. [17] [18] [19] Кори также показал, что катализатор подчиняется кинетике Михаэлиса-Ментен и действует как ферментный карман с предварительным равновесием. [20] В февральском номере журнала Американского химического общества за 1997 год Шарплес опубликовал результаты исследования (анализ Хэммета), которые, как он утверждал, подтверждают циклизацию [2+2] по сравнению с [3+2]. [21] Однако в октябрьском номере того же года Шарплесс также опубликовал результаты другого исследования, проведенного в сотрудничестве с Кеном Хоуком и Синглтоном, которое предоставило убедительные доказательства существования механизма [3+2]. [10] Таким образом, Шарплес был вынужден признать десятилетние дебаты.
Структура катализатора
[ редактировать ]
Кристаллографические данные показали, что активный катализатор содержит пятикоординированные частицы осмия, удерживаемые в U-образном связывающем кармане. Азотистый лиганд удерживает OsO 4 в хиральном окружении, что делает приближение одной стороны олефина стерически затрудненным, а другой - нет. [20]
Каталитические системы
[ редактировать ]Для САД разработано множество каталитических систем и модификаций. Ниже приведен краткий обзор различных компонентов каталитической системы:
- Каталитический окислитель: это всегда OsO 4 , однако некоторые добавки могут координироваться с осмием (VIII) и изменять его электронные свойства. OsO 4 часто образуется in situ из K 2 OsO 2 (OH) 4 (разновидность Os(VI)) из соображений безопасности.
- Хиральное вспомогательное вещество: обычно это какой-то алкалоид хинного дерева.
- Стехиометрический окислитель:
- Пероксиды были одними из первых стехиометрических окислителей, которые использовались в этом каталитическом цикле; см. гидроксилирование по Миласу . К недостаткам пероксидов относятся проблемы хемоселективности. [13]
- N-оксиды триалкиламмония, такие как NMO - как в реакции Апджона - и N-оксид триметиламина. [13]
- Феррицианид калия (K 3 Fe(CN) 6 ) является наиболее часто используемым стехиометрическим окислителем в реакции и входит в состав коммерчески доступных препаратов AD-смесей.
- Добавка:
- Лимонная кислота: тетраоксид осмия является электрофильным окислителем и поэтому медленно реагирует с олефинами с дефицитом электронов. Было обнаружено, что скорость окисления электронодефицитных олефинов можно ускорить, поддерживая слабокислый pH реакции. [13] С другой стороны, высокий pH может увеличить скорость окисления внутренних олефинов, а также увеличить энантиомерный избыток (э.и.) для окисления концевых олефинов. [13]
Региоселективность
[ редактировать ]В целом асимметричное дигидроксилирование Шарплесса способствует окислению более богатого электронами алкена (схема 1). [22]
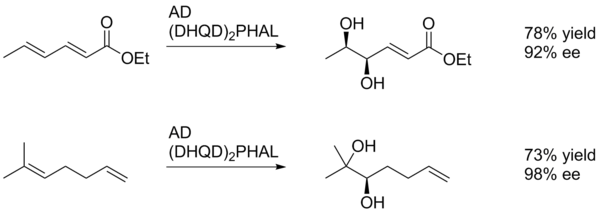
В этом примере SAD дает диол алкена, ближайшего к (электроноакцепторной) параметоксибензоильной группе, хотя и с низким выходом. Вероятно, это связано со способностью арильного кольца благоприятно взаимодействовать с активным центром катализатора посредством π-стэкинга. Таким образом, арильный заместитель может действовать как направляющая группа. [23]

Стереоселективность
[ редактировать ]Диастереоселективность SAD определяется в первую очередь выбором лиганда (т.е. AD-mix-α по сравнению с AD-mix-β), однако такие факторы, как ранее существовавшая хиральность в субстрате или соседних функциональных группах, также могут играть роль. В примере, показанном ниже, пара-метоксибензоильный заместитель служит в первую очередь источником стерического объема, позволяющего катализатору дифференцировать две стороны алкена. [23]

Часто бывает трудно добиться высокой диастереоселективности в отношении цис -дизамещенных алкенов, когда оба конца олефина имеют одинаковое стерическое окружение.
Дальнейшее чтение
[ редактировать ]- Якобсен, Э.Н.; Марко, И.; Мунгалл, штат Вашингтон; Шредер, Г.; Шарплесс, КБ (1988). «Асимметричное дигидроксилирование посредством катализа, ускоренного лигандами». Дж. Ам. хим. Соц. 110 (6): 1968–1970. дои : 10.1021/ja00214a053 .
См. также
[ редактировать ]- Асимметричное каталитическое окисление
- Милас гидроксилирование
- Дигидроксилирование Апджона
- Аминогидроксилирование Шарплесса
- Окисление Лемье-Джонсона - олефин в диол с последующим окислительным расщеплением с образованием двух альдегидов.
Ссылки
[ редактировать ]- ^ Ноэ, Марк С.; Летавич, Майкл А.; Сноу, Шери Л. (15 декабря 2005 г.). «Асимметричное дигидроксилирование алкенов». Орг. Реагировать. 66 (109): 109–625. дои : 10.1002/0471264180.или066.02 . ISBN 0471264180 .
- ^ Колб, ХК; Ван Ньювенце, MS; Шарплесс, КБ (1994). «Каталитическое асимметрическое дигидроксилирование». хим. Откр. 94 (8): 2483–2547. дои : 10.1021/cr00032a009 .
- ^ Гонсалес, Хавьер; Ауригемма, Кристина; Трусдейл, Ларри (2004). «Синтез (+)-(1S , 2R ) - и (-)-(1R , 2S ) -транс - 2-фенилциклогексанола посредством асимметричного дигидроксилирования Шарплесса (AD)» . Органические синтезы . 79 : 93. дои : 10.15227/orgsyn.079.0093 .
- ^ Минато, М.; Ямамото, К.; Цудзи, Дж. (1990). «Тетраоксид осмия катализирует вицинальное гидроксилирование высших олефинов с использованием иона гексацианоферрата (III) в качестве соокислителя». Дж. Орг. хим. 55 (2): 766–768. дои : 10.1021/jo00289a066 .
- ^ Ой, Р.; Шарплесс, КБ (1996). «3-[( 1S )-1,2-Дигидроксиэтил]-1,5-Дигидро-3Н - 2,4-бензодиоксепин» . Органические синтезы . 73 : 1. дои : 10.15227/orgsyn.073.0001 ; Сборник томов , т. 9, с. 251 .
- ^ ВанРхинен, В.; Келли, RC; Ча, Д.Ю. (1976). «Улучшенное каталитическое окисление OsO 4 олефинов до цис -1,2-гликолей с использованием оксидов третичных аминов в качестве окислителя». Тетраэдр Летт. 17 (23): 1973–1976. дои : 10.1016/s0040-4039(00)78093-2 .
- ^ Макки, Б.Х.; Гилхиани, генеральный директор; Шарплесс, КБ (1992). «( R , R )-1,2-Дифенил-1,2-этандиол (Стильбендиол)» . Органические синтезы . 70 : 47. дои : 10.15227/orgsyn.070.0047 ; Сборник томов , т. 9, с. 383 .
- ^ Jump up to: а б Шарплесс, КБ ; Амберг, Вилли; Беннани, Юсеф Л.; и др. (1992). «Асимметричное дигидроксилирование, катализируемое осмием: новый класс лигандов и улучшение процесса». Дж. Орг. хим. 57 (10): 2768–2771. дои : 10.1021/jo00036a003 .
- ^ Кори, Э.Дж .; Ноэ, MC; Гроган, MJ (1996). «Экспериментальное испытание путей [3+2]- и [2+2]-циклоприсоединения для дигидроксилирования олефинов бисхинным алкалоидом-OsO4 посредством кинетических изотопных эффектов». Тетраэдр Летт. 37 (28): 4899–4902. дои : 10.1016/0040-4039(96)01005-2 .
- ^ Jump up to: а б ДельМонте, Эй Джей; Халлер, Дж.; Хоук, КНДР ; Шарплесс, КБ ; Синглтон, Д.А.; Штрасснер, Т.; Томас, А.А. (1997). «Экспериментальные и теоретические кинетические изотопные эффекты для асимметричного дигидроксилирования. Доказательства, подтверждающие ограничивающее скорость «(3 + 2)» циклоприсоединение». Дж. Ам. хим. Соц. 119 (41): 9907–9908. дои : 10.1021/ja971650e .
- ^ Огино, Ю.; Чен, Х.; Квонг, Х.-Л.; Шарплесс, КБ (1991). «О сроках гидролиза/реокисления при катализируемом осмием асимметричном дигидроксилировании олефинов с использованием феррицианида калия в качестве реокислителя». Тетраэдр Летт . 3 (2): 3965–3968. дои : 10.1016/0040-4039(91)80601-2 .
- ^ Вай, Дж.С.М.; Марко, И.; Свендсен, Дж. Н.; Финн, МГ; Якобсен, Э.Н.; Шарплесс, К. Барри (1989). «Механистическое понимание приводит к значительному улучшению процесса асимметричного дигидроксилирования, катализируемого осмием». Дж. Ам. хим. Соц . 111 (3): 1123. doi : 10.1021/ja00185a050 .
- ^ Jump up to: а б с д и Сундермейер У., Доблер К., Беллер М. Последние разработки в области катализируемого осмием дигидроксилирования олефинов. Современные методы окисления. 2004 WILEY-VCH Verlag GmbH & Co. KGaA, Вайнхайм. ISBN 3-527-30642-0
- ^ Хентгес, Стивен Г.; Шарплесс, К. Барри (июнь 1980 г.). «Асимметричная индукция в реакции четырехокиси осмия с олефинами». Дж. Ам. хим. Соц. 102 (12): 4263. doi : 10.1021/ja00532a050 .
- ^ Кори, Э.Дж.; ДаСильва Жардин, Пол; Вирджил, Скотт; Юэнь, По Вай; Коннелл, Ричард Д. (декабрь 1989 г.). «Энантиоселективное вицинальное гидроксилирование концевых и E-1,2-дизамещенных олефинов хиральным комплексом четырехокиси осмия. Эффективная система управления и рациональная механистическая модель». Дж. Ам. хим. Соц. 111 (26): 9243. doi : 10.1021/ja00208a025 .
- ^ Томас, Г.; Шарплесс, КБ ACIEE 1993, 32, 1329
- ^ Кори, Э.Дж.; Ноу, Марк К. (декабрь 1993 г.). «Жесткий и высокоэнантиоселективный катализатор дигидроксилирования олефинов с использованием тетраоксида осмия проясняет причину энантиоспецифичности». Дж. Ам. хим. Соц. 26 (115): 12579. doi : 10.1021/ja00079a045 .
- ^ Колб, ХК; Андерсон, PG; Шарплесс, КБ (февраль 1994 г.). «К пониманию высокой энантиоселективности катализируемого осмием асимметричного дигидроксилирования (AD). 1. Кинетика». Дж. Ам. хим. Соц. 116 (1278): 1278. doi : 10.1021/ja00083a014 .
- ^ Кори, Э.Дж.; Ноэ, Марк С.; Саршар, Сепер (1994). «Рентгеноструктурные исследования предоставляют дополнительные доказательства того, что ферментоподобный карман связывания имеет решающее значение для энантиоселективного дигидроксилирования олефинов комплексами алкалоидов OsO4-бис-хинного дерева». Буквы тетраэдра . 35 (18): 2861. doi : 10.1016/s0040-4039(00)76644-5 .
- ^ Jump up to: а б Кори, Э.Дж.; Ноэ, MC (17 января 1996 г.). «Кинетические исследования предоставляют дополнительные доказательства того, что ферментоподобный карман связывания имеет решающее значение для высокой энантиоселективности в асимметричном дигидроксилировании олефинов, катализируемом алкалоидом бис-хинного алкалоида». Дж. Ам. хим. Соц. 118 (2): 319. дои : 10.1021/ja952567z .
- ^ Шарплесс, КБ; Гипсер, Андреас; Хо, Пуй Тонг; Колб, Хартмут К.; Кондо, Теруюки; Квонг, Хой-Лун; МакГрат, Доминик В.; Рубин, А. Эрик; Норрби, Пер-Ола; Гейбл, Кевин П.; Шарплесс, К. Барри (1997). «К пониманию высокой энантиоселективности в асимметричном дигидроксилировании, катализируемом осмием. 4. Электронные эффекты в осмилировании, ускоренном амином». Дж. Ам. хим. Соц. 119 (8): 1840. doi : 10.1021/ja961464t .
- ^ Сюй, Д.; Криспино, Джорджия; Шарплесс, КБ (сентябрь 1992 г.). «Селективное асимметрическое дигидроксилирование (АД) диенов». Дж. Ам. хим. Соц. 114 (19): 7570–7571. дои : 10.1021/ja00045a043 .
- ^ Jump up to: а б Кори, Э.Дж.; Гусман-Перес, Анхель; Ноу, Марк К. (ноябрь 1995 г.). «Применение механистической модели приводит к распространению асимметричного дигидроксилирования Шарплесса на аллильные 4-метоксибензоаты и конформационно родственные производные амина и гомоаллического спирта». Дж. Ам. хим. Соц. 117 (44): 10805–10816. дои : 10.1021/ja00149a003 .