Белок, взаимодействующий с глутаматными рецепторами
Белок, взаимодействующий с рецептором глутамата (GRIP), относится либо к семейству белков, которые связываются с рецептором глутамата , либо, в частности, к белку GRIP1 в этом семействе. Было показано, что белки семейства белков, взаимодействующих с глутаматными рецепторами (GRIP), взаимодействуют с GluR2 , общей субъединицей АМРА-рецептора . [1] Эта субъединица также взаимодействует с другими белками, такими как белок, взаимодействующий с C-киназой 1 ( PICK1 ) и чувствительный к N-этилмалеимиду слитый белок ( NSF ). Исследования начали выяснять его функцию; однако об этих белках еще многое предстоит узнать.
Открытие и история GRIP 1
[ редактировать ]
Открытие белка, взаимодействующего с глутаматными рецепторами (GRIP-1), произошло в результате наблюдения, что глутаматные рецепторы, такие как рецептор NMDA , группируются в синапсах. [2] Вскоре после этого наблюдения исследователи идентифицировали область С-концевой области рецепторов NMDA, названную мотивом tSXV, которая обладает способностью связываться с доменом PDZ белка PSD -95 . [3]
Исследования локализации рецепторов NMDA проложили путь к исследованиям не-NMDA-рецепторов, таких как рецепторы AMPA. Подобно рецепторам NMDA, было обнаружено, что рецепторы AMPA локализуются в синаптических окончаниях нейронов центральной нервной системы . [4] Используя антитела GFP ( зеленый флуоресцентный белок ), соответствующие белку GRIP, исследователи смогли использовать флуоресценцию для определения местоположения GRIP в нейронах гиппокампа. Затем использовали другое антитело GFP для мечения субъединицы GluR2 рецепторов AMPA. [4] С помощью иммуноцитохимии и сравнения расположения рецепторов GRIP и AMPA было установлено, что рецепторы GRIP и AMPA подвергаются совместной локализации в нейронах гиппокампа. [4] Эти результаты подтвердили первоначальную гипотезу о том, что белок GRIP играет важную роль в связывании АМРА-рецепторов с возбуждающими синапсами.
Структура GRIP содержит семь доменов PDZ и связывается с C-концом субъединицы GluR2 рецепторов AMPA. [4] Хотя количество доменов PDZ различно для белков PSD-95 и GRIP, домен PDZ является распространенным структурным мотивом в белках, который помогает опосредовать белок-белковые взаимодействия. [5] Аминокислотная последовательность рецептора AMPA, с которой связывается белок GRIP, представляет собой ESVKI. Консервативная аминокислота серин на С-конце рецепторов AMPA и NMDA позволяет предположить, что она играет важную роль в облегчении взаимодействия GRIP и PSD-95. [6]
Роль GRIP в велоспорте AMPAR
[ редактировать ]Рецепторы AMPA постоянно транспортируются между клеточной мембраной и внутриклеточным пространством, и первоначально считалось, что GRIP может быть ответственным за кластеризацию рецепторов AMPA в возбуждающем синапсе. [1] Хотя до сих пор неясна точная роль GRIP в этом трафике, похоже, что PICK1 более непосредственно отвечает за кластеризацию рецепторов AMPA на поверхности и что GRIP участвует в стабилизации рецепторов AMPA внутриклеточно. [7] Одно исследование показало, что когда взаимодействие между GluR2 и GRIP нарушается, не происходит изменений в поверхностной экспрессии АМРА-рецепторов или конститутивной интернализации АМРА-рецепторов. [8] Однако существует уменьшенное количество рецепторов, которые остаются интернализованными, когда цикличность рецепторов модифицируется применением AMPA-1. Соотношение возвращается к норме, когда происходит конститутивная рециркуляция, что позволяет предположить, что стабилизация внутриклеточных рецепторов имеет решающее значение только при интернализации, индуцированной AMPA. [8]
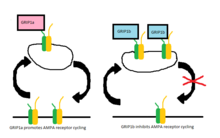
В более поздних исследованиях было обнаружено, что два белка, GRIP-1 (часто сокращенный до GRIP) и ABP-L (также называемый GRIP-2 ), экспрессируются двумя отдельными генами, и их соответствующий вклад в циклирование рецепторов AMPA с тех пор хорошо изучен. . Каждый из этих белков имеет разные изоформы из-за дифференциального сплайсинга РНК . [9] [10] Изоформы GRIP-1 называются GRIP-1a и GRIP-1b, тогда как изоформы ABP-L различаются как ABP-L и pABP-L. Очевидная разница в обоих случаях заключается в том, что одна изоформа (GRIP1b и pABP-L соответственно) способна конъюгироваться с пальмитиновой кислотой - действие, называемое пальмитоилированием .
Первоначально считалось, что GRIP участвует в стабилизации рецепторов AMPA либо на поверхности клетки, либо внутриклеточно, когда интернализация инициируется стимуляцией AMPA, теперь оказывается, что изоформы GRIP-1 по-разному участвуют в стабилизации рецепторов AMPA после интернализации. из-за стимуляции NMDA . [11] Было показано, что GRIP-1a снижает ожидаемые внутриклеточные уровни рецепторов AMPA после стимуляции NMDA. И наоборот, GRIP-1b увеличивает внутриклеточные уровни АМРА-рецепторов в тех же условиях.
ABP-L, как и GRIP-1b, связывается с внутриклеточными запасами АМРА-рецепторов. Однако pABP-L связывается с рецепторами AMPA в качестве поверхностной мембраны. [12] Пока не показано, при каких условиях эти взаимодействия значимы в циклировании AMPAR.
Роль GRIP1 при синдроме Фрейзера
[ редактировать ]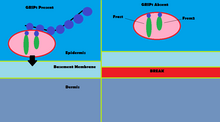
Мутации GRIP1 играют роль менее чем в 10% подтвержденных случаев группы врожденных дефектов, известных как синдром Фрейзера . [13] С помощью иммунофлуоресценции было показано, что GRIP1 обнаруживается в нескольких видах эмбриональных тканей, включая желудочно-кишечный тракт, зачатки мочеточников, кожу, а также полости рта и носа. [14] GRIP1 также важен для правильного функционирования и структуры дермо-эпидермального соединения. [15] В моделях на мышах нокаут белка GRIP1 приводит к нескольким деформациям, которые начинаются еще в эмбрионе. Эти деформации включают субэпидермальные геморрагические волдыри, агенезию почек , синдактилию , полидактилию и криптофтальм. [14] Одно исследование показало, что полное нокаут GRIP1 приводит к отсутствию почек. [14] Другое исследование показывает образование волдырей в эмбриональной ткани, в которой экспрессируется GRIP1, к 12-му дню эмбриональной жизни мышей. [15]
Механизм GRIP1 при синдроме Фрейзера обнаруживается во взаимодействии GRIP1 с белками Fras1 и Frem2. [16] Fras1 и Frem2 представляют собой внеклеточные мембранные белки, необходимые для правильного функционирования базальной мембраны, а также для морфогенеза . [16] GRIP1 играет жизненно важную роль в локализации Fras1 на базальной поверхности эпидермальных клеток, а также в локализации Frem2. [16] Нокаут белка GRIP1 или его мутация приводит к плохой экспрессии Fras1 и Frem2. [16] GRIP1 специфически связывается с Fras1 через мотив PDZ, расположенный на Fras1. [16] Frem2 также имеет домен PDZ , хотя взаимодействие между GRIP1 и Frem2 неясно. [16] В одном случае синдрома Фрейзера у GRIP1 отсутствовали домены 6 и 7 PDZ. Только первые четыре домена PDZ из семи доменов PDZ, которые есть у GRIP1, необходимы для связывания с Fras1, что указывает на дополнительные механизмы и белки, с которыми взаимодействует GRIP1, которые могут привести к синдрому Фрейзера, когда мутировал. [17] Другие мутации GRIP1, которые приводят к синдрому Фрейзера, включают нонсенс-мутации, мутации сдвига рамки считывания, мутации сайта сплайсинга, делецию генома и делецию экзона 18 гена GRIP1. [13]
Роль GRIP1 в морфологии нейронов и транспорте грузов
[ редактировать ], развитие и поддержание нейрона Морфология зависят от экспрессии GRIP1 в клетке. [18] Это жизненно важно на начальном этапе разработки, поскольку эксперименты с нокаутом на мышиных моделях приводят к образованию волдырей на коже и гибели эмбрионов. [15] В разработанных мышиных моделях отключающие мутации, такие как трансфектон или доминантно-негативные мутации в GRIP1, могут вызывать до 75% потери «первичных, вторичных и более высоких» дендритов в развивающихся нейронах. [19] Отключение GRIP1 в живых здоровых нейронах в чашке приведет к уменьшению самой толстой части нейрона на 20% и уменьшению ветвей до 70%. [18]
Дефекты морфологии нейронов из-за неисправности GRIP1 могут быть зарезервированы. Один из способов — сверхэкспрессия GRIP1. Это приводит к усилению, но не полному восстановлению ветвления. [18] Другой белок, EphB2 , который взаимодействует с GRIP1, может быть мутирован так, что возможно восстановление ветвления на 70-90%. Однако сверхэкспрессия дикого типа приводит к уменьшению количества нейронов. [18]
Моторные белки, такие как кинезин (KIF5), связываются с адаптерными молекулами, такими как GRIP1, для перемещения груза из аппарата Гольджи к конечностям нейронной клетки. GRIP1 и KIF5 очень часто встречаются вместе из-за хорошей аффинности связывания (диапазон Kd 10-20 нМ). [20] ). Что касается того, как груз попадает в нужное место, существует гипотеза под названием «умный мотор». [21] В настоящее время считается, что «умный мотор» распознает разницу между аксональными (покрытыми белком KLC) и дендритными (покрытыми KHC) белками. [21] Место назначения выбирается соответственно. К сожалению, подробности о промежуточных этапах транспортировки неизвестны. Однако в пункте назначения связывание белка 14-3-3 нарушает взаимодействие между KIF5 и GRIP1. [19] Это освобождает груз.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Донг, Х; О'Брайен, Р.; Фунг, Э; Ланахан, А; Уорли, П; Хунганир, Р. (март 1997 г.). «GRIP: белок, содержащий синаптический домен PDZ, который взаимодействует с рецепторами AMPA». Природа . 386 (6622): 279–84. Бибкод : 1997Natur.386..279D . дои : 10.1038/386279a0 . ПМИД 9069286 . S2CID 4361791 .
- ^ Корнау, Ганс-Кристиан; Шенкер, Лесли Т.; Кеннеди, Мэри Б.; Сибург, Питер Х. (1995). «Доменное взаимодействие между субъединицами рецептора NMDA и белком постсинаптической плотности PSD-95». Наука . 269 (5231): 1737–1740. Бибкод : 1995Sci...269.1737K . дои : 10.1126/science.7569905 . ПМИД 7569905 .
- ^ Элерс, доктор медицины; Маммен, Алабама; Лау, Л.; Хуганир, Р.Л. (1996). «Синаптическое нацеливание на глутаматные рецепторы» . Современное мнение в области клеточной биологии . 8 (4): 484–489. дои : 10.1016/S0955-0674(96)80024-X . ПМИД 8791455 .
- ^ Jump up to: а б с д Донг, Х; О'Брайен, Р.; Фунг, Э; Ланахан, А; Уорли, П; Хунганир, Р. (1997). «GRIP: белок, содержащий синаптический домен PDZ, который взаимодействует с рецепторами AMPA». Природа . 386 (6622): 279–84. Бибкод : 1997Natur.386..279D . дои : 10.1038/386279a0 . ПМИД 9069286 . S2CID 4361791 .
- ^ Ли, HJ; Чжэн, Джей-Джей (2010). «Домены PDZ и их партнеры по связыванию: структура, специфичность и модификация» . Сигнал сотовой связи . 8 :8. дои : 10.1186/1478-811X-8-8 . ПМК 2891790 . ПМИД 20509869 .
- ^ Элерс, М.; Маммен, А.; Лау, Л.; Хуганир, Р. (1998). «Синаптическое нацеливание на глутаматные рецепторы» . Современное мнение в области клеточной биологии . 8 (4): 484–489. дои : 10.1016/S0955-0674(96)80024-X . ПМИД 8791455 .
- ^ Ся, Дж; Чжан, X; Штаудингер, Дж; Хуганир, Р. (январь 1999 г.). «Кластеризация рецепторов AMPA синаптическим белком PICK1, содержащим домен PDZ» . Нейрон . 22 (1): 179–87. дои : 10.1016/s0896-6273(00)80689-3 . ПМИД 10027300 .
- ^ Jump up to: а б Брейтуэйт, С; Ся, Х; Маленка, Р. (2002). «Дифференциальная роль NSF и GRIP/ABP в цикле рецепторов AMPA» . Труды Национальной академии наук . 99 (10): 7096–101. Бибкод : 2002PNAS...99.7096B . дои : 10.1073/pnas.102156099 . ПМЦ 124534 . ПМИД 12011465 .
- ^ Донг, Х; Чжан, П; Песня, я; Петралия, Р; Ляо, Д; Хунганир, Р. (15 августа 1999 г.). «Характеристика белков GRIP1 и GRIP2, взаимодействующих с глутаматными рецепторами» . Журнал неврологии . 19 (16): 6930–41. doi : 10.1523/JNEUROSCI.19-16-06930.1999 . ПМК 6782851 . ПМИД 10436050 .
- ^ Вышинский, М; Вальшанов, Дж; Нейсбитт, С; Дуна, А; Ким, Э; Штандарт, Д; и др. (1 августа 1999 г.). «Ассоциация АМРА-рецепторов с подмножеством белка, взаимодействующего с глутаматными рецепторами in vivo» . Журнал неврологии . 19 (15): 6528–37. doi : 10.1523/JNEUROSCI.19-15-06528.1999 . ПМК 6782830 . ПМИД 10414981 .
- ^ Хэнли, Л; Хенли, Дж (2010). «Дифференциальная роль GRIP1a и GRIP1b в торговле рецепторами AMPA» . Письма по неврологии . 485 (3): 167–72. дои : 10.1016/j.neulet.2010.09.003 . ПМК 3310156 . ПМИД 20837103 .
- ^ ДеСуза, С; Фу, Дж; Штаты, Б; Зифф, Э. (2002). «Дифференциальное пальмитоилирование направляет белок ABP, связывающий рецептор AMPA, к шипикам или внутриклеточным кластерам» . Журнал неврологии . 22 (9): 3493–503. doi : 10.1523/JNEUROSCI.22-09-03493.2002 . ПМК 6758378 . ПМИД 11978826 .
- ^ Jump up to: а б Шанце, Д. (2014). «Синдром Фрейзера из-за мутаций GRIP1 - клинический фенотип в двух семьях и расширение спектра мутаций». Американский журнал медицинской генетики . 164 (3): 837–840. дои : 10.1002/ajmg.a.36343 . ПМИД 24357607 . S2CID 11034897 .
- ^ Jump up to: а б с Такамия, К.; Костуру, В.; Адамс, С.; Ядея, С.; Чалепакис, Г.; Мошенник, Пи Джей; Адамс, Р.Х. (2004). «Прямая функциональная связь между белком GRIP1 с мульти-PDZ-доменом и белком Fras1 синдрома Фрейзера» . Природная генетика . 36 (2): 172–7. дои : 10.1038/ng1292 . ПМИД 14730302 .
- ^ Jump up to: а б с Бладт, Ф (2002). «Булезный эпидермолиз и эмбриональная смертность у мышей, у которых отсутствует белок GRIP1 с мульти-PDZ-доменом» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (10): 6816–6821. Бибкод : 2002PNAS...99.6816B . дои : 10.1073/pnas.092130099 . ПМК 124486 . ПМИД 11983858 .
- ^ Jump up to: а б с д и ж Киёзуми, Д. (2006). «Нарушение реципрокной стабилизации QBRICK/Frem1, Fras1 и Frem2 на базальной мембране провоцирует дефекты, подобные синдрому Фрейзера» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (32): 11981–11986. Бибкод : 2006PNAS..10311981K . дои : 10.1073/pnas.0601011103 . ПМЦ 1567684 . ПМИД 16880404 .
- ^ Фогель, М., Сон, П., Брютон, Л., Гийзен, М., Туил, М., Кокс, П.,… Хельст, М. (2012). Мутации в GRIP1 вызывают синдром Фрейзера. Журнал медицинской генетики, 303–306.
- ^ Jump up to: а б с д Хугенрад, Каспер (19 июня 2005 г.). «GRIP1 контролирует морфогенез дендритов, регулируя трафик рецепторов EphB». Природная неврология . 8 (7): 906–916. дои : 10.1038/nn1487 . ПМИД 15965473 . S2CID 23686585 .
- ^ Jump up to: а б Гейгер, Юлия (24 февраля 2014 г.). «Путь GRIP1 / 14-3-3 координирует грузоперевозки и развитие дендритов» . Развивающая клетка . 28 (4): 381–393. дои : 10.1016/j.devcel.2014.01.018 . ПМИД 24576423 .
- ^ Скуфиас, Димитриос (14 января 1994 г.). «Карбокси-концевой домен тяжелой цепи кинезина важен для связывания с мембраной» . Журнал биологической химии . 269 (2): 1477–1485. дои : 10.1016/S0021-9258(17)42281-2 . ПМИД 8288613 .
- ^ Jump up to: а б Сето, Мицутоши (2 мая 2002 г.). «Белок GRIP1, взаимодействующий с глутаматными рецепторами, напрямую направляет кинезин к дендритам». Письма к природе . 417 (6884): 83–87. Бибкод : 2002Natur.417...83S . дои : 10.1038/nature743 . ПМИД 11986669 . S2CID 4400494 .