Связанная со стенкой киназа
| Связанная со стенкой киназа | |||
|---|---|---|---|
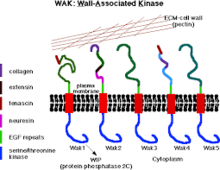 WAK и пектин внутри клеточной стенки | |||
| Идентификаторы | |||
| Символ | Ух ты | ||
| Пфам | PF08488 | ||
| ИнтерПро | ИПР013695 | ||
| Мембраном | 725 | ||
| |||
Стенкоассоциированные киназы (WAK) представляют собой один из многих классов растительных белков, которые, как известно, служат средой между внеклеточным матриксом (ECM) и цитоплазмой клеточных стенок . Это серин-треониновые киназы, которые содержат повторы эпидермального фактора роста (EGF) , цитоплазматическую киназу и расположены в клеточных стенках. [ 1 ] Они обеспечивают связь между внутренней и внешней средой клеточных стенок. [ 2 ] WAK относятся к группе рецептороподобных киназ (RLK), которые активно участвуют в путях сенсорной и сигнальной передачи, особенно в ответ на чужеродные атаки патогенов. [ 3 ] и в развитии клеток. [ 4 ] С другой стороны, пектины представляют собой обширную группу сложных углеводов, присутствующих в первичной клеточной стенке, которые играют роль в росте и развитии клеток, защите, структуре растений и способности удерживать воду.
Киназы, ассоциированные с клеточной стенкой, представляют собой рецептороподобные протеинкиназы , обнаруженные в стенках клеток растений , которые обладают способностью передавать сигналы непосредственно через свои цитоплазматические киназные домены. [ 5 ] Обычно они связывают плазматическую мембрану с белками и углеводами, составляющими клеточную стенку. [ 5 ] Рецептоподобные белки содержат цитоплазматическую серин-треониновую киназу и менее консервативную область; связан с клеточной стенкой и содержит серию повторов эпидермального фактора роста . [ 6 ] WAK обнаружены в различных растениях и культурах, таких как рис, [ 7 ] и кукуруза. [ 8 ] В геноме растений, таких как Arabidopsis , WAK кодируются пятью очень похожими генами, сгруппированными в локусе размером 30 т.п.н. [ 6 ] среди них широко распространены WAK1 и WAK2. [ 5 ] Они в первую очередь участвуют в регуляции функций клеточной стенки растений. [ 5 ] включая расширение клеток, [ 9 ] связывание, а также реакция на пектины , [ 10 ] реакцию патогенов, а также защищает растения от вредного воздействия. [ 5 ]
Пектины богаты галактуроновыми кислотами (ОГ) и присутствуют в средних пластинках растительных тканей, где они обеспечивают прочность, гибкость и адгезию между растительными клетками. [ 11 ] В коммерческих целях и в пищевой промышленности они используются в качестве гелей и стабилизаторов для десертов и соков. Роль WAK в клеточных стенках как пектиновых рецепторов жизненно важна для множества функций, связанных с дифференцировкой клеток, их формой и отношениями хозяин-патоген. [ 12 ]
История
[ редактировать ]Ассоциация WAK со стенкой растительной клетки была впервые нарушена методом иммунолокализации с использованием антисыворотки , при котором было обнаружено, что эпитом WAK прочно связан с фрагментами клеточной стенки, так что их невозможно разделить с помощью детергента, однако WAK можно высвободить при кипячении. стенки с SDS , дитиотреитом (сильным тиоловым восстановителем), протопластирующими ферментами или пектиназой. [ 13 ] [ 9 ]
Ген
[ редактировать ]Белок WAKs состоит из пяти типов очень похожих генов, плотно расположенных в кластерах Arabidopsis размером 30 т.п.н. генома [ 13 ] [ 14 ] Большинство WAK экспрессируются по всему растению, независимо от того, экспрессируются ли WAK1, 2, 3 и 5 в зеленых органах, WAK1 и 2 слабо экспрессируются в цветах и стручках, а WAK2 также экспрессируется в корнях, однако WAK4 экспрессируется только в стручках. [ 15 ] также имеется 21 WAK-подобный ген, В геноме Arabitopsis известный как WAKL, которые имеют небольшое сходство последовательности с WAK. [ 16 ]
Гены Ara WAK и WAKL распределены по всем пяти хромосомам арабидопсиса.
| Число хромосом | Гены локализованы |
|---|---|
| я | ВАКЛ1-13, ВАКЛ22, ВАК1-5 |
| II | ВАКЛ14 |
| III | ВАКЛ14 |
| III | ВАКЛ15, ВАКЛ16 |
| IV | ВАКЛ17, ВАКЛ18, ВАКЛ19 |
| V | ВАКЛ20, ВАКЛ21 |
Члены семейства генов WAK/WAKL у Arabidopsis были разделены на четыре группы на основе парного сравнения предсказанных ими белковых последовательностей. От WAK1 до WAK5, содержащих EGF-Ca 2+ домен с перекрывающимся сайтом гидроксилирования Asp/Asn и домен EGF-2 были помещены в группу I. Было предсказано, что оба домена EGF полностью кодируются вторым экзоном. Семь членов WAKL, включая WAKL1–WAKL6 и WAKL22, были помещены в Группу II. Во всех этих генах группы II EGF-Ca 2+ и домены EGF-2 разделены коротким промежутком в 15-18 аминокислот и расположены в обратном порядке относительно группы I. EGF-Ca 2+ домен кодируется первым экзоном и EGF-Ca 2+ домен кодируется вторым экзоном. Сайт гидроксилирования Asn/asp не был предсказан. [ 17 ]
Группа III состоит из шести членов: WAKL9, WAKL10, WAKL11, WAKL13, WAKL17 и WAKL18. Все соответствующие им белки содержат EGF-Ca. 2+ и домены EGF2, и они структурно подобны WAKL группы II. В WAKL13 EGF-Ca 2+ домен вырожден. За исключением WAKL17, все они имеют вырожденные домены EGF2. [ 17 ]
Группа IV состоит из четырех членов: WAKL14, WAKL15, WAKL20 и WAKL21. Каждый из них имеет домен EGF2, кодируемый первым экзоном. Этот домен является вырожденным как в WAKL20, так и в WAKL21. У всех четырех членов отсутствует EGF-Ca. 2+ домен. Кроме того, каждый из них имеет АТФ-связывающий домен цитоплазматической протеинкиназы (PS00107). Предполагается, что остальные последовательности (WAKL7, WAKL8, WAKL12, WAKL16 и WAKL19) кодируют сокращенные белки WAKL. WAKL7, WAKL8 и WAKL19 похожи на различные другие WAKL в своих внеклеточных областях и лишены трансмембранного домена. WAKL8 и WAKL9 содержат EGF-Ca. 2+ домен, а WAKL19 содержит вырожденный домен EGF2. Ни один из этих доменов не присутствует в WAKL7. WAKL12 также содержит EGF-Ca. 2+ домен, но в отличие от WAKL8 содержит трансмембранный домен. WAKL16 содержит трансмембранный домен, домен STK, который наиболее похож на WAK3, и короткий внеклеточный домен из восьми аминокислот, в котором отсутствуют оба EGF-подобных домена. [ 17 ]
Семьи
[ редактировать ]Стен-ассоциированные киназы (WAK) представляют собой подсемейство рецептороподобных киназ (RLK), связанных с клеточной стенкой. [ 13 ] они были описаны У Arabidopsis thaliana как группа из пяти (WAK1-5), [ 14 ] и 22 гена (WAKL1-WAKL22). [ 16 ]
Семейство генов WAK/WAKL (OsWAK) в рисе [ 18 ]
- OsWAK-RLK (рецептороподобные киназы) - содержат как внеклеточные EGF-подобные домены, так и внутриклеточный киназный домен. [ 18 ]
- OsWAK-RLCK (рецептороподобные цитоплазматические киназы) - содержат только киназный домен. [ 18 ]
- OsWAK-RLP (рецептороподобные белки) – содержат только внеклеточные EGF-подобные домены. [ 18 ]
- Короткие гены OsWAK - отсутствуют оба домена, но они имеют > 40% идентичности на уровне аминокислот с другими членами OsWAK. [ 18 ]
- псевдогены (либо со стоп-кодонами, либо со сдвигом кадра в кодирующей области) [ 18 ]
Структура
[ редактировать ]Все пять белков WAK имеют высококонсервативный домен серин/треониновой протеинкиназы (сходство 86%) на цитоплазматической стороне и внеклеточный домен (сходство аминокислотных последовательностей составляет всего от 40% до 64%). [ 14 ] [ 19 ] [ 6 ] Более того, все изомеры белков WAK имеют повторы, подобные эпидермальному фактору роста (EGF), расположенные на аминоконцевой стороне. [ 6 ] Позиции шести цистеинов (расположенных в повторах EGF) хорошо сохраняются во всех пяти WAK, однако белок-белковые взаимодействия WAks до сих пор неизвестны. [ 20 ]
Все WAK (WAK 1-5) имеют сайт гидроксилирования Asp/Asn (Cx[DN]x(4)[FY]xCxC; Prosite PS00010), перекрывающийся с кальцийсвязывающими доменами EGF, где как гидроксилированные, так и негидроксилированные формы коагуляционных протеаз имеют одинаковое сродство к кальций в физиологических концентрациях. [ 15 ] Гидроксильная группа может участвовать в образовании водородных связей при межбелковых взаимодействиях, опосредованных EGF-подобным доменом. [ 21 ]
Ассоциация WAK с клеточной стенкой очень сильна (имеет ковалентную связь с пектином), поэтому его высвобождение из клеточной стенки требует ферментативного расщепления. [ 22 ] В условиях, которые разрушают тургор растительной клетки и отделяют мембрану от стенки (плазмолиз), ассоциация WAKs-стенка настолько сильна, что они остаются в клеточной стенке. существует пять изоформ WAK У Arabidopsis с вариабельным внеклеточным доменом внутри этих изоформ, каждая из которых содержит по крайней мере два эпидермальных фактора роста (EGF). Из всех этих изоформ WAK1 и WAK2 наиболее распространены, а их информационная РНК (мРНК) и белки присутствуют в вегетативной меристеме и областях клеточной экспансии. [ 22 ]
Взаимодействие
[ редактировать ]WAK1 сшивается в эндомембранах , и его транспорт к поверхности клетки требует правильного синтеза клеточной стенки. [ 23 ] Взаимодействие между WAK1 и пектинами (пектины представляют собой сложные олигополисахариды, образующие гидрофильную гелеобразную матрицу между микрофибриллами целлюлозы и могут концентрироваться в разных участках клеточной стенки) [ 24 ] было подтверждено с использованием антител против WAK1 и против пектина JIM5 и JIM7, распознававших одну и ту же полосу белка массой 68 кДа в вестерн-блотах белков клеточной стенки, экстрагированных из клеточных стенок, обработанных пектиназой. [ 9 ] Этот гибрид пектин-киназы расположен для сообщения с цитоплазмой клеточной стенки, где WAK1 связан в индуцированной кальцием конформации с полигалактуроновой кислотой, олигогалактуронидами и пектинами, и это взаимодействие предотвращалось метиловой этерификацией, хелаторами кальция и деполимеризацией пектина. [ 25 ] [ 26 ] Взаимодействие полианиона пектина с клеточной стенкой или плазмалеммой может вызывать конформационные изменения в полимерах пектина, которые влияют на их гелеобразование и набухание в присутствии кальция. [ 27 ] а связывание пектинов с WAK1 в присутствии кальция может привести к муро- нарушениям пектиновой сети, которые могут генерировать сигналы внутри клеточной стенки. [ 27 ]
Функция
[ редактировать ]Стеносвязанные киназы (WAK) выполняют несколько функций (деление или рост клеток), как и другие растительные рецепторы, такие как сенсоры клеточной стенки, однако их уникальными характеристиками является прямое связывание с пектином , что постулирует WAK-зависимый сигнальный путь, регулирующий расширение клеток. [ 6 ] Они также участвуют в патогенных и стрессовых реакциях. [ 6 ] толерантность к тяжелым металлам, [ 17 ] и развитие растений. [ 6 ]
WAK могут способствовать удлинению клеток, поскольку они имеют активный цитоплазматический протеинкиназный домен, который охватывает плазматическую мембрану и содержат N-конец, который связывает клеточную стенку, если WAK2 может регулировать инвертазу на уровне транскрипции . [ 28 ] WAK также могут регулировать размножение клеток посредством контроля концентрации сахара и, таким образом, тургора контроля , где фенотип wak2-1 может быть спасен за счет экспрессии сахарозофосфатсинтазы, которая изменяет поглотители сахара. [ 29 ] Однако антисмысловую РНК WAK можно индуцировать с помощью системы Dex , которая способствует снижению уровня белка WAK на 50%, а также меньшему размеру клеток, а не меньшему количеству клеток. [ 30 ] [ 31 ] [ 32 ] Wak2-1 ) ( нулевой аллель WAK2 вызывает потерю роста клеток в корнях, но только в условиях ограничения сахара и соли. [ 29 ] однако индивидуальная потеря функциональных аллелей в любом из четырех других WAK не приводит к очевидному фенотипу. [ 14 ] Кохорн и др. (2006a) предположили, что WAK могут быть сшиты с материалом клеточной стенки, однако сборка и сшивание WAK начинаются на ранней стадии внутри цитоплазматического компартмента, а не в самой клеточной стенке, и также координируются с синтезом. поверхностной целлюлозы. [ 23 ] WAK высвобождаются из пектиназы материала клеточной стенки, где они связываются с пектинами. [ 30 ] [ 32 ] Следовательно, WAK1 или 2, связывающиеся с пектином, имеют более высокое сродство к деэтерифицированному пектину, чем к этерифицированным молекулам. При этом короткие пектиновые фрагменты со степенью полимеризации (dp) 9–15 эффективно конкурируют с более длинными пектинами за связывание WAK. [ 29 ] [ 33 ] И WAK1, и WAK 2 связываются с различными пектинами, включая полимеры гомогалактуронана (HA), OG и рамногалактуронанов (RG) I и II. [ 33 ] Требования к связыванию связаны не с простым полимером ГК, а, возможно, с наличием галактуроновой кислоты. [ 33 ] Биологическая активность пектиновых фрагментов, или OG, способствует защитным и стрессовым реакциям, а также процессам развития, где WAK действуют как рецепторы. [ 34 ] [ 35 ] [ 36 ] [ 37 ]
Связанные со стенками киназы участвуют в реакциях на патогены и стресс. [ 29 ]
Путь передачи сигнала
[ редактировать ]Кохорн (2016) предположил, что «пектиновые полимеры могут сшиваться в клеточной стенке с помощью Ca + , а WAK связывают эти пектины и передают сигнал посредством активации вакуолярной инвертазы и множества других индуцированных белков, помогая расширению клеток. Состояние метиловой этерификации пектина модулируется пектинметилэстеразами (PME), а WAK связывают деметилированный пектин с более высоким сродством. Пектин фрагментируется биотическими и абиотическими событиями, а олигогалактурониды (ОГ) имеют более высокое сродство к WAK и вызывают реакцию на стресс». [ 38 ]
WAK связывают пектин
[ редактировать ]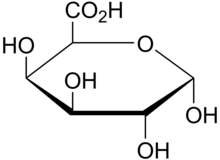
Связанные со стенками киназы представляют собой рецепторы с опосредованной кальцием перекрестной связью с клеточной стенкой растений. [ 39 ] [ 40 ] Предполагается, что наличие основной цепи галактуроновой кислоты в различных типах пектина является жизненно важным свойством для связывания с WAK, поскольку WAK1 и WAK2 связываются с различными пектинами, включая полимеры гомогалактуронана (HA), наиболее распространенного пектина в клеточных стенках; [ 41 ] Олигогалактуроновые кислоты (ОГ) и рамногалактуронаны (РГ) I и II. [ 42 ] Связыванию in vitro между WAK и пектином способствуют заряженные кислородные группы на чистых пектиновых фрагментах и заряженные остатки на ЕСМ WAK. [ 43 ]
Пектиназа , фермент, ответственный за расщепление пектина, присутствующего в клеточной стенке, высвобождает WAK, это стало основным предположением о том, что WAK связаны с пектином внутри клеточной стенки. [ 42 ] Кроме того, эта гипотеза предполагает наличие ковалентной связи между пектином и WAK, поскольку они все еще связаны друг с другом после воздействия детергента додецилсульфата натрия (детергента) и дитиотреитола (ДТТ) и в акриламидных гелях . [ 2 ] Пектинметилэстеразы (ПМЕ) удаляют метильные группы, возникающие из фермента, который полимеризует пектины (полимер этерифицированной метилом α-(1–4) D-галактуроновой кислоты), в результате чего образуется деэтерифицированный полимер пектина. [ 44 ] WAK легче связываются с деэтерифицированными пектинами из-за их более отрицательного заряда. Это предположение о том, что за предпочтительное связывание WAK с деэтерифицированными пектинами (отрицательно заряженными) отвечает заряд, было продемонстрировано в мутации катионных остатков в гене WAK1 на нейтральные остатки, что привело к потере свойств связывания с деэтерифицированными пектинами. . [ 2 ]
Эта роль заряда в связывании дополнительно подтверждается заменой остатков аргинина на глутамин и лизина на треонины в ЕСМ, что свидетельствует о снижении связывания с деэтерифицированным пектином. [ 43 ] Поэтому деэтерификация пектинов необходима для активации WAK.
Молекулярные взаимодействия WAK и пектина
[ редактировать ]Модель
[ редактировать ]Связывание WAK с пектинами запускает функционирование нескольких путей. Фрагментация пектинов (олигогалактуроновой кислоты) во время повреждения или поражения патогенами приводит к стрессовой реакции растения, и WAK играют роль в опосредовании этой реакции. Однако, поскольку WAK также необходимы для роста клеток путем связывания с длинными пектиновыми полимерами для развития растений, а также с фрагментами пектина для реакции на поранение, не было обнаружено способов того, как WAK дифференцируется между двумя типами пектинов, чтобы инициировать удлинение клеток или защиту. . [ 39 ] Однако была предложена модель, демонстрирующая предпочтение WAK деэтерифицированным пектинам и возможное объяснение инициирования реакции патогена, а не реакции роста.
Было показано, что доминантный аллель WAKs, которому необходим пектинсвязывающий домен и киназная активность, вызывает стрессовую реакцию, однако этот аллель был подавлен нулевым аллелем пектинметилэстеразы (pme), который препятствовал удалению метильных групп, полимеризующих пектин. в деэтерифицированный полимер, что приводит к образованию этерифицированного пектина. Поскольку WAK более слабо связывается с этерифицированными пектинами, его было больше для связывания олигогалактуроновых кислот (у этого мутанта), тем самым индуцируя реакцию патогена на стресс, а не реакцию роста. [ 39 ] Зависимая от WAK активация пути клеточной экспансии включает активацию MPK3, тогда как ответ патогена показывает активацию как MPK3, так и MPK6. [ 42 ]
WAK1 и WAK2 являются наиболее экспрессируемыми белковыми вариантами WAKS из пяти WAK, известных у Arabidopsis, однако WAK1 больше всего экспрессируется в сосудистой сети, тогда как WAK2 также экспрессируется в соединениях органов, зонах отторжения и меристемах. [ 40 ]
WAK1: реакция патогена
[ редактировать ]Путь возбудителя к инфекции начинается с клеточной стенки; белки, которые соединяют клеточную стенку с плазматической мембраной, являются начальными медиаторами реакции патогена. WAK1 индуцируется в результате патогенной реакции растения вместе с другими белками, связанными с патогеном, которые выполняют защитную функцию. Wak1 присутствует в ткани растения Arabidopsis, при этом экспрессия мРНК WAK1 более выражена в стебле и листьях растения, чем в корнях, а его внеклеточный домен содержит повторы эпидермального роста , которые облегчают передачу сигналов клеткам. Тепло и соль не влияют на выработку WAK1 в тканях, однако повреждение является значительным, поскольку оно вызывает экспрессию сообщения WAK1 с помощью 2,2-дихлоризоникотиновой кислоты (INA), природного салицилата (SA) в пути передачи сигнала в Реакция растений на инфекцию. Поскольку WAK1 жизненно важен для выживания растения в ответ на патогены, он одновременно придает устойчивость к SA до такой степени, что растение может пережить воздействие высоких уровней SA. [ 45 ] Повышенная устойчивость к SA за счет экспрессии WAK1 может быть обеспечена только за счет эктопической экспрессии всего белка WAK1 или киназного домена. [ 45 ] В конечном итоге это означает, что индуцирование экспрессии WAK1 вызывает снижение уровня СА и снижение токсичности, а, следовательно, и защиту, демонстрируя роль WAK1 в регулировании патогенных атак.
WAK2: пектин и экспрессия генов
[ редактировать ]Пектин влияет на экспрессию WAK2-зависимых генов, например тех, которые участвуют в целостности клеточной стенки и внешнем ответе; [ 43 ] [ 39 ] Предполагается, что WAK2 играет важную роль в клеточных событиях и экспрессии генов в мезофилле Arabidopsis. Экспрессия генов с использованием массивов экспрессии Affymetrix с РНК из протопластов дикого типа или wak2-1 (нулевая мутация), обработанных или не обработанных пектином, позволяет выявить множество вещей. В обработанных пектином протопластах дикого типа наблюдались изменения в экспрессии более 200 генов, при этом почти 50 из повышенно регулируемых генов были генами, участвующими в синтезе клеточной стенки, такими как пектинэстераза, богатая лейцином трансмембранная киназа, растительный дефенсин. Остальные гены с пониженной регуляцией включали гены, участвующие в множестве функций растения; однако только один ген в обработанном пектином WAK2-1 экспрессировался дифференциально. По сравнению с wak2-1, 13 из 50 активируемых генов дикого типа были подавлены в wak2-1, а 37 экспрессировались аналогично дикому типу. 20 генов из числа тех, у которых была снижена экспрессия, показали сниженную экспрессию в клетках wak2-1 , 24 были активированы, а остальные имели уровни, аналогичные дикому типу. [ 43 ]
Эти закономерности позволили идентифицировать гены, регулируемые WAK2 без обработки пектинами, независимые от WAK2, но зависимые от пектинового ответа WAK2. Экспрессия WAK2 в wak2-1 (нулевая мутация) продемонстрировала наибольшее снижение экспрессии, что указывает на то, что ген не транскрибируется. WAK1 и WAK2 повышались у обработанных пектином диких типов, но этого не наблюдалось у wak2-1. [ 43 ] Очевидно, WAK2 является важным компонентом пектинового сигнального пути, поскольку отсутствие WAK2 может значительно снизить транскрипционный ответ на пектин. Как повышенная, так и пониженная регуляция WAK2-зависимых генов пектинового ответа связаны либо с защитой, структурой клеточной стенки, фосфорилированием белка, либо с факторами транскрипции. [ 43 ]
Ссылки
[ редактировать ]- ^ Кохорн Б.Д. (октябрь 2001 г.). «WAK; киназы, связанные с клеточной стенкой». Современное мнение в области клеточной биологии . 13 (5): 529–33. дои : 10.1016/S0955-0674(00)00247-7 . ПМИД 11544019 .
- ^ Jump up to: а б с Вагнер Т.А., Кохорн Б.Д. (февраль 2001 г.). «Связанные со стенками киназы экспрессируются на протяжении всего развития растений и необходимы для размножения клеток» . Растительная клетка . 13 (2): 303–18. дои : 10.1105/tpc.13.2.303 . ПМЦ 102244 . ПМИД 11226187 .
- ^ Ян К., Ци Л, Чжан Цз (2014). «Выделение и характеристика нового гена связанной со стенкой киназы TaWAK5 у пшеницы (Triticum aestivum)» . Журнал «Урожай» . 2 (5): 255–266. дои : 10.1016/j.cj.2014.04.010 .
- ^ Рецепторноподобные киназы у растений . Сигнализация и связь у растений. Том. 13. СпрингерЛинк. 2012. doi : 10.1007/978-3-642-23044-8 . ISBN 978-3-642-23043-1 . S2CID 6532313 .
- ^ Jump up to: а б с д и Андерсон, Кэтрин М.; Вагнер, Таня А.; Перре, Мирей; Хэ, Чжэн-Хуэй; Он, Дезе; Кохорн, Брюс Д. (2001). «WAK: киназы, ассоциированные с клеточной стенкой, связывающие цитоплазму с внеклеточным матриксом». Молекулярная биология растений . 47 (1–2): 197–206. дои : 10.1023/A:1010691701578 . ПМИД 11554472 . S2CID 19683854 .
- ^ Jump up to: а б с д и ж г Кохорн, Брюс Д; Кохорн, Сьюзен Л. (2012). «Киназы, ассоциированные с клеточной стенкой, WAK, как пектиновые рецепторы» . Границы в науке о растениях . 3 : 88. дои : 10.3389/fpls.2012.00088 . ПМЦ 3355716 . ПМИД 22639672 .
- ^ Де Оливейра, Луис Фелипе Вальтер; Кристофф, Ана Паула; Де Лима, Жулио Сезар; Де Росс, Бруно Компарси Фейхо; Сакетто-Мартинс, Жилберто; Маржис-Пинейру, Марсия; Маргис, Роджерио (2014). «Семейство генов киназ, ассоциированных со стеной, в геномах риса». Наука о растениях . 229 : 181–92. doi : 10.1016/j.plantsci.2014.09.007 . ПМИД 25443845 .
- ^ Цзо, Вэйлян, Чжан, Нань; Е, Цзяньжун; Ли, Байлин; Чжан, Боци; Лю, Фэнглер, Кевин А; устойчивость к головне». количественную Лай , обеспечивает «Киназа , связанная со стенками кукурузы, Цзиньшэн ; , Юншэн ; Сюй, Минлян (2014) . .3170 . ПМИД 25531751 .
- ^ Jump up to: а б с Вагнер, Таня А.; Кохорн, Брюс Д. (2001). «Связанные со стенками киназы экспрессируются на протяжении всего развития растений и необходимы для размножения клеток» . Растительная клетка . 13 (2): 303–18. дои : 10.1105/tpc.13.2.303 . JSTOR 3871278 . ПМЦ 102244 . ПМИД 11226187 .
- ^ Кохорн, Брюс Д; Кобаяши, Масару; Йохансен, Сью; Ризе, Джефф; Хуан, Ли-Фен; Кох, Карен; Фу, Сарита; Дотсон, Анджали; Байерс, Николь (2006). «Киназа, связанная с клеточной стенкой арабидопсиса, необходимая для активности инвертазы и роста клеток» (PDF) . Заводской журнал . 46 (2): 307–16. дои : 10.1111/j.1365-313X.2006.02695.x . ПМИД 16623892 .
- ^ Уиллатс В.Г., Маккартни Л., Маки В., Нокс Дж.П. (2001). «Пектин: клеточная биология и перспективы функционального анализа». Стенки растительных клеток . Спрингер, Дордрехт. стр. 9–27. дои : 10.1007/978-94-010-0668-2_2 . ISBN 9789401038614 .
- ^ Декре А, Мессиан Дж (февраль 2005 г.). «Связанная со стенками киназа WAK1 взаимодействует с пектинами клеточной стенки в конформации, индуцированной кальцием» . Физиология растений и клеток . 46 (2): 268–78. дои : 10.1093/pcp/pci026 . ПМИД 15769808 .
- ^ Jump up to: а б с Хэ, Чжэн-Хуэй; Фуджики, Масааки; Кохорн, Брюс Д. (1996). «Связанная с клеточной стенкой рецептороподобная протеинкиназа» . Журнал биологической химии . 271 (33): 19789–93. дои : 10.1074/jbc.271.33.19789 . ПМИД 8702686 .
- ^ Jump up to: а б с д Хэ, Чжэн-Хуэй; Чизмен, Иэн; Он, Дезе; Кохорн, Брюс Д. (1999). «Кластер из пяти генов рецепторной киназы, связанной с клеточной стенкой, Wak1-5, экспрессируется в определенных органах Arabidopsis». Молекулярная биология растений . 39 (6): 1189–96. дои : 10.1023/А:1006197318246 . ПМИД 10380805 . S2CID 9362392 .
- ^ Jump up to: а б Декре, Аннабель; Мессиан, Йохан (2005). «Связанная со стенками киназа WAK1 взаимодействует с пектинами клеточной стенки в конформации, индуцированной кальцием» . Физиология растений и клеток . 46 (2): 268–78. дои : 10.1093/pcp/pci026 . ПМИД 15769808 .
- ^ Jump up to: а б Верика, Дж. А.; Он, З.Х (2002). «Киназа, ассоциированная с клеточной стенкой (WAK) и семейство генов WAK-подобных киназ» . Физиология растений . 129 (2): 455–9. дои : 10.1104/стр.011028 . JSTOR 4280478 . ПМК 1540232 . ПМИД 12068092 .
- ^ Jump up to: а б с д и Каннеганти, Выдехи; Гупта, Адитья К (2008). «Стеносассоциированные киназы растений — обзор» . Физиология и молекулярная биология растений . 14 (1–2): 109–18. дои : 10.1007/s12298-008-0010-6 . ПМК 3550657 . ПМИД 23572878 .
- ^ Jump up to: а б с д и ж Чжан, С; Чен, К; Ли, Л; Мэн, Л; Сингх, Дж; Цзян, Н; Дэн, XW; Он, З. Х; Лемо, PG (2005). «Эволюционное расширение, генная структура и экспрессия семейства генов киназ, связанных со стенками риса» . Физиология растений . 139 (3): 1107–24. дои : 10.1104/стр.105.069005 . JSTOR 4281942 . ПМЦ 1283751 . ПМИД 16286450 .
- ^ Самполи Бенитес, Бенедетта А; Комивес, Элизабет А (2000). «Пластичность дисульфидных связей в эпидермальном факторе роста». Белки: структура, функции и генетика . 40 (1): 168–74. doi : 10.1002/(SICI)1097-0134(20000701)40:1<168::AID-PROT180>3.0.CO;2-N . ПМИД 10813841 . S2CID 40408185 .
- ^ Шивагуру, М; Эзаки, Б; Он, З. Х; Тонг, Х; Осава, Х; Балуска, Ф; Фолькманн, Д; Мацумото, Х (2003). «Индуцированная алюминием экспрессия генов и белковая локализация киназы рецептора, связанного с клеточной стенкой, у Arabidopsis» . Физиология растений . 132 (4): 2256–66. дои : 10.1104/стр.103.022129 . ПМК 181309 . ПМИД 12913180 .
- ^ Стенфло, Йохан; Стенберг, Ивонн; Мураньи, Андреас (2000). «Кальций-связывающие EGF-подобные модули в протеиназах коагуляции: функция иона кальция во взаимодействиях модулей». Biochimica et Biophysical Acta (BBA) - Структура белка и молекулярная энзимология . 1477 (1–2): 51–63. дои : 10.1016/S0167-4838(99)00262-9 . PMID 10708848 .
- ^ Jump up to: а б Кохорн, Брюс Д; Кохорн, Сьюзен Л. (2012). «Киназы, ассоциированные с клеточной стенкой, WAK, как пектиновые рецепторы» . Границы в науке о растениях . 3 : 88. дои : 10.3389/fpls.2012.00088 . ПМЦ 3355716 . ПМИД 22639672 .
- ^ Jump up to: а б Кохорн, Брюс Д.; Кобаяши, Масару; Йохансен, Сью; Фридман, Генри Перри; Фишер, Энди; Байерс, Николь (2006). «Стэнс-ассоциированная киназа 1 (WAK1) сшивается в эндомембранах, и транспорт к поверхности клетки требует правильного синтеза клеточной стенки» . Журнал клеточной науки . 119 (11): 2282–90. дои : 10.1242/jcs.02968 . ПМИД 16723734 .
- ^ Карпита, Николас С; Гибо, Дэвид М. (1993). «Структурные модели первичных клеточных стенок цветковых растений: соответствие молекулярной структуры физическим свойствам стенок во время роста» . Заводской журнал . 3 (1): 1–30. дои : 10.1111/j.1365-313X.1993.tb00007.x . ПМИД 8401598 .
- ^ Декре, А; Томас, А; Шпионы, Б; Брассер, Р; Катсем, П; Мессиан, Дж (2006). «Характеристика in vitro гомогалактуронан-связывающего домена стеночно-ассоциированной киназы WAK1 с использованием сайт-направленного мутагенеза». Фитохимия . 67 (11): 1068–79. Бибкод : 2006PChem..67.1068D . doi : 10.1016/j.phytochem.2006.03.009 . ПМИД 16631829 .
- ^ Дикс, Майкл Дж; Хасси, Патрик Дж; Дэвис, Брендан (2002). «Формины: промежуточные соединения в каскадах передачи сигналов, которые влияют на реорганизацию цитоскелета». Тенденции в науке о растениях . 7 (11): 492–8. дои : 10.1016/S1360-1385(02)02341-5 . ПМИД 12417149 .
- ^ Jump up to: а б Макдугалл, Алистер Дж; Бретт, Гэри М; Моррис, Виктор Дж; Ригби, Нил М; Ридаут, Майкл Дж; Ринг, Стивен Дж. (2001). «Влияние взаимодействия пептид-пектин на гелеобразование пектина клеточной стенки растений». Исследование углеводов . 335 (2): 115–26. дои : 10.1016/S0008-6215(01)00221-X . ПМИД 11567642 .
- ^ Вагнер, Т.А.; Кохорн, Б.Д. (2001). «Связанные со стенками киназы экспрессируются на протяжении всего развития растений и необходимы для размножения клеток» . Растительная клетка . 13 (2): 303–318. дои : 10.1105/tpc.13.2.303 . ПМК 102244 . ПМИД 11226187 .
- ^ Jump up to: а б с д Кохорн Б.Д., Кобаяши М., Йохансен С., Ризе Дж., Хуанг Л.Ф., Кох К., Фу С., Дотсон А., Байерс Н. (2006b). Киназа, ассоциированная с клеточной стенкой арабидопсиса, необходимая для активности инвертазы и роста клеток. Завод J. 46 307–316
- ^ Jump up to: а б Андерсон CM, Вагнер Т.А., Перрет М., Хе З.Х., Хе Д., Кохорн Б.Д. (2001). WAK: киназы, ассоциированные с клеточной стенкой, связывающие цитоплазму с внеклеточным матриксом. Завод Мол. Биол. 47 197–206
- ^ Лалли, Д.; Ингмайр, П.; Тонг, Хай; Он, Ж (2001). «Антисмысловая экспрессия протеинкиназы, ассоциированной с клеточной стенкой, WAK4, ингибирует удлинение клеток и изменяет морфологию» . Растительная клетка . 13 (6): 1317–1331. дои : 10.2307/3871298 . JSTOR 3871298 . ПМЦ 135583 . ПМИД 11402163 .
- ^ Jump up to: а б Кохорн, Б.Д. (2001). «WAK; киназы, связанные с клеточной стенкой». Курс. Мнение. Клеточная Биол . 13 (5): 529–533. дои : 10.1016/s0955-0674(00)00247-7 . ПМИД 11544019 .
- ^ Jump up to: а б с Кохорн Б.Д., Йохансен С., Шишидо А., Тодорова Т., Мартинес Р., Дефео Э., Обрегон П. (декабрь 2009 г.). «Пектиновая активация киназы MAP и экспрессия генов зависят от WAK2» . Плант Дж . 60 (6): 974–82. дои : 10.1111/j.1365-313X.2009.04016.x . ПМЦ 3575133 . ПМИД 19737363 .
- ^ Ямадзаки, Н.; Фрай, Южная Каролина; Дарвилл, АГ; Альберсхайм, П. (1983). «Взаимодействие хозяина и патогена: XXIV. Фрагменты, выделенные из клеточных стенок платана, выращенных в суспензии, ингибируют способность клеток включать [C] лейцин в белки» . Физиол растений . 72 (3): 864–869. дои : 10.1104/стр.72.3.864 . ПМЦ 1066335 . ПМИД 16663100 .
- ^ Уиллатс В.Г., Маккартни Л., Маки В., Нокс Дж.П. (сентябрь 2001 г.). «Пектин: клеточная биология и перспективы функционального анализа». Завод Мол. Биол . 47 (1–2): 9–27. дои : 10.1023/А:1010662911148 . ПМИД 11554482 . S2CID 13011973 .
- ^ Монен Д. (июнь 2008 г.). «Структура пектина и биосинтез». Курс. Мнение. Растительная биол . 11 (3): 266–77. дои : 10.1016/j.pbi.2008.03.006 . ПМИД 18486536 .
- ^ Хархолт Дж., Суттангкакул А., Вибе Шеллер Х. (июнь 2010 г.). «Биосинтез пектина» . Физиол растений . 153 (2): 384–95. дои : 10.1104/стр.110.156588 . ПМЦ 2879803 . ПМИД 20427466 .
- ^ Кохорн, Брюс Д. (2016). «Киназы, ассоциированные с клеточной стенкой, и восприятие пектина» . Журнал экспериментальной ботаники . 67 (2): 489–94. дои : 10.1093/jxb/erv467 . ПМИД 26507892 .
- ^ Jump up to: а б с д Кохорн Б.Д. (07 августа 2015 г.). «Состояние пектина клеточной стенки, контролируемое стеночно-ассоциированными киназами: модель» . Сигнализация и поведение растений . 10 (7): e1035854. дои : 10.1080/15592324.2015.1035854 . ПМЦ 4622591 . ПМИД 26251881 .
- ^ Jump up to: а б Кохорн Б.Д. (январь 2016 г.). «Киназы, ассоциированные с клеточной стенкой, и восприятие пектина» . Журнал экспериментальной ботаники . 67 (2): 489–94. дои : 10.1093/jxb/erv467 . ПМИД 26507892 .
- ^ Вораген, Альфонс Г.Дж.; Коэнен, Герд-Ян; Верхуф, Рене П.; Шолс, Хенк А. (1 апреля 2009 г.). «Пектин, универсальный полисахарид, присутствующий в стенках растительных клеток» . Структурная химия . 20 (2): 263. doi : 10.1007/s11224-009-9442-z .
- ^ Jump up to: а б с Кохорн Б.Д., Кохорн С.Л. (2012). «Киназы, ассоциированные с клеточной стенкой, WAK, как пектиновые рецепторы» . Границы в науке о растениях . 3 : 88. дои : 10.3389/fpls.2012.00088 . ПМЦ 3355716 . ПМИД 22639672 .
- ^ Jump up to: а б с д и ж Кохорн Б.Д., Йохансен С., Шишидо А., Тодорова Т., Мартинес Р., Дефео Э., Обрегон П. (декабрь 2009 г.). «Пектиновая активация киназы MAP и экспрессия генов зависят от WAK2» . Заводской журнал . 60 (6): 974–82. дои : 10.1111/j.1365-313x.2009.04016.x . ПМЦ 3575133 . ПМИД 19737363 .
- ^ Кохорн Б.Д. (январь 2016 г.). «Киназы, ассоциированные с клеточной стенкой, и восприятие пектина» . Журнал экспериментальной ботаники . 67 (2): 489–94. дои : 10.1093/jxb/erv467 . ПМИД 26507892 .
- ^ Jump up to: а б Хе Ж., Хе Д., Кохорн Б.Д. (1 апреля 1998 г.). «Необходимость индуцированной экспрессии киназы рецептора, связанной с клеточной стенкой, для выживания во время реакции патогена» . Заводской журнал . 14 (1): 55–63. дои : 10.1046/j.1365-313x.1998.00092.x . ПМИД 9681026 .