Этилат ниобия(V)
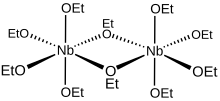 Скелетная структура этоксида ниобия (V)
| |
| Идентификаторы | |
|---|---|
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.019.814 |
| Номер ЕС |
|
ПабХим CID
|
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 10 Н 25 NbO 5 | |
| Молярная масса | 318.209 g mol −1 |
| Появление | Бесцветная жидкость |
| Плотность | 1,258 г см −3 |
| Температура плавления | 5 ° C (41 ° F; 278 К) |
| Точка кипения | 203 ° С (397 ° F; 476 К) |
| Н/Д; реагирует с водой [2] | |
| Термохимия | |
Стандартная энтальпия
образование (Δ f H ⦵ 298 ) |
−1583,9 ± 2,7 кДж моль −1 [3] |
Стандартная энтальпия
горение (Δ c H ⦵ 298 ) |
-6872,6 ± 1,7 кДж моль −1 [3] |
| Опасности | |
| СГС Маркировка : | |
 
| |
| Опасность | |
| Х226 , Х314 | |
| P210 , P233 , P240 , P241 , P242 , P243 , P260 , P264 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , П363 , П370+П378 , П403+П235 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 36 °С; 97 °Ф; 309 К |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Этилат ниобия(V) представляет собой металлорганическое соединение формулы Nb 2 (OC 2 H 5 ) 10 . Это бесцветная жидкость, которая растворяется в некоторых органических растворителях, но легко гидролизуется. [2] В основном используется для золь-гель обработки материалов, содержащих оксиды ниобия. [4]
Структура
[ редактировать ]Алкоксиды металлов редко принимают мономерные структуры, и этоксид ниобия (V) не является исключением. Ранние исследования установили, что алкоксиды ниобия агрегируют в растворе в виде димеров . [5] Последующий кристаллографический анализ установил, что метоксид и изопропоксиды ниобия принимают биооктаэдрические структуры. [6] С геометрической точки зрения десять атомов кислорода этоксидного лиганда молекулы Nb 2 (OEt) 10 в растворе образуют пару октаэдров, имеющих общий край с двумя атомами ниобия, расположенными в их центрах. С точки зрения связи каждый ниобиевый центр окружен октаэдрически четырьмя монодентатными и двумя мостиковыми этоксидными лигандами . Каждый из атомов кислорода мостиковых этоксидов связан с обоими ниобиевыми центрами, и эти два лиганда находятся в цис-положении друг к другу в координационной сфере . Формула [(EtO) 4 Nb(μ-OEt)] 2 более полно представляет эту димерную структуру, хотя для большинства целей обычно используется упрощенная формула.
Препарат и реакции
[ редактировать ]Это соединение получают метатезисом солей из пентахлорида ниобия (Et = C 2 H 5 ):
- 10 NaOEt + Nb 2 Cl 10 → Nb 2 (OC 2 H 5 ) 10 + 10 NaCl
Важнейшей реакцией алкоксидов ниобия является их гидролиз с образованием пленок и гелей оксидов ниобия. [4] Хотя эти реакции сложны, их можно описать этим упрощенным уравнением:
- Nb 2 (OC 2 H 5 ) 10 + 5 H 2 O → Nb 2 O 5 + 10 HOEt
Термическое разложение Nb(OC 2 H 5 ) 5 начинается выше 325 – 350 °С. Это можно наблюдать с помощью QMS по увеличению количества высвобождаемого этанола и этана . Диэтиловый эфир , C 2 H 5 OC 2 H 5 и оксид ниобия(V) являются продуктами разложения, выделяющимися в результате процесса атомно-слоевого осаждения или химического осаждения из паровой фазы . Реакцию разложения можно резюмировать следующим образом: [7]
- Nb 2 (OC 2 H 5 ) 10 → Nb 2 O 5 + 5 O(C 2 H 5 ) 2
Ссылки
[ редактировать ]- ^ CSID ChemSpider: 13600 . Химический Паук . Проверено 17 ноября 2012 г.
- ^ Перейти обратно: а б ВМ Хейнс. Справочник CRC по химии и физике, 93-е издание. Физические константы неорганических соединений.
- ^ Перейти обратно: а б «Этанолат ниобия(5+)» . webbook.nist.gov . Проверено 15 ноября 2012 г.
- ^ Перейти обратно: а б У. Шуберт «Золь-гель обработка соединений металлов» Комплексная координационная химия II 2003, страницы 629–656 Том 7. два : 10.1016/B0-08-043748-6/06213-7
- ^ Брэдли, округ Колумбия ; Холлоуэй, CE (1968). «Исследование пентаалкоксидов ниобия и тантала методом ядерного магнитного резонанса». Дж. Хим. Соц. А : 219–223. дои : 10.1039/J19680000219 . S2CID 98638647 .
- ^ Мехротра, Рам К .; Сингх, Анируд (1997). «Последние тенденции в химии алкоксидов металлов» . В Карлине, Кеннет Д. (ред.). Прогресс неорганической химии . Том. 46. Джон Уайли и сыновья . стр. 239–454. дои : 10.1002/9780470166475.ch4 . ISBN 9780470167045 .
- ^ Рахту, Антти (2002). Атомно-слоевое осаждение оксидов с высокой диэлектрической проницаемостью: рост пленки и исследования in situ (диссертация). Университет Хельсинки. hdl : 10138/21065 . ISBN 952-10-0646-3 .
