трет- Бутилоксикарбонильная защитная группа
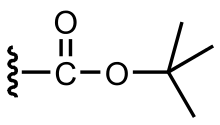
Трет - бутилоксикарбонильная защитная группа или трет- бутоксикарбонильная защитная группа [1] ( ВОС-группа ) — кислотолабильная используемая защитная группа, в органическом синтезе .
Вос-группу можно присоединить к аминам в водных условиях с использованием ди- трет -бутилдикарбоната в присутствии такого основания, как гидроксид натрия :
Защиту аминов также можно осуществить в растворе ацетонитрила, используя 4-диметиламинопиридин в качестве основания (ДМАП).
Удаление BOC-группы в аминокислотах можно осуществить с помощью сильных кислот, таких как трифторуксусная кислота в дихлорметане или HCl в метаноле . [2] [3] [4] Осложнением может быть тенденция промежуточного т -бутильного катиона алкилировать другие нуклеофилы; поглотители, такие как анизол или тиоанизол . можно использовать [5] [6] Селективное расщепление группы N -Boc в присутствии других защитных групп возможно при использовании AlCl 3 .
последовательную обработку триметилсилилиодидом , а затем метанолом. Для снятия Вос-защиты также можно использовать [7] [8] особенно там, где другие методы снятия защиты слишком агрессивны для субстрата. [9] Механизм включает силилирование карбонильного кислорода и отщепление трет -бутилиодида ( 1 ), метанолиз силилового эфира до карбаминовой кислоты ( 2 ) и, наконец, декарбоксилирование до амина ( 3 ). [10]
| R 2 NCO 2 t Bu + Me 3 SiI → R 2 NCO 2 SiMe 3 + t BuI | ( 1 ) |
| R 2 NCO 2 SiMe 3 + MeOH → R 2 NCO 2 H + MeOSiMe 3 | ( 2 ) |
| Р 2 NCO 2 H → R 2 NH + CO 2 | ( 3 ) |
Аминовая защита
[ редактировать ]
Трет - бутилоксикарбонильная группа ( Boc ) используется в качестве защитной группы для аминов в органическом синтезе .
Распространенные методы защиты от аминов
[ редактировать ]- Простое быстрое перемешивание смеси амина и ди- трет -бутилдикарбоната (Boc 2 O), суспендированных в воде при температуре окружающей среды, пример реакции на воде . [11]
- Нагревание смеси защищаемого амина и ди- трет -бутилдикарбоната в тетрагидрофуране (ТГФ) при 40 °C. [12]
- Добавьте амин к гидроксиду натрия и ди -трет -бутилдикарбонату в воде и ТГФ при 0 °C, затем нагрейте до температуры окружающей среды. [13]
- Нагревание смеси защищаемого амина и ди- трет -бутилдикарбоната в двухфазной смеси хлороформа и водного бикарбоната натрия при кипячении с обратным холодильником в течение 90 минут. [14]
- Добавьте амин к ди- трет -бутилдикарбонату, 4-диметиламинопиридину (DMAP) и ацетонитрилу (MeCN) при температуре окружающей среды. [15]
Вос-защищенные амины получают с использованием реагента ди- трет -бутилиминодикарбоксилата . При депротонировании этот реагент образует дважды BOC-защищенный источник NH. −
2 , который может быть N -алкилирован. Этот подход дополняет Габриэлем синтез аминов .
Распространенные методы снятия защиты с аминов
[ редактировать ]- Смешайте защищенный карбамат, с которого нужно снять защиту, с 3 М соляной кислотой (HCl) в этилацетате в течение 30 минут при температуре окружающей среды. [16]
- Нагрейте карбамат в смеси водного раствора соляной кислоты и толуола при 65 °С. [17]
- Растворение желаемого защищенного соединения в смеси дихлорметана и трифторуксусной кислоты 50/50. [18]
Ссылки
[ редактировать ]- ^ «Правила сокращения защитных групп» (PDF) . ИЮПАК . iupac.org. 2013.
- ^ Роберт М. Уильямс; Питер Дж. Синклер; Дуэйн Э. ДеМонг; Даймо Чен; Дунгуань Чжай (2003). «Асимметричный синтез N - трет -Бутоксикарбонил-α-аминокислот. Синтез (5S , 6R ) -4 -трет -Бутоксикарбонил-5,6-дифенилморфолин-2-она (4-морфолинкарбоновой кислоты, 6-оксо-2 ,3-дифенил-,1,1-диметилэтиловый эфир, (2S , 3R ) -)]" . Органические синтезы . 80 : 18. дои : 10.15227/orgsyn.080.0018 .
- ^ Э.А. Энглунд; Х. Н. Гопи; Д. Х. Аппелла (2004). «Эффективный синтез зонда для функции белка: 2,3-диаминопропионовая кислота с ортогональными защитными группами». Орг. Летт. 6 (2): 213–215. дои : 10.1021/ol0361599 . ПМИД 14723531 .
- ^ ДМ Шендейдж; Р. Фрелих; Г. Хауфе (2004). «Высокоэффективное стереоконсервативное амидирование и деамидирование α-аминокислот». Орг. Летт. 6 (21): 3675–3678. дои : 10.1021/ol048771l . ПМИД 15469321 .
- ^ Лундт, Беренд Ф.; Йохансен, Нильс Л.; Вёлунд, Оге; Маркуссен, Ян (1978). «Удаление т -бутильных и т -бутоксикарбонильных защитных групп трифторуксусной кислотой». Межд. Дж. Пепт. Белок Рез. 12 (5): 258–268. дои : 10.1111/j.1399-3011.1978.tb02896.x . ПМИД 744685 .
- ^ Воммина В. Сурешбабу; Нарасимхамурти Нарендра (2011). «Защитные реакции» . В Эндрю Б. Хьюзе (ред.). Защитные реакции, медицинская химия, комбинаторный синтез . Аминокислоты, пептиды и белки в органической химии. Том. 4. Вайли-ВЧ . стр. XVIII – LXXXIV. дои : 10.1002/9783527631827.ch1 . ISBN 9783527641574 .
- ^ Ричард С. Лотт; Вирандер С. Чаухан; Чарльз Х. Стаммер (1979). «Триметилсилилиодид как агент, блокирующий пептиды». Дж. Хим. Соц., хим. Коммун. (11): 495–496. дои : 10.1039/C39790000495 .
- ^ Ола, Г; Наранг, Южная Каролина (1982). «Йодотриметилсилан — универсальный синтетический реагент». Тетраэдр . 38 (15): 2225–2277. дои : 10.1016/0040-4020(82)87002-6 .
- ^ Чжицзянь Лю; Нобуёси Ясуда; Майкл Симеоне; Роберт А. Ример (2014). « Метод снятия N -Boc-защиты и выделения водорастворимых цвиттерионных соединений». Дж. Орг. хим. 79 (23): 11792–11796. дои : 10.1021/jo502319z . ПМИД 25376704 .
- ^ Майкл Э. Юнг; Марк А. Листер (1978). «Превращение алкилкарбаматов в амины обработкой триметилсилилиодидом». Дж. Хим. Соц., хим. Коммун. (7): 315–316. дои : 10.1039/C39780000315 .
- ^ Чанкешвара, Сунай В.; Чакраборти, Асит К. (2006). «Безкатализаторное хемоселективное N -трет-бутилоксикарбонилирование аминов в воде». Орг. Летт. 8 (15): 3259–3262. дои : 10.1021/ol0611191 . ПМИД 16836380 .
- ^ Вутс, Питер ГМ; Грин, Теодора В. (2006). «Защита группы Амино» . Защитные группы Грина в органическом синтезе (4-е изд.). Джон Уайли и сыновья . стр. 696–926. дои : 10.1002/9780470053485.ch7 . ISBN 9780471697541 .
- ^ Фачао Ян; Ханбин Лян; Цзянь Сун; Цзе Цуй; Цин Лю; Шэн Лю; Пин Ван; Юнхуэй Донг; Хуэй Лю (2017). «Катализируемая палладием реакция циклизации-Хека алленамидов: подход к производным 3-метилен-5-фенил-1,2,3,4-тетрагидропиридина». Орг. Летт. 19 (1): 86–89. doi : 10.1021/acs.orglett.6b03364 . ПМИД 27966983 .
- ^ Тарбелл, Д. Стэнли; Ямамото, Ютака; Поуп, Барри М. (1972). «Новый метод получения производных N - т -бутоксикарбонила и соответствующих аналогов серы из ди- т -бутилдикарбоната или ди -т -бутилдитиолдикарбонатов и аминокислот» . Учеб. Натл. акад. наук. США 69 (3): 730–732. Бибкод : 1972ПНАС...69..730Т . дои : 10.1073/pnas.69.3.730 . ПМК 426545 . ПМИД 16591972 .
- ^ Инглунд, Итан А.; Гопи, Хосахудья Н.; Аппелла, Дэниел Х. (2004). «Эффективный синтез зонда для функции белка: 2,3-диаминопропионовая кислота с ортогональными защитными группами». Орг. Летт. 6 (2): 213–215. дои : 10.1021/ol0361599 . ПМИД 14723531 .
- ^ Шталь, Гленн Л.; Уолтер, Родерих; Смит, Кларк В. (1978). «Общая методика синтеза моно- N -ацилированных 1,6-диаминогексанов». Дж. Орг. хим. 43 (11): 2285–2286. дои : 10.1021/jo00405a045 .
- ^ Прашад, Махавир; Хар, Денис; Ху, Бин; Ким, Хон-Ён; Гиргис, Майкл Дж.; Чаудхари, Апурва; Репич, Ольян; Блэклок, Томас Дж.; Мартерер, Вольфганг (2004). «Разработка процесса крупномасштабного синтеза TKA731: антагониста рецептора тахикинина». Орг. Процесс Рез. Дев. 8 (3): 330–340. дои : 10.1021/op0341824 .
- ^ «Снятие Boc-защиты – TFA» .


