Иммунолипосомная терапия
Иммунолипосомальная терапия — это метод адресной доставки лекарств, который включает использование липосом (искусственных липидных двухслойных везикул) в сочетании с моноклональными антителами для доставки терапевтических агентов в определенные участки или ткани организма. [1] Модифицированные антителами липосомы воздействуют на ткани посредством клеточно-специфичных антител с высвобождением лекарств, содержащихся в ассимилированных липосомах. [1] Целью иммунолипосомы является улучшение стабильности лекарств, персонализация лечения и повышение эффективности лекарств. [1] Эта форма терапии использовалась для воздействия на определенные клетки, защищая инкапсулированные лекарства от деградации, чтобы повысить их стабильность, облегчить устойчивое высвобождение лекарств и, следовательно, улучшить современное традиционное лечение рака . [1]
История
[ редактировать ]Алек Д. Бэнгэм открыл липосомы в 1960-х годах как сферические везикулы, состоящие из бислоя фосфолипидов, в котором находятся гидрофильные ядра. [2] Затем липосомы были изучены, чтобы раскрыть свойства биологических мембран, и с 1968 по 1975 год был открыт метод гидратации для получения искусственных липосом. [2] С тех пор было использовано множество методов получения липосом и изучены их характеристики (физические и химические). [2]
Моноклональные антитела — это белки, которые прикрепляются к определенным антигенам , маркирующим определенные клетки, и могут быть синтезированы в лаборатории. [3] Впервые они были созданы в 1975 году и с тех пор стали использоваться для иммунотерапии. [3]
Иммунолипсомы были разработаны с использованием обоих этих компонентов. [1] Первым противораковым препаратом, полученным с помощью этого метода, был доксорубицин (DOX) в 1990-х годах. [4]
Состав и структура
[ редактировать ]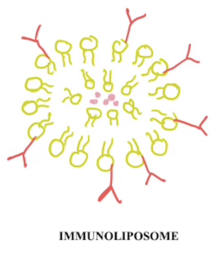
Основная структура иммунолипосом представляет собой липидный бислой . Этот липидный бислой образует гидрофильное ядро, которое обеспечивает стабильную инкапсуляцию терапевтической нагрузки. [5] Обычно используемые липиды — это фосфатидилхолин (ФХ), фосфатидилэтаноламин (ПЭ) и холестерин . [5] Липидный бислой подвергается поверхностной модификации посредством конъюгации с использованием моноклональных антител для специфического распознавания клеток-мишеней или представляющих интерес тканей. [5] Ядро иммунолипосомы содержит терапевтическую полезную нагрузку, которая может представлять собой что угодно: небольшие лекарства, нуклеиновые кислоты, пептиды или средства визуализации. [5]
Часто присутствуют стабилизаторы и наполнители для обеспечения рецептуры, стабильности и функциональности. [5] Некоторые из них включают полиэтиленгликоль (ПЭГ), антиоксиданты для предотвращения деградации липидов и буферные агенты для оптимального pH. [5]
Синтез
[ редактировать ]Иммунолипосомы создаются при конъюгации антител с липосомами. [6] Один из способов сделать это — создать ковалентные связи между антителом (или его фрагментом) и липидом. [6] Другой способ — химическая модификация антител, чтобы они имели более высокое сродство к липосомам. [6] «В целом методика конъюгации основана на трёх основных реакциях; реакция между активированными карбоксильными группами и аминогруппами, которая дает амидную связь, реакция между пиридилдитиолами и тиолами, которая дает дисульфидные связи, и реакция между малеимида производными и тиолами, которая дает тиоэфирные связи». [6]
Конъюгация через карбоксильные и аминоостатки
[ редактировать ]
Аминные группы присутствуют во всем антителе и используются в качестве мишени из-за их легкой стерической доступности и легкой модификации. Обзор этой реакции можно найти на рисунке 2 . Чаще всего аминогруппы, обнаруженные у лизина, ковалентно связываются с группами глутаминовой карбоксильными и аспарагиновой кислоты на образующихся липосомах с помощью определенных агентов. Используется двухэтапный процесс, где на первом этапе используется 1-этил-3-[3-диметиламинопропил]карбодиимид для создания реакционноспособного амина продукта из карбоксильной группы. [6] Этот продукт является мишенью для нуклеофильной атаки амина, но он быстро гидролизуется, поэтому для его стабилизации добавляют EDC. Как видно на рисунке 2 , промежуточное соединение может случайно привести к желаемой стабильной амидной связи или к восстановлению карбоксильной группы. [6] Чтобы создать больше желаемой связи карбоксиламин, добавляют N-гидроксисульфосукцинимид (сульфо-NHS) с образованием другого промежуточного продукта, который представляет собой сложный эфир NHS. [6] Вторым шагом этой реакции является использование антителами N-конца липида для ковалентного конъюгирования путем создания амидной связи путем замещения сульфо-NHS-групп. [6] Это приводит к получению конечного продукта антитела, конъюгированного с липосомой, с образованием иммунолипосомы. Этот процесс является высокоэффективным и действенным при сохранении биологической активности антитела. [6]
Конъюгация через тиоловую группу
[ редактировать ]Другой процесс создания иммунолипосом заключается в использовании тиоловой группы и создании тиоэфирной связи. [6] Сульфгидрильная группа является ключевым игроком. Она содержится в цистеиновых мостиках белков и реагентов, таких как реагенты Траута , SATA и Sulfo-LC-SPDP. [6] Восстановление или гидролиз этих групп приводит к образованию тиоловых групп, которые создают конъюгацию антител с липидами. [6] Существует несколько методов этого процесса, и один из них использует сшивающий агент SATA, как показано на рисунке 3 . [6] Эфирный конец SATA реагирует с аминогруппами белков с образованием амидной связи и молекулы с защищенной сульфгидрильной группой. [6] Чтобы продолжить реакцию, эту группу необходимо освободить, что делается путем добавления гидроксиламина. Следующим шагом является добавление химического вещества, которое может стать якорем между липидом и тиоловой группой. Некоторыми примерами молекул, которые способны быть таким якорем, являются малеимидные, йодацетильные группы или 2-пиридилдитиоловые группы. [6] В конечном итоге на этих этапах создается конъюгат антитело-фермент, в состав которого входит тиоловая группа. [6]
Механизм действия
[ редактировать ]Иммунолипосомы обладают той же функциональностью, что и липосомы, но с добавленной мерой конъюгации моноклональных антител и их фрагментов с липосомами. [6] Использование антител позволяет легко нацеливаться, поскольку они могут распознавать множество различных типов антигенов. [6] Больные клетки обычно содержат больше антигенов, чем здоровые клетки, поэтому антитела способны соответствующим образом нацеливаться на определенные внеклеточные домены (в зависимости от сверхэкспрессии антигена) и убивать больные клетки. [6] Липосомальная доставка лекарств в сочетании с антителами в качестве нацеливающего лиганда помогает иммунолипосомам функционировать как эффективный носитель лекарств. [6]

Как только иммунолипосомы доставляют соответствующие лекарства в клетки-мишени, они могут проникнуть в клетку, используя либо селективное поглощение липосом путем эндоцитоза, либо высвобождение липосом вблизи клетки-мишени. [6] Из-за соединения антител количество клеточного поглощения иммунолипосом увеличивается, что позволяет лучше проникнуть лекарству в больные клетки. [6] Чтобы контролировать высвобождение лекарства, разрабатываются иммунолипосомы, способные воспринимать раздражители. Эти стимулы могут исходить из микроокружения опухоли с использованием таких факторов, как снижение pH, температуры и уровня ферментов. [6] Внешние раздражители, такие как свет, тепло, магнитные поля или ультразвук, также могут спровоцировать высвобождение лекарства. [6]
Иммунолипосомы могут воздействовать на самые разные клетки. Его можно разделить на два основных типа, обычно известных как внутрисосудистое и внесосудистое пространство, как показано на рисунке 4 . [7] Внутрисосудистые клетки более доступны во время кровообращения и включают эритроциты , миелоидные клетки , лимфоциты , нейтрофилы и др. [7] Внесосудистые клетки располагаются на тканевых паренхиматозных или стромальных клетках. [7] Поскольку иммунолипосомы содержат множество копий антител, они обладают более высокой авидностью, чем одно антитело в отдельности, что позволяет эффективно нацеливаться на раковые клетки и некоторые клетки, устойчивые к лекарствам. [7]
Приложения
[ редактировать ]При применении иммунолипосом используют ее способность действовать как система доставки лекарств и высвобождать определенные компоненты лекарства в клетки-мишени. Этот механизм можно особо выделить при нацеливании на раковые клетки и через системы доставки питательных веществ.
Нацеливание на раковые клетки
[ редактировать ]Наиболее распространенным применением иммунолипосом является воздействие на раковые клетки с помощью различных антител. Рецепторы фолиевой кислоты и рецепторы трансферрина обычно сверхэкспрессируются на раковых клетках, поэтому иммунолипосомы будут нацелены на соответствующие лиганды. [8] Рецепторы фолата определяют специфичность опухолевых клеток и, как было замечено, экспрессируются при многих воспалительных заболеваниях, включая псориаз , болезнь Крона , атеросклероз и ревматоидный артрит , что делает иммунолипосомы, нацеленные на фолаты, эффективным носителем лекарств для доставки противовоспалительных препаратов. [8] Рецепторы трансферрина помогают удовлетворить потребность в железе в пролиферации раковых клеток и позволяют создавать противораковые методы лечения, нацеленные на рецепторы трансферрина. [8] EGFR (эпидермальный фактор роста) представляет собой рецептор тирозинкиназы, сверхэкспрессируемый в солидных опухолях, таких как колоректальный рак, немелкоклеточный рак легких, плоскоклеточный рак и рак молочной железы, что делает его еще одним целевым рецептором для иммунолипосом. [8] Некоторые виды рака создают опухоли, в которых сверхэкспрессируются несколько различных рецепторов, или используются раковые стволовые клетки, которые позволяют дифференцировать многочисленные типы рака, поэтому для борьбы с этим создаются иммунолипосомы двойного действия, нацеленные на несколько лигандов и повышающие терапевтическую эффективность. [9] Исследование обеспечивает многообещающую доклиническую демонстрацию эффективности и простоты приготовления иммунолипосом, нагруженных валрубицином (Val-IL), как новой технологии наночастиц. В контексте гематологического рака Val-IL могут быть использованы в качестве точной и эффективной терапии, основанной на целевой гибели клеток, опосредованной везикулами. [10]
Система доставки питательных веществ
[ редактировать ]Иммунолипосомы также можно использовать в качестве систем доставки питательных веществ, помогающих стимулировать активность мозга. Эффективный транспорт определенных питательных веществ в гипоталамус для регулирования активности мозга в настоящее время представляет собой огромную проблему. [11] Ген лептина . используется для регулирования петель обратной связи и отправки сигналов от жировой ткани в гипоталамус [11] Используя эту физиологическую функцию лептина, иммунолипосомные системы доставки питательных веществ могут быть интегрированы в организм, чтобы способствовать транспортировке питательных веществ в мозг, как показано на рисунке 5 . [11] Рецепторы трансферрина имеют высокую экспрессию на ГЭБ ( гематоэнцефалический барьер ) и могут использоваться в качестве мишеней для иммунолипосом для транспортировки веществ p-гликопротеина. [11]
Преимущество и ограничения
[ редактировать ]Иммунолипосомы имеют множество возможных применений, как описано выше, и имеют определенные преимущества в новых исследованиях и идеях. [6] Некоторые исследуемые преимущества включают иммунолипосомы, нацеленные на определенные молекулы в организме. [6] В ходе доклинических испытаний они могут быть экологически чувствительными к определенным условиям температуры, pH, ферментам, окислительно-восстановительным реакциям, магнитной энергии и свету для высвобождения лекарств. [6] Эта условная способность позволяет иммунолипосомам фокусироваться на определенных целевых областях, что может быть полезно для доставки лекарств. [6] Повышенная направленность позволяет снизить системную токсичность при одновременном увеличении концентрации препарата в определенном месте. [6] Даже несмотря на это преимущество иммунолипосом, существуют некоторые проблемы при их применении.
Успех иммунолипосом во время испытаний in vivo был продемонстрирован несколькими группами, включая Meeroekyai et al., 2023. [12] и испытания на животных были успешными в таких группах, как Refaat et al 2022. [13] Тем не менее, они изо всех сил пытаются добиться успеха на более высоком уровне и в клинических испытаниях. [6] Эта проблема связана с изменчивостью и отсутствием понимания опухолей, фармакокинетики и крупномасштабного производства иммунолипосом. Например, опухоли различаются, но обычно имеют повышенную проницаемость сосудов и снижение лимфатического дренажа, что приводит к эффекту ЭПР. EFR — это эффект повышенной проницаемости и удержания, от которого зависят носители лекарственного средства, но эффект и окружающая среда могут различаться в солидных опухолях. [14] Эта изменяющаяся среда затрудняет прогнозирование действия иммунолипосомы и количественную оценку ее фармакокинетики. [6] Кроме того, вызывает обеспокоенность то, что модели на животных, используемые в доклинических испытаниях, не будут отражать тот же эффект на людях. [6] Из-за этой идеи, несмотря на любые доклинические успехи, существует обеспокоенность по поводу проведения испытаний на людях из-за неизвестных рисков. Для экологически чувствительных иммунолипосом для получения конечного продукта требуется больше стадий модификации и очистки. Это увеличение сложности иммунолипосом и их поведения также увеличивает затраты. [6] Еще одной проблемой для конкурентоспособности и клинических исследований является сложность масштабирования производства иммунолипосом. Процедура и использование небольших количеств в лаборатории делают масштабирование производства проблемой, на которую не обращали внимания. [6]
Исследовать
[ редактировать ]Исследования липосомальной медицины для лечения рака с годами увеличились в качестве альтернативы традиционному лечению рака. [15] Существует интерес к липосомальной медицине, поскольку она обеспечивает адресную доставку лекарств, одновременно уменьшая повреждение здоровых клеток и тканей. [15] Одним из комбинированных продуктов липосомальной терапии, который исследуется для применения в терапии рака, является иммунолипосомная терапия. [15] Другие области исследований в области комбинированной липосомальной терапии включают фотодинамическую терапию , фототермические агенты, лучевую терапию и агенты газотерапии. [15]
Завершенное клиническое исследование иммунолипосомной терапии проводилось Швейцарской группой клинических исследований рака с 2006 по 2009 год . [16] Исследование представляло собой клиническое исследование фазы II, в котором рассматривалась комбинация коммерчески продаваемого доксорубицина с бевацизумабом , моноклональным антителом, которое блокирует рост опухоли. [16] Терапия использовалась для лечения пациентов с местно-рецидивирующим или метастатическим раком молочной железы . [16] По данным исследования, из 43 пациентов у 16 была ладонно-подошвенная эритродизестезия 3 степени, у одного - мукозит 3 степени и у одного - тяжелая кардиотоксичность. [16] В результате комбинированная терапия продемонстрировала более высокую, чем ожидалось, токсичность, имея при этом лишь умеренный терапевтический эффект. [16] Эти результаты пришли к выводу, что, хотя иммунолипосомная терапия является многообещающей, необходимы дополнительные исследования, прежде чем ее можно будет превратить в коммерческие продукты. [16]
Коммерциализация
[ редактировать ]В настоящее время коммерчески доступно несколько липосомальных препаратов, которые помогают установить путь регулирования иммунолипосомной терапии. [15]
По мере развития исследований в области иммунолипосомной терапии крупные игроки рынка фармацевтических исследований и производства инвестировали в разработку этих методов лечения. [15] Соответствующим примером этого является исследование фазы I/II , в котором изучалась эффективность PDS0101 в сочетании с пембролизумабом , ингибитором иммунных контрольных точек (продаваемым под торговой маркой Кейтруда ). [17] Исследование финансируется PDS Biotechnology и в партнерстве с Merck . [18] Цель исследования — определить эффективность комбинации PDS0101 + пембролизумаб в уменьшении опухолей у пациентов с вирусозависимыми раковыми опухолями ротоглотки у человека. [15] PDS0101 — это вакцина на основе пептидов, которая способствует иммунному ответу и уничтожает опухолевые клетки. [15] В исследовании также используются моноклональные антитела к пембролизумабу, которые помогают иммунной системе организма атаковать рак и препятствуют распространению опухолевых клеток. [15] Хотя иммунолипосомная терапия демонстрирует клинические и коммерческие перспективы, существует несколько известных проблем при переходе от лабораторных исследований к клиническим исследованиям и, в конечном итоге, к коммерциализации. [15] Одним из препятствий является то, что терапия иммунолипосомами ограничена коротким периодом полураспада и временем удерживания после достижения микроокружения опухоли. [15] Кроме того, иммунолипосомная терапия часто индивидуализирована, что требует тщательного клинического мониторинга и комплексных методов оценки. [15] С биохимической точки зрения другими проблемами, с которыми сталкивается иммунолипосомная терапия, являются нестабильность лекарственного средства из-за бислоя фосфолипидов и известная возможность гепатотоксичности . [15] С точки зрения производства разработка липосомальных систем доставки лекарств в промышленном масштабе может представлять собой проблему из-за сложности этих механизмов высвобождения лекарств и связанной с ними биобезопасности. [15]
Похожие подходы
[ редактировать ]Хотя иммунолипосомы являются возможным достижением, существуют и другие методы лечения, подобные им, которые играют роль систем таргетной доставки лекарств. [19] Одним из примеров такой терапии являются иммунные полимерные наночастицы , которые похожи на липосомы, но состоят из небольших частиц, состоящих из биоразлагаемых полимеров. [19] Эти наночастицы аналогичным образом инкапсулируют лекарства и могут повышать специфичность в отношении целевых больных клеток с помощью пептидных лигандов. [19] Другой тип — это таргетные конъюгаты антител с лекарственными средствами , которые сочетают моноклональные антитела с цитотоксичностью химиотерапевтических препаратов. [20] Этот конкретный тип предназначен для раковых клеток, экспрессирующих определенный целевой антиген. [20] Они хорошо переносятся организмом, поскольку являются биоразлагаемыми, устраняют многие потенциальные факторы токсичности и могут стать новой моделью терапии. [20]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Пашко Э., Сенге М.О. (2012). «Иммунолипосомы». Современная медицинская химия . 19 (31): 5239–5277. дои : 10.2174/092986712803833362 . ПМИД 22934774 .
- ^ Jump up to: а б с Тручильо П., Кампарделли Р., Ревершон Э. (сентябрь 2020 г.). «Липосомы: от Бангама до сверхкритических жидкостей» . Процессы . 8 (9): 1022. дои : 10.3390/pr8091022 . ISSN 2227-9717 .
- ^ Jump up to: а б «Моноклональные антитела и их побочные эффекты» . www.cancer.org . Проверено 22 марта 2024 г.
- ^ Лю Дж. К. (декабрь 2014 г.). «История разработки моноклональных антител – прогресс, оставшиеся проблемы и будущие инновации» . Анналы медицины и хирургии . 3 (4): 113–116. дои : 10.1016/j.amsu.2014.09.001 . ПМЦ 4284445 . ПМИД 25568796 .
- ^ Jump up to: а б с д и ж Фултон, доктор медицинских наук, Наджахи-Миссауи, W (апрель 2023 г.). «Липосомы в терапии рака: как мы начинали и где мы находимся сейчас» . Международный журнал молекулярных наук . 24 (7): 6615. doi : 10.3390/ijms24076615 . ПМЦ 10095497 . ПМИД 37047585 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть Сандип Д., Аль-Савафтах Н.М., Хусейни Дж. (23 февраля 2024 г.). «Иммунолипосомы: синтез, структура и их потенциал в качестве носителей доставки лекарств» (PDF) . Текущие обзоры лечения рака . 16 (4): 306–319. дои : 10.2174/1573394716666200227095521 . hdl : 11073/19721 .
- ^ Jump up to: а б с д Ди Дж, Се Ф, Сюй Ю (2020). «Когда липосомы встретились с антителами: доставка лекарств и не только». Обзоры расширенной доставки лекарств . 154–155: 151–162. doi : 10.1016/j.addr.2020.09.003 . ПМИД 32926944 .
- ^ Jump up to: а б с д Тенчов Р., Бёрд Р., Курце А.Е., Чжоу Ц (ноябрь 2021 г.). «Липидные наночастицы — от липосом до доставки вакцин на основе мРНК: разнообразие исследований и прогресс» . АСУ Нано . 15 (11): 16982–17015. дои : 10.1021/acsnano.1c04996 . ПМИД 34181394 .
- ^ Ким Дж.С., Шин Д.Х., Ким Дж.С. (январь 2018 г.). «Имунолипосомы двойного нацеливания с использованием антитела ангиопеп-2 и CD133 для стволовых клеток глиобластомы». Журнал контролируемого выпуска . 269 : 245–257. дои : 10.1016/j.jconrel.2017.11.026 . ПМИД 29162480 .
- ^ Георгиевски А., Беллай П.С., Турнье Б., Шубли Х., Паис де Баррос Ж.П., Хербст М. и др. (май 2024 г.). «Имунолипосомы, нагруженные валрубицином, для специфической гибели клеток, опосредованной везикулами, при лечении гематологического рака» . Дисциплина о гибели клеток (15(5):328). дои : 10.1038/s41419-024-06715-5 . ПМЦ 11088660 . ПМИД 38734740 .
- ^ Jump up to: а б с д Сянхуа Ю, Цзыжун X (декабрь 2006 г.). «Использование иммунолипосом для целевой регуляции питательных веществ (обзор)». Критические обзоры в области пищевой науки и питания . 46 (8): 629–638. дои : 10.1080/10408390500507167 . ПМИД 17092828 .
- ^ Мирокьяй С., Джаймалай Т., Сури Н., Прангкио П. (февраль 2024 г.). "CD4 + Иммунолипосомы, нацеленные на Т-клетки, для лечения латентного резервуара ВИЧ». European Journal of Pharmaceutics and Biopharmaceutics . 195 : 114166. doi : 10.1016/j.ejpb.2023.12.006 . PMID 38110161 .
- ^ Рефаат А., дель Росаль Б., Бонгкарон В., Уолш А.П., Питерс Г., Питер К. и др. (январь 2023 г.). «Активированные иммунолипосомы IR780, нацеленные на тромбоциты, для фототермического тромболизиса» . Передовые функциональные материалы . 33 (4). дои : 10.1002/adfm.202209019 . ISSN 1616-301X .
- ^ У Дж (август 2021 г.). «Эффект повышенной проницаемости и удержания (EPR): значение концепции и методы улучшения ее применения» . Журнал персонализированной медицины . 11 (8): 771. дои : 10.3390/jpm11080771 . ПМК 8402171 . ПМИД 34442415 .
- ^ Jump up to: а б с д и ж г час я дж к л м н Чен Дж., Ху С., Сунь М., Ши Дж., Чжан Х., Юй Х. и др. (февраль 2024 г.). «Последние достижения и клиническое применение липосомальных систем доставки в терапии рака» . Европейский журнал фармацевтических наук . 193 : 106688. doi : 10.1016/j.ejps.2023.106688 . ПМИД 38171420 .
- ^ Jump up to: а б с д и ж Швейцарская группа клинических исследований рака (26 июня 2012 г.). Бевацизумаб и пегилированный липосомальный доксорубицин как терапия первой линии при местно-рецидивирующем или метастатическом раке молочной железы. Многоцентровое исследование фазы II с одной группой (отчет). www.clinicaltrials.gov.
- ^ PDS Biotechnology Corp. (12 марта 2024 г.). Открытое многоцентровое исследование фазы II комбинированной иммунотерапии PDS0101 и пембролизумаба (KEYTRUDA®) у субъектов с рецидивирующей и/или метастатической HNSCC и инфекцией HPV16 высокого риска (отчет). www.clinicaltrials.gov.
- ^ «РАЗРАБОТКА МОЩНЫХ, БЕЗОПАСНЫХ, УНИВЕРСАЛЬНЫХ ИММУНОТЕРАПИЙ» . pdsbiotech.com . Проверено 12 апреля 2024 г.
- ^ Jump up to: а б с Лю Ц, Ван Х, Лю Х, Кумар С., Гочман Г, Цзи Ю и др. (апрель 2019 г.). «Использование платформы полимерных наночастиц, нацеленной на печень, для индукции Treg-опосредованной антиген-специфической иммунной толерантности в модели сенсибилизации легочных аллергенов» . АСУ Нано . 13 (4): 4778–4794. дои : 10.1021/acsnano.9b01444 . ПМК 6506187 . ПМИД 30964276 .
- ^ Jump up to: а б с Шастри М., Гупта А., Чандарлапати С., Янг М., Паулз Т., Гамильтон Э. (май 2023 г.). «Рост конъюгатов антитело-лекарство: настоящее и будущее». Учебная книга Американского общества клинической онкологии. Американское общество клинической онкологии. Ежегодное собрание . 43 (43): e390094. дои : 10.1200/EDBK_390094 . ПМИД 37229614 .