Торговля мембранными пузырьками
Транспортировка мембранных пузырьков в эукариотических клетках животных включает перемещение биохимических сигнальных молекул из мест синтеза и упаковки в теле Гольджи в определенные места высвобождения на внутренней стороне плазматической мембраны секреторной клетки. микроразмера Это происходит в форме связанных с мембраной Гольджи везикул , называемых мембранными везикулами (МВ).
В этом процессе упакованные клеточные продукты высвобождаются или секретируются за пределы клетки, через ее мембрану. С другой стороны, везикулярная мембрана сохраняется и перерабатывается секреторными клетками. явление играет важную роль в синаптической нейротрансмиссии , эндокринной секреции, секреции слизи гранулярных продуктов , секреции нейтрофилами Это и других явлениях. Ученые, сделавшие это открытие, были удостоены Нобелевской премии за 2013 год.
В прокариотических бактериальных грамотрицательных клетках транспорт мембранных везикул опосредован через наноразмерные везикулы, ограниченные внешней мембраной бактерий, называемые везикулами внешней мембраны (OMV). Однако в этом случае мембрана OMV также секретируется вместе с содержимым OMV за пределы секреторно-активной бактерии . Это другое явление играет важную роль во взаимодействиях хозяин-патоген , эндотоксическом шоке у пациентов, инвазии и инфекции животных или растений, межвидовой бактериальной конкуренции, распознавании кворума, экзоцитозе и других областях.
Движение внутри эукариотических клеток
[ редактировать ]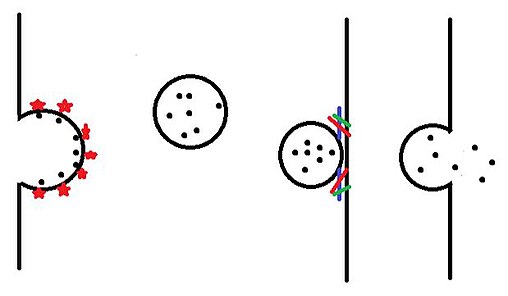
Как только везикулы производятся в эндоплазматическом ретикулуме и модифицируются в теле Гольджи, они направляются в различные пункты назначения внутри клетки. Везикулы сначала покидают тело Гольджи и попадают в цитоплазму в процессе, называемом почкованием. Затем везикулы перемещаются к месту назначения с помощью моторных белков . Как только везикула достигает пункта назначения, она соединяется с билипидным слоем в процессе, называемом слиянием , а затем высвобождает свое содержимое.
зарождающийся
[ редактировать ]Рецепторы, встроенные в мембрану тела Гольджи, связывают специфический груз (например, дофамин) на просветной стороне пузырька. Эти рецепторы груза затем рекрутируют различные белки, включая другие рецепторы груза и белки оболочки, такие как клатрин , COPI и COPII . По мере того, как все больше и больше этих покрывающих белков собираются вместе, они заставляют везикулу расширяться наружу и в конечном итоге вырваться на свободу в цитоплазму. Белки покрытия затем попадают в цитоплазму для переработки и повторного использования. [1]
Подвижность между клеточными компартментами
[ редактировать ]Для перемещения между различными отсеками внутри клетки везикулы полагаются на моторные белки миозин , кинезин (преимущественно антероградный транспорт) и динеин (преимущественно ретроградный транспорт). Один конец моторных белков прикрепляется к пузырьку, а другой конец прикрепляется либо к микротрубочкам , либо к микрофиламентам . Затем моторные белки перемещаются за счет гидролиза АТФ, что продвигает везикулу к месту назначения. [2]
Стыковка и слияние
[ редактировать ]Когда везикула приближается к намеченному месту, белки RAB в мембране везикулы взаимодействуют со стыковочными белками в месте назначения. Эти стыковочные белки приближают везикулу для взаимодействия с комплексом SNARE , обнаруженным в целевой мембране. Комплекс SNARE реагирует с синаптобревином , обнаруженным на мембране везикул. [3] Это прижимает мембрану везикулы к мембране целевого комплекса (или внешней мембране клетки) и вызывает слияние двух мембран. В зависимости от того, сливается ли везикула с целевым комплексом или с внешней мембраной, содержимое везикулы затем высвобождается либо в целевой комплекс, либо за пределы клетки. [4]
Примеры у эукариотов
[ редактировать ]- Внутриклеточный транспорт происходит между субклеточными компартментами, такими как цистерны Гольджи, и мультивезикулярными эндосомами для транспорта растворимых белков в виде МВ.
- Отпочкование МВ непосредственно из плазматической мембраны в виде микровезикул, высвобождаемых за пределы секреторных клеток .
- Экзосомы представляют собой МВ, которые могут образовываться внутри внутреннего компартмента, например, мультивезикулярной эндосомы. Экзосомы высвобождаются в конечном итоге за счет слияния этой эндосомы с плазматической мембраной клетки.
- Захват экзосомального механизма некоторыми вирусами, такими как ретровирусы , при котором вирусы отпочковываются внутри мультивезикулярных эндосом и впоследствии секретируются в виде экзосом.
Все эти типы (1–4) способов транспорта мембранных везикул, происходящие в эукариотических клетках, объяснены схематически. [5]
У прокариот
[ редактировать ]В отличие от эукариот , мембранный везикулярный транспорт у прокариот является новой областью интерактивной биологии для внутривидовой (чувство кворума) и межвидовой передачи сигналов на границе хозяин-патоген , поскольку у прокариот отсутствует внутренняя мембранная компартментализация их цитоплазмы . бактерий Дисперсию везикул внешней мембраны вдоль поверхности клеток измеряли у живых Escherichia coli , комменсальных бактерий, распространенных в кишечнике человека. Лечение антибиотиками изменяло динамику везикул, сродство везикул к мембранам и поверхностные свойства клеточных мембран, в целом усиливая транспорт везикул вдоль поверхности бактериальных мембран и предполагая, что их свойства движения могут быть признаком антибиотикового стресса. [6]
На протяжении более четырех десятилетий культуры грамотрицательных бактерий выявляли наличие наноразмерных мембранных везикул. Роль мембранных везикул в патогенных процессах подозревалась с 1970-х годов, когда они были обнаружены в десневых бляшках с помощью электронной микроскопии . [7] Предполагалось, что эти везикулы способствуют адгезии бактерий к поверхности эпителиальных клеток хозяина. [8] Затем была продемонстрирована их роль во инвазии в клетки животных-хозяев in vivo . [9] Показано , что при межбактериальном взаимодействии OMV, выделяемые Pseudomonas aeruginosa, сливаются с внешней мембраной других грамотрицательных бактерий, вызывая их бактериолиз; эти OMV также могут лизировать грамположительные бактерии. [10] Роль OMV в Helicobacter pylori инфицировании первичных эпителиальных клеток антрального отдела человека как модели, очень напоминающей желудок человека, также была подтверждена. [11] VacA-содержащие OMV также могут быть обнаружены в слизистой оболочке желудка человека, инфицированной H. pylori. . [12] было показано, что OMV сальмонеллы играют прямую роль во инвазии эпителиальных клеток подвздошной кишки кур in vivo В 1993 году (ссылка 4) и позже , в перехвате защитных макрофагов на вспомогательную службу для репликации патогена и последующем апоптозе инфицированных макрофагов при брюшном тифе. - как заражение животных. [13] Эти исследования привлекли внимание к OMV в торговле мембранными пузырьками и показали, что это явление участвует в разнообразных процессах, включая генетическую трансформацию , ощущение кворума , арсенал конкуренции среди микробов, а также инвазию, инфицирование , иммуномодуляцию животных-хозяев. [7] Уже был предложен механизм образования OMV грамотрицательными бактериями, включающий расширение карманов периплазмы (называемых периплазматическими органеллами ) за счет накопления секретов бактериальных клеток и их отщипывания в виде везикул, ограниченных внешней мембраной (OMV) на линиях образование «мыльного пузыря» с пузырьковой трубкой и дальнейшее слияние или поглощение диффундирующих OMV клетками-хозяевами/мишенями (рис. 2). [14]


В заключение, транспорт мембранных пузырьков через OMV грамотрицательных организмов затрагивает разные виды и царства, включая царство растений. [15] – в области передачи сигналов от ячейки к ячейке .
См. также
[ редактировать ]- Бактериальные везикулы наружной мембраны
- Эндоцитоз
- Экзоцитоз
- Взаимодействие хозяина и патогена
- Секреторный путь
- Везикула (биология и химия)
- Вирулентность
Ссылки
[ редактировать ]- ^ Бонифачино, Хуан (январь 2004 г.). «Механизмы почкования и слияния пузырьков» . Клетка . 116 (2): 153–166. дои : 10.1016/S0092-8674(03)01079-1 . PMID 14744428 .
- ^ Хенли Х., Стамнес М. (май 2007 г.). «Регуляция подвижности везикул на основе цитоскелета» . Письма ФЭБС . 581 (11): 2112–8. doi : 10.1016/j.febslet.2007.01.094 . ЧВК 1974873 . ПМИД 17335816 .
- ^ Нанавати С., Маркин В.С., Оберхаузер А.Ф., Фернандес Х.М. (октябрь 1992 г.). «Экзоцитотическая слитая пора, смоделированная как липидная пора» . Биофизический журнал . 63 (4): 1118–32. Бибкод : 1992BpJ....63.1118N . дои : 10.1016/S0006-3495(92)81679-X . ПМЦ 1262250 . ПМИД 1420930 .
- ^ Папахаджопулос Д., Нир С., Дюзгунес Н. (апрель 1990 г.). «Молекулярные механизмы кальций-индуцированного слияния мембран». Журнал биоэнергетики и биомембран . 22 (2): 157–79. дои : 10.1007/BF00762944 . ПМИД 2139437 . S2CID 1465571 .
- ^ Тери С., Островски М., Сегура Э. (август 2009 г.). «Мембранные везикулы как конвейеры иммунных ответов». Обзоры природы. Иммунология . 9 (8): 581–93. дои : 10.1038/nri2567 . ПМИД 19498381 . S2CID 21161202 .
- ^ Бос Дж., Сиснерос Л.Х., Мазел Д. (январь 2021 г.). «Отслеживание бактериальных мембранных везикул в режиме реального времени показывает усиление мембранного движения при воздействии антибиотиков» . Достижения науки . 7 (4): eabd1033. дои : 10.1126/sciadv.abd1033 . ПМЦ 7817102 . ПМИД 33523924 .
- ^ Jump up to: а б Эллис Т.Н., Куэн М.Дж. (март 2010 г.). «Вирулентность и иммуномодулирующая роль везикул внешней мембраны бактерий» . Обзоры микробиологии и молекулярной биологии . 74 (1): 81–94. дои : 10.1128/MMBR.00031-09 . ПМЦ 2832350 . ПМИД 20197500 .
- ^ Хэлхул Н., Колвин-младший (февраль 1975 г.). «Ультраструктура бактериального налета, прикрепленного к десне человека». Архивы оральной биологии . 20 (2): 115–8. дои : 10.1016/0003-9969(75)90164-8 . ПМИД 1054578 .
- ^ ЯшРой RC (1993). «Электронно-микроскопические исследования поверхностных пилей и везикул организмов Salmonella 3,10:r:-» . Индийский журнал наук о животных . 63 (2): 99–102.
- ^ Кадуругамува Дж. Л., Беверидж Т. Дж. (май 1996 г.). «Бактериолитическое действие мембранных везикул Pseudomonas aeruginosa на другие бактерии, включая патогены: концептуально новые антибиотики» . Журнал бактериологии . 178 (10): 2767–74. дои : 10.1128/jb.178.10.2767-2774.1996 . ПМК 178010 . ПМИД 8631663 .
- ^ Хечко У., Смит В.К., Марк Мелош Р., Бьюкен А.М., Финли Б.Б. (ноябрь 2000 г.). «Характеристики прикрепления Helicobacter pylori к первичным эпителиальным клеткам антрального отдела человека» . Микробы и инфекции . 2 (14): 1669–76. дои : 10.1016/s1286-4579(00)01322-8 . ПМИД 11137040 .
- ^ Фиокка Р., Некки В., Сомми П., Риччи В., Телфорд Дж., Кавер Т.Л., Сольсия Е. (июнь 1999 г.). «Высвобождение вакуолирующего цитотоксина Helicobacter pylori как посредством специфического пути секреции, так и путем отпочкования везикул внешней мембраны. Поглощение высвободившегося токсина и везикул эпителием желудка». Журнал патологии . 188 (2): 220–6. doi : 10.1002/(sici)1096-9896(199906)188:2<220::aid-path307>3.0.co;2-c . ПМИД 10398168 . S2CID 44528015 .
- ^ Яшрой РЦ (2000). «Захват макрофагов сальмонеллой (3,10:r:-) посредством экзоцитозной передачи сигналов, подобной секреции III типа: механизм заражения подвздошной кишки кур» . Индийский журнал птицеводства . 35 (3): 276–281.
- ^ ЯшРой РЦ (июнь 2003 г.). «Интоксикация эукариотических клеток грамотрицательными патогенами: новая модель бактериального нановезикулярного экзоцитоза, связанного с внешней мембраной, для системы секреции типа III». Международная токсикология . 10 (1): 1–9.
- ^ Бахар О, Прюитт Р, Луу Д.Д., Швессингер Б, Дауди А, Лю Ф, Руан Р, Фонтен-Бодин Л, Кёбник Р, Рональд П (2014). «Белок Xanthomonas Ax21 процессируется общей секреторной системой и секретируется вместе с везикулами наружной мембраны» . ПерДж . 2 : е242. дои : 10.7717/peerj.242 . ПМЦ 3897388 . ПМИД 24482761 .
Внешние ссылки
[ редактировать ]- Нобелевская премия 2013 года по физиологии и медицине – пресс-релиз http://www.nobelprize.org/nobel_prizes/medicine/laureates/2013/press.html
- Открытие везикулярного экзоцитоза у прокариот https://www.researchgate.net/publication/230793568_Discovery_of_vesicle_exocytosis_in_prokaryotes_and_its_role_in_Salmonella_invasion?ev=prf_pub