2,4,6-Тритер - Бутилфенол

| |
| Имена | |
|---|---|
| Предпочтительное имя IUPAC
2,4,6-Тритер - Бутилфенол | |
| Другие имена
2,4,6-TTBP
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Химический | |
| Chemspider | |
| Echa Infocard | 100.010.900 |
| ЕС номер |
|
PubChem CID
|
|
| НЕКОТОРЫЙ | |
Comptox Dashboard ( EPA )
|
|
| Характеристики | |
| C 18 H 30 O | |
| Молярная масса | 262.437 g·mol −1 |
| Опасности | |
| GHS Маркировка : | |
 
| |
| Предупреждение | |
| H302 , H315 , H319 , H410 | |
| P264 , p270 , p273 , p280 , p301+p312 , p302+p352 , p305+p351+p338 , p321 , p330 , p332+p313 , p337+p313 , p362 , p391 , p501 | |
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |
2,4,6-Три -Терт -Бутилфенол ( 2,4,6-ТТБП ) является феноловым симметрично замененным тремя трет -бутильными группами и, следовательно, сильно затруднен . 2,4,6-TTBP-это легко окисляемое ароматическое соединение и слабая кислота . Он окисляется, чтобы дать глубоководный 2,4,6-триточный радикал . [ 1 ] 2,4,6-TTBP связано с 2,6-димерным - бутилфенолом , который широко используется в качестве антиоксиданта в промышленных применениях. Эти соединения бесцветные твердые тела. [ 2 ]
Подготовка
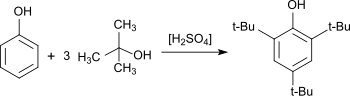
[ редактировать ]Подготовка 2,4,6-треть-тертон-бутилфенола тщательно изучалась. Еще в 1890 году Вильгельм Кенигс описал катализируемую кислотой реакцию фенола с изобутиленом . [ 3 ] Появилось много других отчетов. [ 4 ] Сообщалось о доходности до 90%. Типичные боковые продукты являются результатом неполного алкилирования: 4- ТЕРТ -Бутилфенол (4-ТБП), 2,4-диперт - бутилфенол (2,4-дтбп), 2,6- тератт -бутилфенол (2, 6-DTBP). 2,5- диперт- бутилфенол (2,5-дтб). Наблюдается [ 5 ] 2,4,6-Тридт - Бутилфенол также обнаружен в качестве побочного продукта в синтезе продуктов дискретиции 2,4-DTBP и 2,6-DTBP, которые более широко используются антиоксидантами. [ 2 ]
синтез 2,4,6-тритора - Был описан метиловый-бутиловый эфир бутилфенола, который также подходит в качестве учебного эксперимента. В качестве катализатора используется в качестве алкилирующего агента и серной кислоты. 2,4,6-ТТБП получается с выходом 69%. [ 6 ]
Характеристики
[ редактировать ]2,4,6-Тридт - Бутилфенол-это белое твердое вещество, которое растворяется во многих органических растворителях, но не в водных или алкогольных щелочных растворах. Зеленая голубая окраска хлоридом железа (III), которая характерна для фенолов, не встречается в 2,4,6-ТТБП. Соединение окисляется в воздухе, но практически не биоразлагаемым. [ 7 ]
В качестве богатого электроном ароматическим, 2,4,6-тридерт - бутилфенол также может быть легко окислен электрохимически. [ 8 ] В щеломе образующийся фенолярный анион сначала окисляется в обратимой реакции на фенокси -радикал. Стабильный радикал окисляется дальнейшим снятием электронов в катион феноксония, который реагирует в воде с получением 2,4,6-тритора - бутил-4-гидрокси-2,5-циклогексадиен.
В кислых средах гидроксидиенон решается с расщеплением трет-бутильной группы в 4-м положении в 2,6-диверт - бутилгидрохинон, который окисляется до конечного продукта 2,6-диперт -бутил -бутил- -1,4-бензохинон.
Окисление 2,4,6-триторт - бутилфенола в щелочном до интенсивного фенокси-радикала синего цвета также может происходить при калиевом феррицианиде . [ 1 ] [ 9 ] [ 6 ] 2,4,6 -Три -Терт -Бутилфеноксидикал образует синие кристаллы при охлаждении до -70 ° С, которые стабильны при комнатной температуре в течение нескольких недель и только постепенно становятся желтыми. [ 9 ] Фенокси радикал реагирует с кислородом как дирадикальный, образующий 4,4'-связанный перекись, образующий желтые кристаллы. [ 10 ]
Приложения
[ редактировать ]Богатый электронами 2,4,6-триторт - бутилфенол может быть легко окислен до фенокси-радикала, который в 4-позиции добавляет фенолы, [ 11 ] [ 12 ] а также спирты и тиолы [ 13 ] к соответствующим циклогексадиенонам. Циклогексадиеноны, также называемые в литературе как чинлетер , расщепляют 4-позиционную трет-бутильную группу при нагревании в кислых условиях и ароматизируют обратно к замещенному фенолу.
Реакция может быть использована для синтеза 2,6-диперт - бутил-4-метоксифенола, который часто используется в качестве антиоксиданта.
2,4,6-TTBP используется в качестве стабилизаторов , мастерских свободных радикалов и антиоксидантов в технических применениях, таких как в топливе , гидравлические жидкости и смазочные масла , а также в эластомерных и термопластичных полимерах. Из-за своего выраженного устойчивости , его высокая тенденция к биоаккумуляции и водной токсичности , 2,4,6-TTBP представляет собой лишь низкое промышленное использование и даже запрещено, например, в Японии .
Фенокси радикал 2,4,6 -TTBP также описывается как стерически требовательная защитная группа в реагенте для переноса нуклеофильной диметиламинометильной группы [(CH 3 ) 2 -N -CH 2 -] для образования третичных аминов . [ 14 ]
Регулирование
[ редактировать ]23 января 2024 года, исходя из того, что он токсичен для воспроизведения и постоянного, биоаккумулятивного и токсичного (PBT), 2,4,6-TTBP был добавлен в список кандидатов в ЕС оказания веществ очень высокой озабоченности ( SVHC ) для разрешения. [ 15 ]
Ссылки
[ редактировать ]- ^ Jump up to: а беременный Уоррен, JJ; Троник, Та; Mayer, JM (2010). «Термохимия реагентов переноса электронов, связанных с протоном, и его последствия» . Химические обзоры . 110 (12): 6961–7001. doi : 10.1021/cr100085k . PMC 3006073 . PMID 20925411 .
- ^ Jump up to: а беременный Питер П. Клемчук (2005). «Антиоксиданты». Энциклопедия промышленной химии Уллмана . Вейнхайм: Wiley-VCH. doi : 10.1002/14356007.a03_091 . ISBN 978-3527306732 .
- ^ «В этом случае, по -видимому, также есть прямое добавление ненасыщенного углеводорода к ароматическому веществу». W. Koenigs (1890), «о конденсациях ненасыщенных углеводородов с фенолами» , Chem. (на немецком языке), вып. нет , 23 .
- ^ Ар Хаджипур; Y. Ghayeb; Н. Шейхан; Ae Ruoho (2009), «Кислотная ионная жидкость Brønsted в качестве эффективного и многоразового катализатора для синтеза 1-амидоалкила 2-нафтолов в условиях без растворителя», Tetrahedron Lett. Vol. 50, нет. 40, с. 5649–5651, doi : 10.1016/j.tetlet.2009.07.116
- ^ GH Stillson; DW Sawyer; CK Hunt (1945), «Запранные фенолы», J. Am. Химический Соц Vol. 67, нет. 2, с. 303–307, doi : 10.1021/ja01218a045
- ^ Jump up to: а беременный BG Somers; CD Cook (1955), «Приготовление 2,4,6-тритора - бутилфенол», J. Chem. Образовательный Vol. 32, нет. 6, с. 312, doi : 10.1021/ed032p312
- ^ «Оценка скрининга для вызова, фенол, 2,4,6-трис (1,1-диметилэтил)-(2,4,6-три-трет-бутилфенол), реестр CAS № 732-26-3» (PDF) Полем Окружающая среда Канада, здравоохранение Канада. Ноябрь 2008 . Получено 2017-01-11 .
- ^ Ja Richards; PE Whitson; DH Evans (1975), «Электрохимическое окисление 2,4,6-трет- бутилфенол », J. Electroanal. Химический (на немецком языке), вып. 63, нет. 3, с. 311–327, doi : 10.1016/s0022-0728 (75) 80303-2
- ^ Jump up to: а беременный CD Cook; Да Кун; P. Fianu (1956), «Окисление затрудненных фенолов. IV. Стабильные фенокси радикалы», J. Am. Химический Соц Vol. 78, нет. 9, с. 2002–2005, doi : 10.1021/ja01590a067
- ^ CD Cook; RC Woodworth (1953), «Окисление затрудненных фенолов. II . Химический Соц Vol. 75, нет. 24, с. 6242–6244, doi : 10.1021/ja01120a040
- ^ США 3410878 , H.-D. Беккер, «Подготовка эфиров хинола», выпущено 1968-11-12
- ^ Э. Мюллер; К. Лей; G. Schlechte (1957), «О кислородных радикалах, VIII. О дегидратации фенолов», Chem. (на немецком языке), вып. нет , . 90
- ^ US 3895069 , JH Atkinson, D. Clark, «Процесс приготовления 2,4,6 Trialkyl-4-алкилтио или 4-алкоксициклогексади-2,5-ene-1-Ones», выпущен 1975-7-15
- ^ D. Seebach; Т. Хассель (1978), «2.4,6-триерт -бутилфенокси (TBPO) в качестве стерической эффективности карбонильной защиты группы-новое нуклеофильное диметиламинометилирование» . . Хим нет 90 ,
- ^ «Список кандидатов веществ очень высокой заботы о разрешении - Echa» . echa.europa.eu . Получено 2024-01-24 .