Микропептид
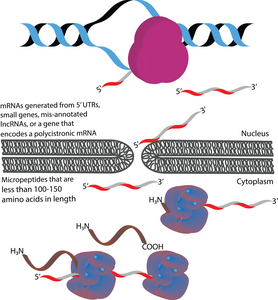
Микропептиды (также называемые микропротеинами) представляют собой полипептиды длиной менее 100-150 аминокислот , кодируемые короткими открытыми рамками считывания (кОРС). [ 1 ] [ 2 ] [ 3 ] В этом отношении они отличаются от многих других активных малых полипептидов, которые образуются путем посттрансляционного расщепления более крупных полипептидов. [ 1 ] [ 4 ] По размеру микропептиды значительно короче «канонических» белков, средняя длина которых у прокариот и эукариот составляет 330 и 449 аминокислот соответственно. [ 5 ] Микропептиды иногда называют в соответствии с их геномным расположением. Например, транслируемый продукт вышестоящей открытой рамки считывания (uORF) можно назвать пептидом, кодируемым uORF (uPEP). [ 6 ] У микропептидов отсутствуют N-концевые сигнальные последовательности, что позволяет предположить, что они, вероятно, локализуются в цитоплазме . [ 1 ] Однако некоторые микропептиды были обнаружены и в других клеточных компартментах, о чем свидетельствует существование трансмембранных микропептидов. [ 7 ] [ 8 ] Они встречаются как у прокариот, так и у эукариот. [ 1 ] [ 9 ] [ 10 ] КОРС, с которых транслируются микропептиды, могут кодироваться 5'-НТО , небольшими генами или полицистронными мРНК . Некоторые гены, кодирующие микропептиды, изначально были ошибочно обозначены как длинные некодирующие РНК (днРНК). [ 11 ]
Первоначально на sORF не обращали внимания из-за их небольшого размера. Однако с помощью различных методов у множества организмов были идентифицированы сотни тысяч предполагаемых микропептидов. Лишь небольшая часть из них с потенциалом кодирования подтвердила свою экспрессию и функцию. Те, которые были функционально охарактеризованы, в целом играют роль в передаче сигналов в клетках , органогенезе и клеточной физиологии . Чем больше микропептидов обнаружено, тем больше их функций. Одной из регуляторных функций является функция пептопереключателей, которые ингибируют экспрессию нижестоящих кодирующих последовательностей путем остановки рибосом путем их прямой или непрямой активации небольшими молекулами. [ 11 ]
Идентификация
[ редактировать ]Существуют различные экспериментальные методы для идентификации потенциальных ORF и продуктов их трансляции. Эти методы полезны только для идентификации кОРС, которые могут продуцировать микропептиды, а не для прямой функциональной характеристики.
секвенирование РНК
[ редактировать ]Одним из методов поиска потенциальных кОРС и, следовательно, микропептидов, является секвенирование РНК ( RNA-Seq ). RNA-Seq использует секвенирование нового поколения (NGS) для определения того, какие РНК экспрессируются в данной клетке, ткани или организме в определенный момент времени. Этот набор данных, известный как транскриптом , может затем использоваться в качестве ресурса для поиска потенциальных кОРС. [ 1 ] Из-за высокой вероятности случайного возникновения кОРС размером менее 100 а.к. необходимы дальнейшие исследования для определения достоверности данных, полученных с использованием этого метода. [ 11 ]
Профилирование рибосом (Ribo-Seq)
[ редактировать ]Профилирование рибосом использовалось для идентификации потенциальных микропептидов у растущего числа организмов, включая плодовых мух, рыбок данио, мышей и людей. [ 11 ] В одном методе используются такие соединения, как харрингтонин, пуромицин или лактимидомицин, для остановки рибосом в местах инициации трансляции. [ 12 ] Это указывает на то, где происходит активная трансляция. Ингибиторы элонгации трансляции, такие как эметин или циклогексимид, также можно использовать для получения следов рибосом, которые с большей вероятностью приведут к транслируемой ORF. [ 13 ] Если рибосома связана с кОРС или рядом с ней, она предположительно кодирует микропептид. [ 1 ] [ 2 ] [ 14 ]
Масс-спектрометрия
[ редактировать ]Масс-спектрометрия (МС) является золотым стандартом идентификации и секвенирования белков. Используя этот метод, исследователи могут определить, действительно ли полипептиды транслируются из кОРС.
Протеогеномные приложения
[ редактировать ]Протеогеномика объединяет протеомику, геномику и трансциптомику. Это важно при поиске потенциальных микропептидов. Один из методов использования протеогеномики предполагает использование данных RNA-Seq для создания собственной базы данных всех возможных полипептидов. Жидкостную хроматографию с последующей тандемной МС (ЖХ-МС/МС) проводят для получения информации о последовательности продуктов трансляции. Сравнение данных транскриптомики и протеомики можно использовать для подтверждения присутствия микропептидов. [ 1 ] [ 2 ]
Филогенетическая консервация
[ редактировать ]Филогенетическая консервация может быть полезным инструментом, особенно при анализе большой базы данных кОРС. Вероятность того, что кОРС приведет к образованию функционального микропептида, более вероятна, если он консервативен у многих видов. [ 11 ] [ 12 ] Однако это будет работать не для всех SORF. Например, те из них, которые кодируются днРНК, с меньшей вероятностью будут консервативными, поскольку сами днРНК не обладают высокой консервативностью последовательности. [ 2 ] Дальнейшие эксперименты будут необходимы, чтобы определить, действительно ли производится функциональный микропептид.
Проверка потенциала кодирования белка
[ редактировать ]Антитела
[ редактировать ]Изготовленные на заказ антитела, нацеленные на интересующий микропептид, могут быть полезны для количественной оценки экспрессии или определения внутриклеточной локализации. Как и в случае с большинством белков, низкая экспрессия может затруднить обнаружение. Небольшой размер микропептида также может привести к трудностям при разработке эпитопа, на который будет нацелено антитело. [ 2 ]
Маркировка с помощью CRISPR-Cas9
[ редактировать ]Редактирование генома можно использовать для добавления FLAG/MYC или других небольших пептидных меток к эндогенной кОРС, создавая таким образом слитые белки. В большинстве случаев этот метод выгоден тем, что его можно выполнить быстрее, чем разработку индивидуального антитела. Это также полезно для микропептидов, для которых не может быть нацелен ни один эпитоп. [ 2 ]
перевод in vitro
[ редактировать ]Этот процесс включает клонирование полноразмерной кДНК микропептида в плазмиду, содержащую промотор T7 или SP6. В этом методе используется бесклеточная система синтеза белка в присутствии 35 S-метионин для получения интересующего пептида. Затем продукты можно проанализировать с помощью гель-электрофореза и 35 S-меченный пептид визуализируют с помощью авторадиографии. [ 2 ]
Базы данных и репозитории
[ редактировать ]Существует несколько репозиториев и баз данных, созданных как для кОРС, так и для микропептидов. Репозиторий небольших ORF, обнаруженных с помощью профилирования рибосом, можно найти на сайте sORFs.org. [ 15 ] [ 16 ] Репозиторий предполагаемых пептидов, кодируемых sORF, у Arabidopsis thaliana можно найти на сайте ARA-PEP. [ 17 ] [ 18 ] Базу данных малых белков, особенно кодируемых некодирующими РНК, можно найти на SmProt. [ 19 ] [ 20 ]
Прокариотические примеры
[ редактировать ]На сегодняшний день большинство микропептидов идентифицировано в прокариотических организмах. Хотя большинство из них еще полностью не охарактеризовано, многие из изученных организмов, по-видимому, имеют решающее значение для выживания этих организмов. Из-за своего небольшого размера прокариоты особенно восприимчивы к изменениям окружающей среды и поэтому разработали методы обеспечения своего существования.
Эшерихия коли (E.coli)
[ редактировать ]Микропептиды, экспрессируемые в E. coli, служат примером адаптации бактерий к окружающей среде. Большинство из них были разделены на три группы: лидерные пептиды, рибосомальные белки и токсичные белки. Белки-лидеры регулируют транскрипцию и/или трансляцию белков, участвующих в метаболизме аминокислот, когда аминокислот недостаточно. Рибосомальные белки включают L36 ( rpmJ ) и L34 ( rpmH ), два компонента рибосомальной субъединицы 50S. Токсичные белки, такие как ldrD , токсичны в высоких концентрациях и могут убивать клетки или ингибировать рост, что снижает жизнеспособность клетки-хозяина. [ 21 ]
Сальмонелла энтерика (S. enterica)
[ редактировать ]У S. enterica фактор вирулентности MgtC участвует в адаптации к среде с низким содержанием магния. Гидрофобный пептид MgrR связывается с MgtC, вызывая его деградацию протеазой FtsH. [ 9 ]
Бацилла субтилис (B. subtilis)
[ редактировать ]Микропептид Sda из 46 ак., экспрессируемый B. subtilis , подавляет споруляцию при нарушении инициации репликации. Ингибируя гистидинкиназу KinA, Sda предотвращает активацию транскрипционного фактора Spo0A, который необходим для споруляции. [ 10 ]
Золотистый стафилококк (S. aureus)
[ редактировать ]У S. aureus существует группа микропептидов, состоящая из 20-22 аминокислот, которые выделяются во время инфекции хозяина, разрушая мембраны нейтрофилов, вызывая лизис клеток. Эти микропептиды позволяют бактериям избежать деградации под действием основных защитных сил иммунной системы человека. [ 22 ] [ 23 ]
Эукариотические примеры
[ редактировать ]Микропептиды были обнаружены в эукариотических организмах от Arabidopsis thaliana до человека. Они играют разнообразную роль в развитии тканей и органов, а также в поддержании и функционировании после полного развития. Хотя многие из них еще функционально не охарактеризованы и, вероятно, еще предстоит открыть, ниже приводится краткое изложение недавно выявленных функций эукариотических микропептидов.
Arabidopsis thaliana ( A. thaliana )
[ редактировать ]Ген POLARIS (PLS) кодирует микропептид из 36 аминокислот. Это необходимо для правильного формирования сосудистого рисунка листьев и расширения клеток в корне. Этот микропептид взаимодействует с белками PIN развития, образуя критическую сеть для гормональных перекрестных помех между ауксином, этиленом и цитокинином. [ 24 ] [ 25 ] [ 26 ]
ROTUNDIFOLIA (ROT4 ) у A. thaliana кодирует пептид из 53 аминокислот, который локализуется на плазматической мембране клеток листа. Механизм функции ROT4 не совсем понятен, но мутанты имеют короткие округлые листья, что указывает на то, что этот пептид может быть важен в морфогенезе листьев. [ 27 ]
Зеа Мэйс ( Z. mays )
[ редактировать ]Brick1 (Brk1) кодирует микропептид из 76 аминокислот, который высоко консервативен как у растений, так и у животных. Было обнаружено , что у Z. mays он участвует в морфогенезе эпителия листьев, способствуя множественным актин-зависимым событиям поляризации клеток в развивающемся эпидермисе листа. [ 28 ] Zm401p10 представляет собой микропептид, состоящий из 89 аминокислот, который играет роль в нормальном развитии пыльцы в тапетуме. После митоза он также важен для деградации тапетума. [ 29 ] Zm908p11 представляет собой микропептид длиной 97 аминокислот, кодируемый геном Zm908 , который экспрессируется в зрелых пыльцевых зернах. Он локализуется в цитоплазме пыльцевых трубок, где способствует их росту и развитию. [ 30 ]
Дрозофила меланогастер ( D. melanogaster )
[ редактировать ]Эволюционно консервативный ген полированного риса ( pri ), известный как tarsal-less (tal) у D. melanogaster , участвует в эпидермальной дифференцировке. Этот полицистронный транскрипт кодирует четыре сходных пептида, длина которых варьируется от 11 до 32 аминокислот. Они действуют, усекая транскрипционный фактор Shavenbaby (Svb). Это превращает Svb в активатор, который непосредственно регулирует экспрессию целевых эффекторов, включая миниатюрный (m) и шавеноид (sha) , которые вместе ответственны за образование трихом. [ 31 ]
Данио рерио ( D. rerio )
[ редактировать ]Ген Элабела ( Ela) (он же Apela, Toddler) важен для эмбриогенеза. [ 32 ] Он особенно экспрессируется на стадиях поздней бластулы и гаструлы. Во время гаструляции это имеет решающее значение для содействия интернализации и направленному на анимальный полюс движению мезоэнтодермальных клеток . После гаструляции Ela экспрессируется в латеральной мезодерме, энтодерме, а также в передней и задней хорде. Хотя она была аннотирована как днРНК у рыбок данио, мышей и человека, ORF из 58 аминокислот оказалась высококонсервативной среди видов позвоночных. Ela процессируется путем удаления ее сигнального пептида на N-конце , а затем секретируется во внеклеточное пространство . Его зрелый пептид, состоящий из 34 аминокислот, служит первым эндогенным лигандом GPCR , известного как апелиновый рецептор . [ 33 ] [ 32 ] Генетическая инактивация Ela или Aplnr у рыбок данио приводит к бессердечным фенотипам. [ 34 ] [ 35 ]
Mus musculus ( М. musculus )
[ редактировать ]Миорегулин (Mln) кодируется геном, первоначально обозначенным как lncRNA. Mln экспрессируется во всех трех типах скелетных мышц и действует аналогично микропептидам фосфоламбану (Pln) в сердечной мышце и сарколипину (Sln) в медленных (тип I) скелетных мышцах. Эти микропептиды взаимодействуют с саркоплазматическим ретикулумом Ca. 2+ -АТФаза (SERCA), мембранный насос, ответственный за регуляцию кальция. 2+ попадание в саркоплазматический ретикулум (СР). Ингибируя Са 2+ попадая в СР, они вызывают мышечную релаксацию. Аналогично, гены эндорегулина (ELN) и другого регулина (ALN) кодируют трансмембранные микропептиды, которые содержат мотив связывания SERCA и консервативны у млекопитающих. [ 7 ]
Миомиксер (Mymx) кодируется геном Gm7325, специфичным для мышц пептидом длиной 84 ак, который играет роль во время эмбриогенеза в слиянии и формировании скелетных мышц. Он локализуется на плазматической мембране, связываясь с фузогенным мембранным белком Myomaker (Mymk). У людей ген, кодирующий Mymx, обозначается как неохарактеризованный LOC101929726 . Ортологи встречаются также в геномах черепах, лягушек и рыб. [ 8 ]
Человек разумный ( H. sapiens )
[ редактировать ]У людей NoBody (неаннотированный полипептид, диссоциирующий P-тельца), микропептид из 68 аминокислот, был обнаружен в длинной промежуточной некодирующей РНК (lincRNA) LINC01420 . Он имеет высокую консервативность последовательности среди млекопитающих и локализуется в P-тельцах . Он обогащает белки, связанные с декапированием 5'-мРНК . Считается, что он напрямую взаимодействует с энхансером декаппирования мРНК 4 (EDC4). [ 36 ]
ЭЛАБЕЛА ( ELA) (также известная как АПЕЛА) представляет собой эндогенный гормон , который секретируется в виде микропептида из 32 аминокислот эмбриональными стволовыми клетками человека . [ 32 ] Крайне важно поддерживать самообновление и плюрипотентность человека эмбриональных стволовых клеток . Его сигналы аутокринным образом проходят через путь PI3/AKT через пока еще неидентифицированный рецептор клеточной поверхности . [ 37 ] При дифференцировке мезоэндермальных клеток ELA связывается и передает сигналы через APLNR , GPCR , который также может реагировать на гормональный пептид APLN .
Предполагается, что ген CYREN , консервативный у млекопитающих, при альтернативном сплайсинге будет производить три микропептида. Ранее было обнаружено, что МРТ-1 является модулятором ретровирусной инфекции. Второй предсказанный микропептид, MRI-2, может играть важную роль в процессе негомологического соединения концов (NHEJ) двухцепочечных разрывов ДНК. В экспериментах по коиммунопреципитации MRI-2 связывался с Ku70 и Ku80 , двумя субъединицами Ku , которые играют важную роль в пути NHEJ. [ 38 ]
Микропептид из 24 аминокислот, гуманин (HN), взаимодействует с индуцирующим апоптоз белком Bcl2, ассоциированным с белком X (Bax). В активном состоянии Bax претерпевает конформационные изменения, которые обнажают мембраноориентированные домены. Это заставляет его перемещаться из цитозоля на митохондриальную мембрану, где он встраивает и высвобождает апоптогенные белки, такие как цитохром с. Взаимодействуя с Bax, HN предотвращает нацеливание Bax на митохондрии, тем самым блокируя апоптоз. [ 39 ]
Было обнаружено, что микропептид из 90 аминокислот, « малый регуляторный полипептид аминокислотного ответа » или SPAAR, кодируется в lncRNA LINC00961 . Он консервативен у человека и мыши и локализуется в поздней эндосоме/лизосоме. SPAAR взаимодействует с четырьмя субъединицами комплекса v-АТФазы , ингибируя транслокацию mTORC1 на поверхность лизосом, где он активируется. Снижение уровня этого микропептида позволяет активировать mTORC1 за счет стимуляции аминокислот, способствуя регенерации мышц. [ 40 ]
Ссылки
[ редактировать ]![]() Эта статья была адаптирована из следующего источника под лицензией CC BY 4.0 ( 2018 ) ( отчеты рецензента ):
Мария Э. Соуза; Майкл Х. Фаркас (13 декабря 2018 г.). «Микропептид» . ПЛОС Генетика . 14 (12): e1007764. doi : 10.1371/JOURNAL.PGEN.1007764 . ISSN 1553-7390 . ПМК 6292567 . ПМИД 30543625 . Викиданные Q60017699 .
Эта статья была адаптирована из следующего источника под лицензией CC BY 4.0 ( 2018 ) ( отчеты рецензента ):
Мария Э. Соуза; Майкл Х. Фаркас (13 декабря 2018 г.). «Микропептид» . ПЛОС Генетика . 14 (12): e1007764. doi : 10.1371/JOURNAL.PGEN.1007764 . ISSN 1553-7390 . ПМК 6292567 . ПМИД 30543625 . Викиданные Q60017699 .
- ^ Jump up to: а б с д и ж г Краппе Дж., Ван Крикинг В., Меншерт Дж. (2014). «Из мелочей происходят большие дела: краткое изложение генов, кодирующих микропептиды» . Открытая протеомика EuPA . 3 : 128–137. дои : 10.1016/j.euprot.2014.02.006 . hdl : 1854/LU-4374851 .
- ^ Jump up to: а б с д и ж г Макаревич К.А., Олсон Э.Н. (сентябрь 2017 г.). «Добыча микропептидов» . Тенденции в клеточной биологии . 27 (9): 685–696. дои : 10.1016/j.tcb.2017.04.006 . ПМЦ 5565689 . ПМИД 28528987 .
- ^ Гильен Г., Диас-Камино С., Лойола-Торрес К.А., Апарисио-Фабр Р., Эрнандес-Лопес А., Диас-Санчес М., Санчес Ф. (2013). «Детальный анализ предполагаемых генов, кодирующих малые белки в геномах бобовых» . Границы в науке о растениях . 4 : 208. doi : 10.3389/fpls.2013.00208 . ПМЦ 3687714 . ПМИД 23802007 .
- ^ Хасимото Ю., Кондо Т., Кагеяма Ю. (июнь 2008 г.). «Лилипуты оказались в центре внимания: новый класс малых пептидных генов в морфогенезе» . Развитие, рост и дифференциация . 50 (Приложение 1): S269–76. дои : 10.1111/j.1440-169x.2008.00994.x . ПМИД 18459982 .
- ^ Чжан Дж (март 2000 г.). «Распределение белков по длине для трех областей жизни». Тенденции в генетике . 16 (3): 107–9. дои : 10.1016/s0168-9525(99)01922-8 . ПМИД 10689349 .
- ^ Ротнагель Дж., Меншерт Г. (май 2018 г.). «Короткие открытые рамки считывания и их кодированные пептиды» . Протеомика . 18 (10): e1700035. дои : 10.1002/pmic.201700035 . ПМИД 29691985 .
- ^ Jump up to: а б Андерсон Д.М., Андерсон К.М., Чанг К.Л., Макаревич К.А., Нельсон Б.Р., Макэналли Дж.Р., Касарагод П., Шелтон Дж.М., Лиу Дж., Бассель-Дюби Р., Олсон Э.Н. (февраль 2015 г.). «Микропептид, кодируемый предполагаемой длинной некодирующей РНК, регулирует работу мышц» . Клетка . 160 (4): 595–606. дои : 10.1016/j.cell.2015.01.009 . ПМЦ 4356254 . ПМИД 25640239 .
- ^ Jump up to: а б Би П., Рамирес-Мартинес А., Ли Х., Каннавино Дж., Макэналли-младший, Шелтон Дж.М., Санчес-Ортис Э., Бассель-Дюби Р., Олсон Э.Н. (апрель 2017 г.). «Контроль мышечного формирования с помощью фузогенного микропептидного миомиксера» . Наука . 356 (6335): 323–327. Бибкод : 2017Sci...356..323B . дои : 10.1126/science.aam9361 . ПМК 5502127 . ПМИД 28386024 .
- ^ Jump up to: а б Аликс Э., Blanc-Potard AB (февраль 2008 г.). «Пептидная деградация фактора вирулентности Salmonella MgtC» . Журнал ЭМБО . 27 (3): 546–57. дои : 10.1038/sj.emboj.7601983 . ПМК 2241655 . ПМИД 18200043 .
- ^ Jump up to: а б Буркхолдер В.Ф., Курцер И., Гроссман А.Д. (январь 2001 г.). «Белки инициации репликации регулируют контрольную точку развития Bacillus subtilis». Клетка . 104 (2): 269–79. дои : 10.1016/s0092-8674(01)00211-2 . hdl : 1721.1/83916 . ПМИД 11207367 . S2CID 15048130 .
- ^ Jump up to: а б с д и Эндрюс С.Дж., Ротнагель Дж.А. (март 2014 г.). «Появляющиеся доказательства существования функциональных пептидов, кодируемых короткими открытыми рамками считывания». Обзоры природы. Генетика . 15 (3): 193–204. дои : 10.1038/nrg3520 . ПМИД 24514441 . S2CID 22543778 .
- ^ Jump up to: а б Баззини А.А., Джонстон Т.Г., Кристиано Р., Маковяк С.Д., Обермайер Б., Флеминг Э.С., Вейнар К.Э., Ли М.Т., Раевски Н., Вальтер Т.К., Хиральдез А.Дж. (май 2014 г.). «Идентификация малых ORF у позвоночных с использованием рибосомного следа и эволюционной консервации» . Журнал ЭМБО . 33 (9): 981–93. дои : 10.1002/embj.201488411 . ПМК 4193932 . ПМИД 24705786 .
- ^ Инголия НТ, Брар Г.А., Стерн-Гиноссар Н., Харрис М.С., Талхуарн Г.Дж., Джексон С.Е., Уиллс М.Р., Вайсман Дж.С. (сентябрь 2014 г.). «Профилирование рибосом выявляет всеобъемлющую трансляцию за пределами аннотированных генов, кодирующих белок» . Отчеты по ячейкам . 8 (5): 1365–79. дои : 10.1016/j.celrep.2014.07.045 . ПМК 4216110 . ПМИД 25159147 .
- ^ Штерн-Гиноссар Н., Инголия, Северная Каролина (ноябрь 2015 г.). «Профилирование рибосом как инструмент для расшифровки вирусной сложности» . Ежегодный обзор вирусологии . 2 (1): 335–49. doi : 10.1146/annurev-virology-100114-054854 . ПМИД 26958919 .
- ^ «sORFs.org: хранилище небольших ORF, идентифицированных с помощью профилирования рибосом» . sorfs.org . Проверено 14 декабря 2018 г.
- ^ Олексюк В., Краппе Дж., Вербрюгген С., Верхеген К., Мартенс Л., Меншерт Г. (январь 2016 г.). «sORFs.org: хранилище небольших ORF, идентифицированных с помощью профилирования рибосом» . Исследования нуклеиновых кислот . 44 (Д1): Д324–9. дои : 10.1093/nar/gkv1175 . ПМЦ 4702841 . ПМИД 26527729 .
- ^ «ARA-PEP: хранилище предполагаемых пептидов, кодируемых sORF, у Arabidopsis thaliana » . www.biw.kuleuven.be . Проверено 14 декабря 2018 г.
- ^ Хазарика Р.Р., Де Конинк Б., Ямамото ЛР, Мартин ЛР, Камму Б.П., ван Ноорт В. (январь 2017 г.). «ARA-PEP: хранилище предполагаемых пептидов, кодируемых кОРС, у Arabidopsis thaliana» . БМК Биоинформатика . 18 (1): 37. дои : 10.1186/s12859-016-1458-y . ПМК 5240266 . ПМИД 28095775 .
- ^ «SmProt: база данных небольших белков, кодируемых аннотированными кодирующими и некодирующими локусами РНК» . bioinfo.ibp.ac.cn . Проверено 14 декабря 2018 г.
- ^ Хао Ю, Чжан Л, Ню Ю, Цай Т, Луо Дж, Хэ С, Чжан Б, Чжан Д, Цинь Ю, Ян Ф, Чен Р (июль 2018 г.). «SmProt: база данных небольших белков, кодируемых аннотированными кодирующими и некодирующими локусами РНК». Брифинги по биоинформатике . 19 (4): 636–643. дои : 10.1093/нагрудник/bbx005 . ПМИД 28137767 .
- ^ Хемм М.Р., Пол Б.Дж., Шнайдер Т.Д., Шторц Г., Радд К.Е. (декабрь 2008 г.). «Малые мембранные белки, обнаруженные с помощью сравнительной геномики и моделей сайтов связывания рибосом» . Молекулярная микробиология . 70 (6): 1487–501. дои : 10.1111/j.1365-2958.2008.06495.x . ПМК 2614699 . ПМИД 19121005 .
- ^ Ван Р., Бротон К.Р., Кречмер Д., Бах Т.Х., Квик С.Ю., Ли М., Кеннеди А.Д., Дорвард Д.В., Клебанофф С.Дж., Пешель А., ДеЛео Ф.Р., Отто М. (декабрь 2007 г.). «Идентификация новых цитолитических пептидов как ключевых детерминант вирулентности для местного MRSA». Природная медицина . 13 (12): 1510–4. дои : 10.1038/nm1656 . ПМИД 17994102 . S2CID 8465052 .
- ^ Хемм М.Р., Пол Б.Дж., Миранда-Риос Дж., Чжан А., Солтанзад Н., Сторц Г. (январь 2010 г.). «Малые белки реакции на стресс в Escherichia coli: белки, пропущенные классическими протеомными исследованиями» . Журнал бактериологии . 192 (1): 46–58. дои : 10.1128/jb.00872-09 . ПМЦ 2798279 . ПМИД 19734316 .
- ^ Кассон С.А., Чилли П.М., Топпинг Дж.Ф., Эванс И.М., Саутер М.А., Линдси К. (август 2002 г.). «Ген POLARIS арабидопсиса кодирует предполагаемый пептид, необходимый для правильного роста корней и формирования сосудистого рисунка листьев» . Растительная клетка . 14 (8): 1705–21. дои : 10.1105/tpc.002618 . ПМК 151460 . ПМИД 12172017 .
- ^ Чилли П.М., Кассон С.А., Тарковски П., Хокинс Н., Ван К.Л., Хасси П.Дж., Бил М., Экер Дж.Р., Сэндберг Г.К., Линдси К. (ноябрь 2006 г.). «Пептид POLARIS Arabidopsis регулирует транспорт ауксина и рост корней посредством воздействия на передачу сигналов этилена» . Растительная клетка . 18 (11): 3058–72. дои : 10.1105/tpc.106.040790 . ПМК 1693943 . PMID 17138700 .
- ^ Лю Дж., Мехди С., Топпинг Дж., Фримл Дж., Линдси К. (2013). «Взаимодействие PLS и PIN и гормональные перекрестные помехи в развитии корня арабидопсиса» . Границы в науке о растениях . 4 : 75. дои : 10.3389/fpls.2013.00075 . ПМК 3617403 . ПМИД 23577016 .
- ^ Нарита Н.Н., Мур С., Хоригучи Г., Кубо М., Демура Т., Фукуда Х., Гудрич Дж., Цукайя Х. (май 2004 г.). «Сверхэкспрессия нового небольшого пептида ROTUNDIFOLIA4 уменьшает пролиферацию клеток и изменяет форму листьев Arabidopsis thaliana». Заводской журнал . 38 (4): 699–713. дои : 10.1111/j.1365-313x.2004.02078.x . ПМИД 15125775 .
- ^ Фрэнк М.Дж., Смит Л.Г. (май 2002 г.). «Небольшой новый белок, высококонсервативный в растениях и животных, способствует поляризованному росту и делению эпидермальных клеток листьев кукурузы» . Современная биология . 12 (10): 849–53. Бибкод : 2002CBio...12..849F . дои : 10.1016/s0960-9822(02)00819-9 . ПМИД 12015123 . S2CID 14725039 .
- ^ Ван Д., Ли С., Чжао Q, Чжао Л., Ван М., Чжу Д., Ао Г., Ю Дж. (2009). «Zm401p10, кодируемый специфичным для пыльников геном с короткими открытыми рамками считывания, необходим для дегенерации тапетума и развития пыльников у кукурузы». Функциональная биология растений . 36 (1): 73–85. дои : 10.1071/fp08154 . ПМИД 32688629 .
- ^ Донг X, Ван Д, Лю П, Ли С, Чжао Q, Чжу Д, Юй Дж (май 2013 г.). «Zm908p11, кодируемый геном короткой открытой рамки считывания (sORF), действует при росте пыльцевых трубок как лиганд профилина у кукурузы» . Журнал экспериментальной ботаники . 64 (8): 2359–72. дои : 10.1093/jxb/ert093 . ПМЦ 3654424 . ПМИД 23676884 .
- ^ Кондо Т., Плаза С., Занет Дж., Бенраба Э., Валенти П., Хасимото Ю., Кобаяши С., Пайре Ф., Кагеяма Ю. (июль 2010 г.). «Маленькие пептиды переключают транскрипционную активность Shavenbaby во время эмбриогенеза дрозофилы». Наука . 329 (5989): 336–9. Бибкод : 2010Sci...329..336K . дои : 10.1126/science.1188158 . ПМИД 20647469 . S2CID 2927777 .
- ^ Jump up to: а б с Чнг СК, Хо Л, Тянь Дж, Реверсейд Б (декабрь 2013 г.). «ЭЛАБЕЛА: гормон, необходимый для сигналов развития сердца через апелиновый рецептор» . Развивающая клетка . 27 (6): 672–80. дои : 10.1016/j.devcel.2013.11.002 . ПМИД 24316148 .
- ^ Паули А., Норрис М.Л., Вален Э., Чу Г.Л., Ганьон Дж.А., Циммерман С., Митчелл А., Ма Дж., Дубрулль Дж., Рейон Д., Цай С.К., Йонг Дж.К., Сагателян А., Шир А.Ф. (февраль 2014 г.). «Малыш: эмбриональный сигнал, который способствует движению клеток через рецепторы апелина» . Наука . 343 (6172): 1248636. doi : 10.1126/science.1248636 . ПМК 4107353 . ПМИД 24407481 .
- ^ Дешвар, Ашиш Р.; Чнг, Серен С; Эй, Лена; Реверсейд, Бруно; Скотт, Ян С. (14 апреля 2016 г.). Робертсон, Элизабет (ред.). «Апелиновый рецептор усиливает передачу сигналов Nodal/TGFβ, обеспечивая правильное развитие сердца» . электронная жизнь . 5 : е13758. дои : 10.7554/eLife.13758 . ISSN 2050-084X . ПМЦ 4859801 . ПМИД 27077952 .
- ^ Скотт, Ян С.; Масри, Бернард; Д'Амико, Леонард А.; Джин, Сук-Вон; Юнгблут, Бенно; Веман, Энн М.; Байер, Хервиг; Одижье, Ив; Стейнье, Дидье Ю.Р. (март 2007 г.). «Рецептор agtrl1b, связанный с g-белком, регулирует раннее развитие предшественников миокарда» . Развивающая клетка . 12 (3): 403–413. дои : 10.1016/j.devcel.2007.01.012 . ISSN 1534-5807 . ПМИД 17336906 .
- ^ Д'Лима Н.Г., Ма Дж., Винклер Л., Чу К., Лох К.Х., Корпус Э.О., Будник Б.А., Люкке-Андерсен Дж., Сагателян А., Славофф С.А. (февраль 2017 г.). «Человеческий микропротеин, который взаимодействует с декапирующим комплексом мРНК» . Химическая биология природы . 13 (2): 174–180. дои : 10.1038/следующий.2249 . ПМК 5247292 . ПМИД 27918561 .
- ^ Ты, Лена; Тан, Шон YX; Ви, Шина; У, Исюань; Тан, Сэм Джей Си; Рамакришна, Навин Б.; Чнг, Серен К.; Имя Шрикантх; Щербинска, Ивона; Щербинска, Ивона; Чан, Юн-Шен (01 октября 2015 г.). «ELABELA — это эндогенный фактор роста, который поддерживает самообновление ЭСК через путь PI3K/AKT» . Клеточная стволовая клетка . 17 (4): 435–447. дои : 10.1016/j.stem.2015.08.010 . ISSN 1875-9777 . ПМИД 26387754 .
- ^ Славофф С.А., Хео Дж., Будник Б.А., Ханакахи Л.А., Сагателян А (апрель 2014 г.). «Человеческий полипептид, кодируемый короткой открытой рамкой считывания (sORF), который стимулирует соединение концов ДНК» . Журнал биологической химии . 289 (16): 10950–7. дои : 10.1074/jbc.c113.533968 . ПМК 4036235 . ПМИД 24610814 .
- ^ Го Б., Чжай Д., Кабесас Э., Уэлш К., Нурайни С., Саттертуэйт А.С., Рид Дж.К. (май 2003 г.). «Пептид гуманина подавляет апоптоз, препятствуя активации Bax». Природа . 423 (6938): 456–61. Бибкод : 2003Natur.423..456G . дои : 10.1038/nature01627 . ПМИД 12732850 . S2CID 4423176 .
- ^ Мацумото А, Пасут А, Мацумото М, Ямашита Р, Фунг Дж, Монтелеоне Э, Сагателян А, Накаяма К.И., Клохесси Дж.Г., Пандолфи П.П. (январь 2017 г.). «mTORC1 и регенерация мышц регулируются полипептидом SPAR, кодируемым LINC00961». Природа . 541 (7636): 228–232. Бибкод : 2017Natur.541..228M . дои : 10.1038/nature21034 . ПМИД 28024296 . S2CID 205253245 .