НГЛИ1
| НГЛИ1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | NGLY1 , CDG1V, PNG1, PNGаза, CDDG, N-гликаназа 1, PNG-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 610661 ; МГИ : 1913276 ; Гомологен : 10117 ; Генные карты : NGLY1 ; OMA : NGLY1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
PNGаза, также известная как N-гликаназа 1 (EC 3.5.1.52) или пептид-N(4)-(N-ацетил-бета-глюкозаминил)аспарагинамидаза, представляет собой фермент , который у людей кодируется NGLY1 геном . PNGаза представляет собой де- N -гликозилирующий фермент, который удаляет N- связанные или аспарагин -связанные гликаны ( N- гликаны) из гликопротеинов . [ 5 ] [ 6 ] [ 7 ] Более конкретно, NGLY1 катализирует гидролиз амидной связи между самым внутренним N- ацетилглюкозамином (GlcNAc) и остатком Asn на N- гликопротеине, образуя де- N -гликозилированный белок, в котором N -гликоилированный остаток Asn превращается в asp и свободный олигосахарид, содержащий 1-амино-GlcNAc. Затем аммиак спонтанно высвобождается из 1-аминоGlcNAc при физиологическом pH (<8), образуя свободный олигосахарид со структурой N,N'- диацетилхитобиозы на восстанавливающем конце.
Открытие
[ редактировать ]Впервые о появлении цитоплазматической активности PNGазы в клетках млекопитающих сообщалось в культивируемых клетках. [ 8 ] Этот фермент отличается от других «реагентных» PNGаз миндаля (гликоамидаза/PNGаза А), [ 9 ] или бактерии ( N -гликаназа/PNGаза F), [ 10 ] который часто используется для структурных/функциональных исследований N -гликанов в отношении некоторых ферментативных свойств, включая требование восстанавливающего реагента для активности и нейтрального pH для оптимальной активности. [ 8 ] [ 11 ] [ 12 ]
Ген, кодирующий цитоплазматическую PNGазу, был впервые идентифицирован у почкующихся дрожжей, а с тех пор Saccharomyces cerevisiae и ортологи генов были обнаружены у самых разных эукариот, включая млекопитающих. [ 13 ] Что касается тканевого распределения мышиного гена Ngly1 , ферментативная активность, а также транскрипты были обнаружены во всех исследованных тканях/органах. [ 12 ] [ 14 ]
Структура
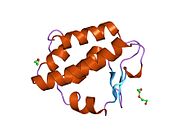
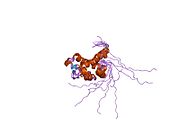
[ редактировать ]Известно, что каталитические остатки цитоплазматической PNGазы находятся в домене, называемом трансглутаминазным доменом. [ 15 ] [ 16 ] NGLY1 по сравнению с дрожжевыми ортологами обладает расширенными N-концевыми и C-концевыми последовательностями в дополнение к трансглутаминазному домену. Среди дополнительных доменов, обнаруженных в NGLY1, домен PUB (связанный с PNGазой и убиквитином) был впервые идентифицирован с помощью биоинформационного анализа. [ 17 ] [ 18 ] Хотя изначально предполагалось, что он может служить доменом межбелкового взаимодействия, [ 17 ] В настоящее время накапливаются экспериментальные данные, подтверждающие эту гипотезу. [ 19 ] [ 20 ] [ 21 ] С другой стороны, C-концевой домен PAW (домен, присутствующий в PNGазах и других белках червей). [ 18 ] теперь показано, что он участвует в связывании олигосахаридов с PNGазой. [ 22 ]
Что касается кристаллических структур мышиного Ngly1, каталитического основного домена, [ 23 ] C-концевой домен, включая домен PAW [ 22 ] и N-концевой домен, включая домен PUB. [ 24 ] были получены.
Функция
[ редактировать ]Что касается функции NGLY1, было показано, что фермент участвует в ER-ассоциированной деградации (ERAD), одной из систем контроля качества/гомеостаза ER для вновь синтезированных гликопротеинов. [ 25 ] [ 26 ] [ 27 ] [ 28 ] Однако функциональная важность NGLY1 в процессе ERAD до конца не понятна. Также было высказано предположение, что NGLY1 тесно вовлечен в презентацию антигена, опосредованную MHC класса I. [ 29 ] [ 30 ] [ 31 ] Ngly1-опосредованное (гликозилированное) дезамидирование Asn в Asp представляет собой, вместе с другими реакциями, такими как транспептидирование, нетрадиционные посттрансляционные модификации антигенных пептидов, которые представлены молекулами MHC класса I. [ 32 ]
NGLY1-связывающие белки
[ редактировать ]С помощью двухгибридного скрининга дрожжей было показано, что белки NGLY1 могут связываться с несколькими белками, в основном через N-концевой домен, включая домен PUB. [ 33 ] in vivo и in vitro между NGLY1 и несколькими белками, связанными с ERAD. Сообщалось о взаимодействиях [ 20 ] [ 23 ] [ 24 ] [ 33 ] [ 34 ] [ 35 ] [ 36 ] [ 37 ] [ 38 ] Хотя важность этих белок-белковых взаимодействий для функций NGLY1 еще предстоит выяснить, можно предположить, что такие взаимодействия могут быть полезны для эффективного процесса ERAD. [ 39 ]
Клиническое значение
[ редактировать ]В 2012 году дефицит NGLY1 , включающий мутации в локусе гена NGLY1 , был впервые выявлен с помощью анализа экзома. [ 40 ] На данный момент в литературе описаны клинические особенности 60 пациентов, и более 100 были идентифицированы группами защиты интересов пациентов. [ 41 ] [ 42 ] [ 43 ] [ 44 ] У одного пациента с церебральными нарушениями зрения (ЦВН) также была мутация в NGLY1 . гене [ 45 ] Клинические эффекты включают нейромоторные нарушения, умственную отсталость и невропатию. Это также связано с боковым амиотрофическим склерозом и болезнью Паркинсона.
Детали механизма, ответственного за патогенез дефицита NGLY1, остаются неизвестными, а внутриклеточное накопление белков N -GlcNAc обусловлено избыточным действием цитозольной эндо-bN-ацетилглюкозаминидазы. [ 46 ] неправильно свернутых гликопротеинов в клетках с дефицитом Ngly1 является. Предполагается, что потенциальной причиной [ 28 ]
Дефицит NGLY1 привлек внимание общественности. [ 47 ] [ 48 ] [ 49 ] [ 50 ]
Были проведены исследования с целью обнаружения небольших молекул, которые могут связываться с трансглутаминазным доменом белка, чтобы стабилизировать его в качестве потенциального терапевтического средства при лечении расстройств, вызванных дефектами NGLY1. [ 51 ]
Примечания
[ редактировать ]
Версия этой статьи 2015 года была обновлена внешним экспертом в рамках модели двойной публикации. Соответствующая академическая рецензируемая статья была опубликована в журнале Gene и может цитироваться как: Тадаши Судзуки; Чэнчэн Хуан; Харухико Фудзихира (20 ноября 2015 г.). «Цитоплазматический пептид: N-гликаназа (NGLY1) - Структура, экспрессия и клеточные функции» . Джин . Серия обзоров Gene Wiki. 577 (1): 1–7. дои : 10.1016/J.GENE.2015.11.021 . ISSN 0378-1119 . ПМЦ 4691572 . ПМИД 26611529 . Викиданные Q30274598 . |
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000151092 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000021785 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Хираяма Х., Хосоми А., Сузуки Т. (май 2015 г.). «Физиологические и молекулярные функции цитозольного пептида: N-гликаназы». Семинары по клеточной биологии и биологии развития . 41 : 110–120. дои : 10.1016/j.semcdb.2014.11.009 . ПМИД 25475175 .
- ^ Сузуки Т (январь 2015 г.). «Цитоплазматический пептид: N-гликаназа (Ngly1) – фундаментальная наука сталкивается с генетическим заболеванием человека» . Журнал биохимии . 157 (1): 23–34. дои : 10.1093/jb/mvu068 . ПМИД 25398991 .
- ^ Сузуки Т., Хуан С., Фудзихира Х. (февраль 2016 г.). «Цитоплазматический пептид: N-гликаназа (NGLY1) - Структура, экспрессия и клеточные функции» . Джин . 577 (1): 1–7. дои : 10.1016/j.gene.2015.11.021 . ПМЦ 4691572 . ПМИД 26611529 .
- ^ Jump up to: а б Сузуки Т., Секо А., Китадзима К., Иноуэ Ю., Иноуэ С. (август 1993 г.). «Идентификация активности пептида: N-гликаназы в культивируемых клетках млекопитающих». Связь с биохимическими и биофизическими исследованиями . 194 (3): 1124–1130. дои : 10.1006/bbrc.1993.1938 . ПМИД 8352768 .
- ^ Такахаши Н. (июнь 1977 г.). «Демонстрация новой амидазы, действующей на гликопептиды». Связь с биохимическими и биофизическими исследованиями . 76 (4): 1194–1201. дои : 10.1016/0006-291x(77)90982-2 . ПМИД 901470 .
- ^ Пламмер Т.Х., Элдер Дж.Х., Александр С., Фелан А.В., Тарентино А.Л. (сентябрь 1984 г.). «Демонстрация активности пептида: N-гликозидазы F в препаратах эндо-бета-N-ацетилглюкозаминидазы F» . Журнал биологической химии . 259 (17): 10700–10704. дои : 10.1016/S0021-9258(18)90568-5 . ПМИД 6206060 .
- ^ Сузуки Т., Секо А., Китадзима К., Иноуэ Ю., Иноуэ С. (июль 1994 г.). «Очистка и ферментативные свойства пептида: N-гликаназы из фибробластов L-929 мышиного происхождения C3H. Возможное широкое распространение посттрансляционной ремодификации белков путем N-дегликозилирования» . Журнал биологической химии . 269 (26): 17611–17618. дои : 10.1016/S0021-9258(17)32485-7 . ПМИД 8021270 .
- ^ Jump up to: а б Китаджима К., Сузуки Т., Коучи З., Иноуэ С., Иноуэ Ю. (июнь 1995 г.). «Идентификация и распространение пептида: N-гликаназы (PNGазы) в органах мыши». Архив биохимии и биофизики . 319 (2): 393–401. дои : 10.1006/abbi.1995.1309 . ПМИД 7786020 .
- ^ Сузуки Т., Парк Х., Холлингсворт, Н.М., Стернгланц Р., Леннарц В.Дж. (май 2000 г.). «PNG1, дрожжевой ген, кодирующий высококонсервативный пептид: N-гликаназу» . Журнал клеточной биологии . 149 (5): 1039–1052. дои : 10.1083/jcb.149.5.1039 . ПМК 2174826 . ПМИД 10831608 .
- ^ Сузуки Т., Квофи М.А., Леннарц В.Дж. (май 2003 г.). «Ngly1, мышиный ген, кодирующий дегликозилирующий фермент, участвующий в протеосомной деградации: экспрессия, геномная организация и хромосомное картирование». Связь с биохимическими и биофизическими исследованиями . 304 (2): 326–332. дои : 10.1016/s0006-291x(03)00600-4 . ПМИД 12711318 .
- ^ Макарова К.С., Аравинд Л., Кунин Е.В. (август 1999 г.). «Суперсемейство архейных, бактериальных и эукариотических белков, гомологичных трансглутаминазам животных» . Белковая наука . 8 (8): 1714–1719. дои : 10.1110/ps.8.8.1714 . ПМК 2144420 . ПМИД 10452618 .
- ^ Катияр С., Сузуки Т., Балгобин Б.Дж., Леннарц В.Дж. (апрель 2002 г.). «Исследование сайт-направленного мутагенеза дрожжевого пептида: N-гликаназы. Понимание механизма реакции дегликозилирования» . Журнал биологической химии . 277 (15): 12953–12959. дои : 10.1074/jbc.M111383200 . ПМИД 11812789 .
- ^ Jump up to: а б Сузуки Т., Парк Х., Тилль Э.А., Леннарц В.Дж. (октябрь 2001 г.). «Домен PUB: предполагаемый домен межбелкового взаимодействия, участвующий в пути убиквитин-протеасома». Связь с биохимическими и биофизическими исследованиями . 287 (5): 1083–1087. дои : 10.1006/bbrc.2001.5688 . ПМИД 11587532 .
- ^ Jump up to: а б Доркс Т., Копли Р.Р., Шульц Дж., Понтинг К.П., Борк П. (январь 2002 г.). «Систематическая идентификация новых семейств белковых доменов, связанных с ядерными функциями» . Геномные исследования . 12 (1): 47–56. дои : 10.1101/гр.203201 . ПМК 155265 . ПМИД 11779830 .
- ^ Аллен, доктор медицинских наук, Бухбергер А., Байкрофт М. (сентябрь 2006 г.). «Домен PUB функционирует как модуль связывания p97 в пептидной N-гликаназе человека» . Журнал биологической химии . 281 (35): 25502–25508. дои : 10.1074/jbc.M601173200 . ПМИД 16807242 .
- ^ Jump up to: а б Камия Ю, Уэкуса Ю, Сумиёси А, Сасакава Х, Хирао Т, Сузуки Т, Като К (апрель 2012 г.). «ЯМР-характеристика взаимодействия между доменом PUB пептида: N-гликаназы и убиквитин-подобным доменом HR23» . Письма ФЭБС . 586 (8): 1141–1146. дои : 10.1016/j.febslet.2012.03.027 . ПМИД 22575648 . S2CID 23573555 .
- ^ Шеффер В., Акуцу М., Олма М.Х., Гомес Л.К., Кавасаки М., Дикич И. (май 2014 г.). «Связывание OTULIN с доменом PUB HOIP контролирует передачу сигналов NF-κB» . Молекулярная клетка . 54 (3): 349–361. doi : 10.1016/j.molcel.2014.03.016 . ПМИД 24726327 .
- ^ Jump up to: а б Чжоу X, Чжао Дж., Трульо Дж.Дж., Ван Л., Ли Г., Леннарц В.Дж., Шинделин Х. (ноябрь 2006 г.). «Структурные и биохимические исследования С-концевого домена мышиного пептида-N-гликаназы идентифицируют его как маннозосвязывающий модуль» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (46): 17214–17219. Бибкод : 2006PNAS..10317214Z . дои : 10.1073/pnas.0602954103 . ПМК 1859912 . ПМИД 17088551 .
- ^ Jump up to: а б Чжао Г., Чжоу X, Ван Л., Ли Г., Кискер С., Леннарц В.Дж., Шинделин Х. (май 2006 г.). «Структура мышиного пептидного комплекса N-гликаназы-HR23 предполагает совместную эволюцию путей деградации, связанной с эндоплазматическим ретикулумом, и восстановления ДНК» . Журнал биологической химии . 281 (19): 13751–13761. дои : 10.1074/jbc.M600137200 . ПМИД 16500903 .
- ^ Jump up to: а б Чжао Г., Чжоу X, Ван Л., Ли Г., Шинделин Х., Леннарц В.Дж. (май 2007 г.). «Исследования взаимодействия пептида: N-гликаназы-p97 показывают, что фосфорилирование p97 модулирует деградацию, связанную с эндоплазматическим ретикулумом» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (21): 8785–8790. Бибкод : 2007PNAS..104.8785Z . дои : 10.1073/pnas.0702966104 . ПМК 1885580 . ПМИД 17496150 .
- ^ Вирц Э.Дж., Джонс Т.Р., Сан Л., Богьо М., Гёз Х.Дж., Плох Х.Л. (март 1996 г.). «Продукт гена цитомегаловируса человека US11 перемещает тяжелые цепи MHC класса I из эндоплазматического ретикулума в цитозоль» . Клетка . 84 (5): 769–779. дои : 10.1016/s0092-8674(00)81054-5 . ПМИД 8625414 . S2CID 5122267 .
- ^ Хирш К., Блом Д., Плох Х.Л. (март 2003 г.). «Роль N-гликаназы в цитозольном обороте гликопротеинов» . Журнал ЭМБО . 22 (5): 1036–1046. дои : 10.1093/emboj/cdg107 . ПМК 150340 . ПМИД 12606569 .
- ^ Гротцке Дж. Э., Лу К., Крессвелл П. (февраль 2013 г.). «Зависимые от дегликозилирования флуоресцентные белки предоставляют уникальные инструменты для изучения деградации, связанной с ER» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (9): 3393–3398. Бибкод : 2013PNAS..110.3393G . дои : 10.1073/pnas.1300328110 . ПМЦ 3587246 . ПМИД 23401531 .
- ^ Jump up to: а б Хуан С., Харада Ю., Хосоми А., Масахара-Негиши Ю., Сейно Дж., Фудзихира Х. и др. (февраль 2015 г.). «Эндо-β-N-ацетилглюкозаминидаза образует агрегаты белка N-GlcNAc во время ER-ассоциированной деградации в Ngly1-дефектных клетках» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (5): 1398–1403. Бибкод : 2015PNAS..112.1398H . дои : 10.1073/pnas.1414593112 . ПМК 4321286 . ПМИД 25605922 .
- ^ Скиппер Дж.К., Хендриксон Р.К., Гулден П.Х., Бришар В., Ван Пел А., Чен Ю. и др. (февраль 1996 г.). «HLA-A2-рестриктированный тирозиназный антиген на клетках меланомы возникает в результате посттрансляционной модификации и предполагает новый путь процессинга мембранных белков» . Журнал экспериментальной медицины . 183 (2): 527–534. дои : 10.1084/jem.183.2.527 . ПМК 2192446 . ПМИД 8627164 .
- ^ Альтрих-ВанЛит М.Л., Останкович М., Полефроне Дж.М., Моссе К.А., Шабановиц Дж., Хант Д.Ф., Энгельхард В.Х. (октябрь 2006 г.). «Процессинг эпитопа, ограниченного классом I, из тирозиназы требует пептидной N-гликаназы и совместного действия аминопептидазы 1 эндоплазматического ретикулума и цитозольных протеаз» . Журнал иммунологии . 177 (8): 5440–5450. дои : 10.4049/jimmunol.177.8.5440 . ПМИД 17015730 .
- ^ Карио Э., Тирош Б., Плух Х.Л., Навон А. (январь 2008 г.). «N-связанное гликозилирование не ухудшает протеосомную деградацию, но влияет на представление главного комплекса гистосовместимости класса I» . Журнал биологической химии . 283 (1): 244–254. дои : 10.1074/jbc.M706237200 . ПМИД 17951257 .
- ^ Далет А., Роббинс П.Ф., Строобант В., Виньерон Н., Ли Ю.Ф., Эль-Гамиль М. и др. (июль 2011 г.). «Антигенный пептид, полученный путем обратного сплайсинга и двойного дезамидирования аспарагина» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (29): Е323–Е331. Бибкод : 2011PNAS..108E.323D . дои : 10.1073/pnas.1101892108 . ПМК 3142003 . ПМИД 21670269 .
- ^ Jump up to: а б Пак Х., Сузуки Т., Леннарц В.Дж. (сентябрь 2001 г.). «Идентификация белков, которые взаимодействуют с пептидом млекопитающих: N-гликаназой и вовлекают эту гидролазу в протеасомно-зависимый путь деградации белка» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (20): 11163–11168. Бибкод : 2001PNAS...9811163P . дои : 10.1073/pnas.201393498 . ПМК 58701 . ПМИД 11562482 .
- ^ Макнил Х., Кнебель А., Артур Дж.С., Куэнда А., Коэн П. (декабрь 2004 г.). «Новый белок доменов UBA и UBX, который связывает полиубиквитин и VCP и является субстратом для SAPK» . Биохимический журнал . 384 (Часть 2): 391–400. дои : 10.1042/BJ20041498 . ПМЦ 1134123 . ПМИД 15362974 .
- ^ Катияр С., Ли Г., Леннарц В.Дж. (сентябрь 2004 г.). «Комплекс между пептидом: N-гликаназой и двумя белками, связанными с протеасомами, предполагает механизм деградации неправильно свернутых гликопротеинов» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (38): 13774–13779. Бибкод : 2004PNAS..10113774K . дои : 10.1073/pnas.0405663101 . ПМК 518832 . ПМИД 15358861 .
- ^ Катияр С., Джоши С., Леннарц В.Дж. (октябрь 2005 г.). «Белок ретротранслокации Дерлин-1 связывает пептид: N-гликаназу с эндоплазматическим ретикулумом» . Молекулярная биология клетки . 16 (10): 4584–4594. doi : 10.1091/mbc.E05-04-0345 . ПМК 1237066 . ПМИД 16055502 .
- ^ Ли Г, Чжоу Х, Чжао Г, Шинделин Х, Леннарц В.Дж. (ноябрь 2005 г.). «Множественные способы взаимодействия фермента дегликозилирования, мышиного пептида N-гликаназы, с протеасомой» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (44): 15809–15814. Бибкод : 2005PNAS..10215809L . дои : 10.1073/pnas.0507155102 . ПМК 1276080 . ПМИД 16249333 .
- ^ Ли Г, Чжао Г, Чжоу Х, Шинделин Х, Леннарц В.Дж. (май 2006 г.). «ААА-АТФаза p97 связывает пептид N-гликаназу с рецептором аутокринного фактора подвижности E3-лигазы, связанной с эндоплазматическим ретикулумом» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (22): 8348–8353. Бибкод : 2006PNAS..103.8348L . дои : 10.1073/pnas.0602747103 . ПМЦ 1482497 . ПМИД 16709668 .
- ^ Сузуки Т., Леннарц В.Дж. (февраль 2003 г.). «Гипотеза: комплекс деградации гликопротеина, образующийся в результате белок-белкового взаимодействия, включает цитоплазматический пептид: N-гликаназу». Связь с биохимическими и биофизическими исследованиями . 302 (1): 1–5. дои : 10.1016/s0006-291x(03)00052-4 . ПМИД 12593838 .
- ^ Нужен AC, Шаши В., Хитоми Ю., Шох К., Шианна К.В., Макдональд М.Т. и др. (июнь 2012 г.). «Клиническое применение секвенирования экзома при недиагностированных генетических состояниях» . Журнал медицинской генетики . 49 (6): 353–361. doi : 10.1136/jmedgenet-2012-100819 . ПМК 3375064 . ПМИД 22581936 .
- ^ Леви Р.Дж., Frater CH, Gallentine WB, Филлипс Дж.М., Ружников М.Р. (март 2022 г.). «Определение фенотипа эпилепсии при дефиците NGLY1». Журнал наследственных метаболических заболеваний . 45 (3): 571–583. дои : 10.1002/jimd.12494 . ПМИД 35243670 . S2CID 247228775 .
- ^ Эннс Г.М., Шаши В., Бейнбридж М., Гамбелло М.Дж., Захир Ф.Р., Баст Т. и др. (октябрь 2014 г.). «Мутации в NGLY1 вызывают наследственное нарушение пути деградации, связанного с эндоплазматическим ретикулумом» . Генетика в медицине . 16 (10): 751–758. дои : 10.1038/gim.2014.22 . ПМК 4243708 . ПМИД 24651605 .
- ^ Чаглаян А.О., Кому С., Бараноски Дж.Ф., Парман Ю., Каймакчалан Х., Акгумус Г.Т. и др. (январь 2015 г.). «Мутация NGLY1 вызывает нейромоторные нарушения, умственную отсталость и невропатию» . Европейский журнал медицинской генетики . 58 (1): 39–43. дои : 10.1016/j.ejmg.2014.08.008 . ПМЦ 4804755 . ПМИД 25220016 .
- ^ Хили Дж., Шинави М. (апрель 2015 г.). «Мультисистемное участие в расстройстве, связанном с NGLY1, вызванном двумя новыми мутациями». Американский журнал медицинской генетики. Часть А. 167А (4): 816–820. дои : 10.1002/ajmg.a.36889 . ПМИД 25707956 . S2CID 7959186 .
- ^ Бош Д.Г., Бунстра Ф.Н., де Леу Н., Пфундт Р., Нилсен В.М., де Лигт Дж. и др. (май 2016 г.). «Новые генетические причины церебральных нарушений зрения» . Европейский журнал генетики человека . 24 (5): 660–665. дои : 10.1038/ejhg.2015.186 . ПМЦ 4930090 . ПМИД 26350515 .
- ^ Сузуки Т., Яно К., Сугимото С., Китадзима К., Леннарц В.Дж., Иноуэ С. и др. (июль 2002 г.). «Эндо-бета-N-ацетилглюкозаминидаза, фермент, участвующий в переработке свободных олигосахаридов в цитозоле» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (15): 9691–9696. Бибкод : 2002PNAS...99.9691S . дои : 10.1073/pnas.152333599 . ПМК 124980 . ПМИД 12114544 .
- ^ «Дети, которые не плачут: обнаружено новое генетическое заболевание» . 20 марта 2014 г.
- ^ Мнукин С. (14 июля 2014 г.). "Единственный в своем роде" . Житель Нью-Йорка .
- ^ «Выслеживание убийцы моего сына» .
- ^ Мэйт М., Уилси М. (октябрь 2014 г.). «Изменяющаяся модель в клинической диагностике: как секвенирование следующего поколения и семьи меняют способы обнаружения, изучения и лечения редких заболеваний» . Генетика в медицине . 16 (10): 736–737. дои : 10.1038/gim.2014.23 . ПМИД 24651604 . S2CID 27270375 .
- ^ Шринивасан Б., Чжоу Х., Митра С., Сколник Дж. (октябрь 2016 г.). «Новые низкомолекулярные связыватели человеческой N-гликаназы 1, ключевого игрока в пути деградации, связанной с эндоплазматическим ретикулумом» . Биоорганическая и медицинская химия . 24 (19): 4750–4758. дои : 10.1016/j.bmc.2016.08.019 . ПМК 5015769 . ПМИД 27567076 .
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .