Спиновые изомеры водорода

Молекулярный водород существует в двух изомерных формах: одна с двумя ядерными спинами протонов, ориентированными параллельно (ортоводород), другая с двумя спинами протонов, ориентированными антипараллельно (параводород). [1] Эти две формы часто называют спиновыми изомерами. [2] или как изомеры ядерного спина. [3]
Параводород находится в более низкоэнергетическом состоянии, чем ортоводород. При комнатной температуре и тепловом равновесии термическое возбуждение приводит к тому, что водород состоит примерно из 75% ортоводорода и 25% параводорода. Когда водород сжижается при низкой температуре, происходит медленный самопроизвольный переход к преимущественно пара-соотношению, при этом высвобождаемая энергия имеет значение для хранения. По существу чистую форму параводорода можно получить при очень низких температурах, однако получить при нагревании образец, содержащий более 75% ортоводорода, невозможно.
Смесь или смесь орто- и параводорода в соотношении 50:50 можно получить в лаборатории, пропуская ее через катализатор на основе оксида железа (III) при температуре жидкого азота (77 К). [4] или храня водород при температуре 77 К в течение 2–3 часов в присутствии активированного угля. [5] В отсутствие катализатора релаксация параводорода в газовой фазе до нормального водорода при комнатной температуре занимает несколько дней, тогда как в органических растворителях на это требуются часы. [5]
Ядерные спиновые состояния H 2
[ редактировать ]Этот раздел может быть слишком техническим для понимания большинства читателей . ( Май 2015 г. ) |
Каждая водорода молекула ( H
2 ) состоит из двух атомов водорода , связанных ковалентной связью . Если пренебречь небольшой долей дейтерия и трития , которые могут присутствовать, каждый атом водорода состоит из одного протона и одного электрона . Каждый протон имеет связанный с ним магнитный момент , который связан со спином протона. 1 ⁄ 2 . В Х
2 , спины двух ядер водорода (протонов) соединяются, образуя триплетное состояние, известное как ортоводород , и синглетное состояние, известное как параводород .
Триплетное ортоводородное состояние имеет полный ядерный спин I = 1, так что компонент вдоль определенной оси может иметь три значения M I = 1, 0 или -1. Соответствующие волновые функции ядерного спина: , и . В этом формализме используются стандартные обозначения скобок ; символ ↑ представляет волновую функцию со спином вверх , а символ ↓ — волновую функцию со спином вниз для ядра, поэтому ↑↓ означает, что первое ядро расположено вверх, а второе вниз. Тогда каждый энергетический уровень ортоводорода имеет (ядерное) спиновое вырождение , равное трем, что означает, что он соответствует трем состояниям с одинаковой энергией (в отсутствие магнитного поля). [1] Синглетное состояние параводорода имеет квантовые числа ядерного спина I = 0 и MI = 0 , с волновой функцией . Поскольку существует только одна возможность, каждый уровень параводорода имеет спиновое вырождение, равное единице, и называется невырожденным. [1]
Допустимые уровни вращательной энергии
[ редактировать ]Поскольку протоны имеют спин 1 ⁄ 2 , они являются фермионами и перестановочная антисимметрия полного H
2 волновая функция накладывает ограничения на возможные вращательные состояния двух форм H
2 . [1] Ортоводород с симметричными функциями ядерного спина может иметь только вращательные волновые функции, которые антисимметричны относительно перестановки двух протонов, что соответствует нечетным значениям вращательного квантового числа J ; и наоборот, параводород с антисимметричной функцией ядерного спина может иметь только вращательные волновые функции, симметричные относительно перестановки двух протонов, что соответствует четному J . [1]
Пара-форма, самый низкий уровень которой J = 0, более стабильна на 1,455 кДж/моль. [6] [7] чем орто-форма, самый низкий уровень которой равен J = 1. Соотношение между количеством орто- и пара-молекул составляет около 3: 1 при стандартной температуре , когда заселено множество уровней вращательной энергии, что отдает предпочтение орто-форме за счет тепловой энергии. Однако при низких температурах J = 0, так что пара-форма доминирует при низких температурах (около 99,8% при 20 К). заметно заселяется только уровень [8] Теплота испарения составляет всего 0,904 кДж/моль. В результате орто-жидкий водород, уравновешивающийся пара-форме, выделяет достаточно энергии, чтобы вызвать значительные потери при кипении. [6]
Термические свойства
[ редактировать ]Этот раздел нуждается в дополнительных ссылках на вторичные или третичные источники . ( Май 2015 г. ) |
Применяя приближение жесткого ротора , энергии и вырождения вращательных состояний определяются как: [9] [ нужна страница ]
- .
Вращательная статистическая сумма условно записывается как: [ нужна ссылка ]
- .
Однако, пока два спиновых изомера не находятся в равновесии, полезнее написать для каждого отдельные статистические суммы: [ нужна ссылка ]
Коэффициент 3 в статистической сумме для ортоводорода учитывает спиновое вырождение, связанное со спиновым состоянием +1; когда равновесие между спиновыми изомерами возможно, тогда общую статистическую сумму, учитывающую эту разницу вырождения, можно записать как: [ нужна ссылка ]
Молярные энергии вращения и теплоемкости для любого из этих случаев получаются из: [ нужна ссылка ]
Показанные здесь графики представляют собой молярные энергии вращения и теплоемкости орто- и параводорода, а также «нормальное» соотношение орто: пара (3: 1) и равновесные смеси: [ нужна ссылка ]

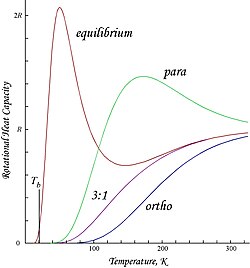
Из-за налагаемого антисимметрией ограничения на возможные вращательные состояния ортоводород имеет остаточную вращательную энергию при низкой температуре, при которой почти все молекулы находятся в состоянии J = 1 (молекулы в симметричном спин-триплетном состоянии не могут перейти в самое низкое, симметричное вращательное состояние). ядерного спина ) и обладает энтропией из-за тройного вырождения триплетного состояния. [ нужна ссылка ] Остаточная энергия значительна, поскольку уровни вращательной энергии относительно широко разнесены в H.
2 ; промежуток между первыми двумя уровнями, выраженный в единицах температуры, в два раза превышает характерную вращательную температуру для H
2 : [ нужна ссылка ]
- .
Это точка пересечения T = 0, наблюдаемая в молярной энергии ортоводорода. Поскольку «нормальный» водород при комнатной температуре представляет собой смесь орто: пара 3: 1, его молярная остаточная энергия вращения при низкой температуре составляет (3/4) × 2 Rθ rot ≈ 1091 Дж / моль, [ нужна ссылка ] что несколько больше энтальпии испарения нормального водорода, равной 904 Дж/моль при температуре кипения, T b ≈ 20,369 К. [10] Примечательно, что температуры кипения параводорода и нормального (3:1) водорода почти равны; для параводорода ∆H vap ≈ 898 Дж/моль при T b ≈ 20,277 К, откуда следует, что почти вся остаточная вращательная энергия ортоводорода сохраняется в жидком состоянии. [ нужна ссылка ]
Однако ортоводород термодинамически нестабилен при низких температурах и самопроизвольно превращается в параводород. [11] В этом процессе отсутствует какой-либо естественный режим излучения девозбуждения, поэтому он протекает медленно из-за отсутствия катализатора, который может облегчить взаимное преобразование синглетного и триплетного спиновых состояний. [11] При комнатной температуре водород содержит 75% ортоводорода, часть которого сохраняется в процессе сжижения, если его проводить в отсутствие катализатора , такого как оксид железа , активированный уголь , платинированный асбест, редкоземельные металлы, соединения урана, оксид хрома или некоторые соединения никеля. для ускорения превращения жидкого водорода в параводород. В качестве альтернативы можно использовать дополнительное холодильное оборудование для медленного поглощения тепла, которое будет (более медленно) выделять ортоводородная фракция при самопроизвольном превращении в параводород. [ нужна ссылка ] Если из быстро сжиженного водорода не удалить ортоводород без катализатора, то тепло, выделяющееся при его распаде, может выпарить до 50% исходной жидкости.
История
[ редактировать ]Необычная теплоемкость водорода была открыта в 1912 году Арнольдом Ойкеном . [12] Две формы молекулярного водорода были впервые предложены Вернером Гейзенбергом и Фридрихом Хундом в 1927 году. Принимая во внимание эту теоретическую основу, чистый параводород был впервые синтезирован Паулем Хартеком и Карлом Фридрихом Бонхеффером в 1929 году в Институте физической химии и электрохимии кайзера Вильгельма . [13] [14] Когда в 1932 году Гейзенбергу была присуждена Нобелевская премия по физике за создание квантовой механики, это открытие «аллотропных форм водорода» было отмечено как наиболее примечательное его применение. [15] Дальнейшая работа над свойствами и химической реакционной способностью параводорода была проведена в следующем десятилетии Элли Шваб-Агаллидис и Георгом-Марией Шваб . [16]
Современное выделение чистого параводорода с тех пор было достигнуто с помощью быстрого осаждения в вакууме твердого параводорода толщиной в несколько миллиметров (p – H
2 ) образцы, отличающиеся превосходными оптическими качествами. [17]
Использование в ЯМР и МРТ.
[ редактировать ]используется избыток параводорода Когда во время реакций гидрирования (вместо обычной смеси ортоводорода с параводородом в соотношении 3:1), полученный продукт демонстрирует гиперполяризованные сигналы в спектрах ЯМР протонов , эффект, называемый PHIP (поляризация, индуцированная параводородом) или, что то же самое, ПАСАДЕНА (Параводород и синтез позволяют значительно улучшить ядерное выравнивание; назван в честь первого признания эффекта Бауэрсом и Вайтекампом из Калифорнийского технологического института ), [18] [ нужна ссылка ] явление, которое использовалось для изучения механизма реакций гидрирования. [19] [20]
Усиление сигнала путем обратимого обмена (SABRE) — это метод гиперполяризации образцов без их химической модификации. По сравнению с ортоводородом или органическими молекулами, гораздо большая часть ядер водорода в параводороде выравнивается под действием приложенного магнитного поля. В SABRE металлический центр обратимо связывается как с тестируемой молекулой, так и с молекулой параводорода, помогая молекуле-мишени улавливать поляризацию параводорода. [21] [22] [23] Этот метод можно улучшить и использовать для широкого спектра органических молекул, используя промежуточную «реле»-молекулу, такую как аммиак. Аммиак эффективно связывается с металлическим центром и принимает поляризацию параводорода. Затем аммиак передает поляризацию другим молекулам, которые не так хорошо связываются с металлическим катализатором. [24] Этот улучшенный сигнал ЯМР позволяет быстро анализировать очень небольшие количества материала и имеет большой потенциал для применения в магнитно-резонансной томографии .
Дейтерий
[ редактировать ]Двухатомный дейтерий ( D
2 ) имеет изомеры ядерного спина, такие как двухатомный водород, но с разными популяциями двух форм, поскольку ядро дейтерия (дейтрон) представляет собой бозон с ядерным спином, равным единице. [25] Существует шесть возможных ядерных спиновых волновых функций, которые орто- или симметричны обмену двух ядер, и три пара- или антисимметричны. [25] Орто-состояния соответствуют четным вращательным уровням с симметричными вращательными функциями, так что полная волновая функция симметрична, что требуется для обмена двумя бозонами, а пара-состояния соответствуют нечетным вращательным уровням. [25] Основное состояние ( J = 0), заселенное при низкой температуре, является орто, а при стандартной температуре соотношение орто: пара составляет 2:1. [25]
Другие вещества со спин-изомерами
[ редактировать ]Другие молекулы и функциональные группы, содержащие два атома водорода, например вода. [26] и метилен (СН 2 ), [27] также имеются орто- и пара-формы (например, орто- и паравода), но это не имеет большого значения для их термических свойств. [27] Их соотношение орто:пара отличается от соотношения диводорода. Недавно были выделены орто- и пара-формы воды. Было обнаружено, что пара-вода на 25% более активна в реакции переноса протона. [28] [29]
Молекулярный кислород ( O
2 в основном состоянии ) также существует в трех триплетных состояниях с более низкой энергией и одном синглетном состоянии, как парамагнитный триплетный кислород и высокореактивный диамагнитный синглетный кислород с высокой реакционной способностью . Эти состояния возникают из-за спинов их неспаренных электронов , а не их протонов или ядер.
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Аткинса П. Аткинс и Дж. де Паула, Физическая химия , 8-е издание (WHFreeman 2006), с. 451–2 ISBN 0-7167-8759-8
- ^ Мэтьюз, MJ; Петитпас, Г.; Асевес, С.М. (2011). «Исследование кинетики конверсии спин-изомеров в сверхкритическом жидком водороде для технологий хранения криогенного топлива». Прил. Физ. Летт . 99 (8): 081906. Бибкод : 2011АпФЛ..99х1906М . дои : 10.1063/1.3628453 .
- ^ Чен, Джуди Ю.-К.; Ли, Юнджун; Фрунзи, Майкл; Лей, Сюэгун; Мурата, Ясудзиро; Лоулер, Рональд Г.; Турро, Николас (13 сентября 2013 г.). «Ядерные спиновые изомеры молекул-гостей в H2@C60, H2O@C60 и других эндофуллеренах» . Философские труды Королевского общества А. 371 (1998). Бибкод : 2013RSPTA.37110628C . дои : 10.1098/rsta.2011.0628 . ПМИД 23918710 . S2CID 20443766 .
- ^ Мацумото, Мицуру; Эспенсон, Джеймс Х. (2005). «Кинетика взаимного превращения параводорода и ортоводорода, катализируемого парамагнитными комплексными ионами». Журнал Американского химического общества . 127 (32): 11447–11453. дои : 10.1021/ja0524292 . ISSN 0002-7863 . ПМИД 16089474 .
- ^ Jump up to: а б Аруланда, Кристи; Старовойтова Лариса; Кане, Дэниел (2007). «Продольная ядерная спиновая релаксация орто- и параводорода, растворенного в органических растворителях». Журнал физической химии А. 111 (42): 10615–10624. Бибкод : 2007JPCA..11110615A . дои : 10.1021/jp073162r . ISSN 1089-5639 . ПМИД 17914761 .
- ^ Jump up to: а б «Открытие параводорода» . Институт биофизической химии Макса Планка (на немецком языке). Архивировано из оригинала 16 ноября 2020 года . Проверено 9 ноября 2020 г.
- ^ Ривз, Роберт Б.; Хартек, Пол (1979). «Орто и параводород в межзвездном материале» . Журнал естественных исследований А. 34а (2): 163–166. Стартовый код : 1979ЗНатА..34..163Р . дои : 10.1515/zna-1979-0206 . S2CID 10149772 . Проверено 9 ноября 2020 г.
В этом источнике указано 0,34 ккал/моль (= 1,4 кДж/моль).
- ^ Рок, Питер А., Химическая термодинамика; принципы и приложения (Macmillan 1969) Таблица с. 478 показывает (N o /N p )H 2 = 0,002 при 20 К. ISBN 1-891389-32-7
- ^ FT Wall (1974). Химическая термодинамика , 3-е издание. WH Фриман и компания
- ^ «Теплофизические свойства жидких систем» . Веббук.nist.gov . Проверено 14 мая 2015 г.
- ^ Jump up to: а б Миленко, Ю. Я.; Сибилева Р.М.; Стржемечный, Массачусетс (1 апреля 1997 г.). «Степень естественной орто-пара-конверсии в жидком и газообразном водороде» . Журнал физики низких температур . 107 (1): 77–92. Бибкод : 1997JLTP..107...77M . дои : 10.1007/BF02396837 . ISSN 1573-7357 . S2CID 120832814 .
- ^ А. Ойкен, «Молекулярное тепло водорода при низких температурах». Королевская Прусская академия наук (Берлин). Отчеты о собраниях (1912 г.): стр. 141–151.
- ^ Бонхёффер, К.Ф.; Хартек, П. (1929). «Опыты с пара- и ортоводородом» . Естественные науки (на немецком языке). 17 (11): 182. Бибкод : 1929NW.....17..182B . дои : 10.1007/BF01506559 . ISSN 0028-1042 . S2CID 20704671 .
- ^ Майкл Поланьи и его поколение: истоки социального строительства науки Мэри Джо Най, University of Chicago Press (2011), с. 119 ISBN 0-226-61065-9
- ^ Вернер Гейзенберг - Факты Nobelprize.org
- ^ «Элли Шваб-Агаллидис» . Лаборатория физической химии (на греческом языке). Афинский университет, химический факультет . Проверено 11 апреля 2021 г.
- ^ Быстрое осаждение из паровой фазы оптически прозрачных образцов твердого параводорода толщиной в миллиметры для спектроскопии матричной изоляции - Бурные среды
- ^ Бауэрс, ЧР; Вайтекамп, Д.П. (1986). «Преобразование порядка симметризации в намагниченность ядерного спина посредством химической реакции и ядерного магнитного резонанса» (PDF) . Письма о физических отзывах . 57 (21): 2645–2648. Бибкод : 1986PhRvL..57.2645B . дои : 10.1103/physrevlett.57.2645 . ПМИД 10033824 .
- ^ Дакетт, SB; Мьюис (2013). Улучшение чувствительности ЯМР и МРТ с помощью параводорода . Темы современной химии. Том. 338. С. 75–103. дои : 10.1007/128_2012_388 . ISBN 978-3-642-39727-1 . ПМИД 23138689 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Адамс, RW; Агилар, Дж.А.; Аткинсон, К.Д.; Коули, MJ; Эллиотт, частный детектив; Дакетт, SB; Грин, Г.Г.; Хазал, ИГ; Лопес-Серрано, Дж; Уильямсон, округ Колумбия (2009). «Обратимые взаимодействия с параводородом повышают чувствительность ЯМР за счет переноса поляризации» (PDF) . Наука . 323 (5922): 1708–11. Бибкод : 2009Sci...323.1708A . дои : 10.1126/science.1168877 . hdl : 20.500.11820/e1a90be9-4d10-466c-8535-1653cd039cbd . ПМИД 19325111 . S2CID 3158148 .
- ^ Эшуис, Нэн; Асперс, Рууд ЛЕГ; ван Верденбург, Брэм Дж.А.; Фейтерс, Мартин С.; Рутьес, Флорис ПДжТ; Вейменга, Сибрен С.; Тессари, Марко (2016). «Определение дальнодействующих скалярных констант связи 1 H – 1 H, ответственных за перенос поляризации в SABRE». Журнал магнитного резонанса . 265 : 59–66. Бибкод : 2016JMagR.265...59E . дои : 10.1016/j.jmr.2016.01.012 . hdl : 2066/161984 . ISSN 1090-7807 . ПМИД 26859865 .
- ^ Ратайчик, Томаш; Гутманн, Торстен; Бернатович, Петр; Бунтковский, Герд; Фридель, Ярослав; Федорчик, Бартломей (2015). «Усиление сигнала ЯМР за счет эффективного мечения олигопептидов SABER» . Химия – Европейский журнал . 21 (36): 12616–12619. дои : 10.1002/chem.201501552 . ISSN 1521-3765 . ПМИД 26189499 .
- ^ Ратайчик, Томаш; Бунтковский, Герд; Гутманн, Торстен; Федорчик, Бартломей; Мамес, Адам; Петржак, Мариуш; Пуцио, Сюзанна; Шкудларек, Петр Гжегож (2021). «Усиление магнитно-резонансного сигнала путем обратимого обмена селективными олигопептидными лигандами PyFALGEA на рецепторы эпидермального фактора роста» . ХимБиоХим . 22 (5): 855–860. дои : 10.1002/cbic.202000711 . ISSN 1439-7633 . ПМИД 33063920 . S2CID 222819924 .
- ^ Яли, Виссам; Рейнер, Питер Дж.; Дакетт, Саймон Б. (2018). «Использование параводорода для гиперполяризации аминов, амидов, карбоновых кислот, спиртов, фосфатов и карбонатов» . Достижения науки . 4 (1): eaao6250. Бибкод : 2018SciA....4.6250I . дои : 10.1126/sciadv.aao6250 . ISSN 2375-2548 . ПМК 5756661 . ПМИД 29326984 .
- ^ Jump up to: а б с д Холлас, Дж. Майкл (1996). Современная спектроскопия (3-е изд.). Джон Уайли и сыновья. п. 115. ИСБН 0-471-96523-5 .
- ^ Тихонов Владимир Иванович; Волков, Александр А. (28 июня 2002 г.). «Разделение воды на орто- и пара-изомеры» . Наука . 296 (5577): 2363. doi : 10.1126/science.1069513 . ПМИД 12089435 . S2CID 26190863 . Проверено 16 июля 2021 г.
- ^ Jump up to: а б Шиницкий, Меир; Элицур, Авшалом К. (2006). «Орто-пара-спиновые изомеры протонов метиленовой группы». Хиральность . 18 (9): 754–756. дои : 10.1002/чир.20319 . ПМИД 16856167 .
- ^ «Впервые выделены две разные формы воды» . Новости BBC - Наука . 30 мая 2018 года . Проверено 16 июля 2021 г.
Если ядерные спины двух атомов водорода в воде ориентированы в одном направлении, это называется орто-водой. Если они расположены в разных направлениях, это называется параводой.
- ^ Киладж, Ардита; Гао, Хун; Рош, Дэниел; Риверо, Усия; Куппер, Йохен; Виллич, Стефан (29 мая 2018 г.). «Наблюдение различной реакционной способности пара- и орто-воды по отношению к захваченным ионам диазенилия» (PDF) . Природные коммуникации . 9 (статья 2096): 2096. arXiv : 1804.05925 . Бибкод : 2018NatCo...9.2096K . дои : 10.1038/s41467-018-04483-3 . ПМЦ 5974139 . ПМИД 29844308 . Проверено 16 июля 2021 г.
В качестве примера исследуем реакцию переноса протона воды с ионным диазенилием (N 2 H + )
Дальнейшее чтение
[ редактировать ]- Алин Леон, Эд. 2008, Водородная технология: мобильные и портативные приложения, стр. 93–101, Нью-Йорк, штат Нью-Йорк: Springer Science & Business, ISBN 3-540-69925-2 , см. [1] , по состоянию на 10 мая 2015 г.
- Тихонов В.И., Волков А.А. (2002). «Разделение воды на орто- и пара-изомеры». Наука . 296 (5577): 2363. doi : 10.1126/science.1069513 . ПМИД 12089435 . S2CID 26190863 .
- Марио Э. Фахардо; Саймон Тэм (1997). Быстрое осаждение из паровой фазы оптически прозрачных образцов твердого параводорода толщиной в миллиметры для матричной изолирующей спектроскопии . Авиабаза Эдвардс (Западное управление силовых установок): Исследовательская лаборатория ВВС США.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) [ нужна страница ] - Бауэрс, ЧР; Вайтекамп, Д.П. (1986). «Преобразование порядка симметризации в намагниченность ядерного спина посредством химической реакции и ядерного магнитного резонанса» (PDF) . Физ. Преподобный Летт . 57 (21): 2645–2648. Бибкод : 1986PhRvL..57.2645B . дои : 10.1103/physrevlett.57.2645 . ПМИД 10033824 .
- А. Фаркас (1935). Ортоводород, параводород и тяжелый водород . Кембриджская серия по физической химии. Кембридж, Великобритания: Кубок . [ нужна страница ]
- Бонхеффер К.Ф. , Хартек П. (1929). «Пара- и ортоводород». Журнал физической химии Б. 4 (1–2): 113–141.
- Oxford Instruments, дата неизвестна, «Повышение чувствительности ЯМР-спектроскопии с использованием параводорода»









