Подсчет виртуальных колоний
Подсчет виртуальных колоний ( VCC ) — это кинетический 96-луночный микробиологический анализ, первоначально разработанный для измерения активности дефенсинов . [1] С тех пор его стали применять к другим антимикробным пептидам, включая LL-37 . [2] В нем используется метод подсчета бактерий, называемый количественной кинетикой роста, который сравнивает время, необходимое бактериальной периодической культуре для достижения пороговой оптической плотности, со временем серии калибровочных кривых. Название VCC также использовалось для описания применения количественной кинетики роста для подсчета бактерий в моделях инфекции клеточных культур. [3] Тестирование чувствительности к противомикробным препаратам (AST) можно проводить на 96-луночных планшетах путем разведения противомикробного агента в различных концентрациях в бульоне, инокулированном бактериями , и измерения минимальной ингибирующей концентрации , при которой рост бактерий отсутствует. Однако эти методы нельзя использовать для изучения некоторых мембраноактивных антимикробных пептидов , ингибируемых самим бульоном. Процедура виртуального подсчета колоний использует этот факт, сначала подвергая бактериальные клетки воздействию активного противомикробного агента в буфере с низким содержанием соли в течение двух часов, затем одновременно ингибируя противомикробную активность и вызывая экспоненциальный рост путем добавления бульона. Кинетику роста выживших клеток можно затем отслеживать с помощью устройства для чтения планшетов с контролируемой температурой . Время, необходимое каждой кривой роста для достижения порогового изменения оптической плотности, затем преобразуется в виртуальные значения выживаемости, которые служат мерой противомикробной активности.
Тестирование чувствительности к противомикробным препаратам
[ редактировать ]Методы проверки антибактериальной активности противомикробных препаратов существуют уже многие десятилетия. [4] [5] Обычно они включают воздействие противомикробного агента на бактерии в присутствии питательных веществ, которые в противном случае обеспечили бы устойчивый рост бактерий. Эксперименты можно было проводить либо на чашках, содержащих агар в качестве твердой подложки, либо в жидком бульоне без агара. [6] С использованием этих методов было разработано множество низкомолекулярных антибиотиков. Однако, когда исследователи захотели изучить антибактериальную активность некоторых антимикробных пептидов, возникла сложность, поскольку они ингибируются насыщенной средой, независимо от того, подается ли она на чашке с агаром или в бульоне. Например, дефенсины — это антимикробные пептиды, которые являются частью врожденной иммунной системы многих организмов, включая человека. Они разделены на несколько структурных классов, включая альфа, бета и тета, в зависимости от характера дисульфидных связей. В гранулах нейтрофилов обнаружены четыре альфа-дефенсина человека, которые известны как пептиды нейтрофилов человека (HNP) 1-4. На ранних этапах изучения дефенсинов было обнаружено, что HNP сильно ингибируются физиологическими концентрациями солей. Чтобы измерить антимикробную активность HNP, их необходимо было инкубировать с клетками в буфере с низким содержанием соли в качестве отдельного начального этапа, прежде чем добавлять богатую среду, позволяющую подсчитать выживших. Поскольку нет возможности анализировать пептиды, такие как дефенсин HNP1, в присутствии физиологически значимых концентраций солей, любой анализ, измеряющий активность HNP1, использует условия, отличные от тех, которые присутствуют в организме.
Традиционный подсчет колоний
[ редактировать ]Одним из методов, обычно используемых для измерения антимикробной активности в жидкости, является воздействие противомикробного агента на клетки в течение периода инкубации, например, двух часов, а затем подсчет выживших путем разведения смеси и последующего распределения части жидкости на чашке с агаром, содержащей насыщенную среду. . [2] Стадию инкубации обычно проводят на 96-луночном планшете. После распределения чашки с агаром инкубируют в течение ночи и на следующий день подсчитывают количество колониеобразующих единиц (КОЕ). Эти методы имеют ряд недостатков, включая неточность, возникающую на этапе разведения, и возможность того, что потребуется большое количество чашек с агаром для получения приемлемого количества колоний на чашку. [7] Обратите внимание, что для измерения противомикробной активности антимикробных агентов, таких как дефенсины, двухчасовой этап инкубации должен проводиться в буфере с низким содержанием соли, таком как 10 мМ фосфат натрия, pH 7,4.
Минимальная ингибирующая концентрация
[ редактировать ]Другой метод, обычно используемый для измерения антимикробной активности в жидкости, состоит в том, чтобы подвергнуть серии разведений противомикробного агента клеткам в богатом бульоне, таком как бульон Мюллера-Хинтона (MHB), в 96-луночном планшете, а затем инкубировать 96-луночный планшет при 37°С. °С в течение ночи. Каждая лунка либо станет мутной из-за роста бактерий, либо останется прозрачной. Минимальная ингибирующая концентрация (МИК) затем указывается как самая низкая концентрация, которая обеспечивает прозрачную лунку и, таким образом, подавляет рост. [8] Стандартизированные методы МИК с использованием MHB не применимы к противомикробным агентам, таким как дефенсины, поскольку для измерения их активности дефензины необходимо инкубировать в буфере с низким содержанием соли, а не в богатом бульоне.
Подсчет виртуальных колоний
[ редактировать ]Традиционный метод подсчета колоний можно модифицировать для измерения антимикробной активности в 96-луночном планшете без необходимости отбора проб из лунок и распределения выживших клеток по чашкам с агаром, просто добавив равный объем дважды концентрированного бульона после двухчасовой инкубации в буфер с низким содержанием соли. Должен быть способ определить, сколько клеток выживет в конце инкубационного периода, используя периодические культуры. К счастью, математика экспоненциального роста предлагает способ сделать именно это. Если мутность или оптическую плотность серийных культур в 96-луночном планшете контролируют в режиме реального времени, записывают количество времени, необходимое лунке для достижения порогового значения, и определяют время удвоения экспоненциально растущих клеток. известно, то можно вычислить количество клеток, первоначально присутствующих в инокуляте. Это начальное количество клеток равно количеству выживших клеток в конце двухчасовой инкубации с противомикробным агентом. Поскольку эта процедура не требует фактического формирования колоний или подсчета колоний, ее называют «виртуальным подсчетом колоний». До сих пор метод VCC ограничивался применением противомикробных пептидов. Потенциально он может работать с другими противомикробными агентами, если дважды концентрированный бульон Мюллера-Хинтона инактивирует противомикробную активность агента. Метод VCC позволяет обнаружить как бактерицидную, так и бактериостатическую активность, но не позволяет различить их. Однако бактериостатическую активность можно определить количественно, измеряя разницу порогового времени между «входным» и «выходным» контролем (см. ниже).
Общая лабораторная процедура для использования в анализах VCC
[ редактировать ]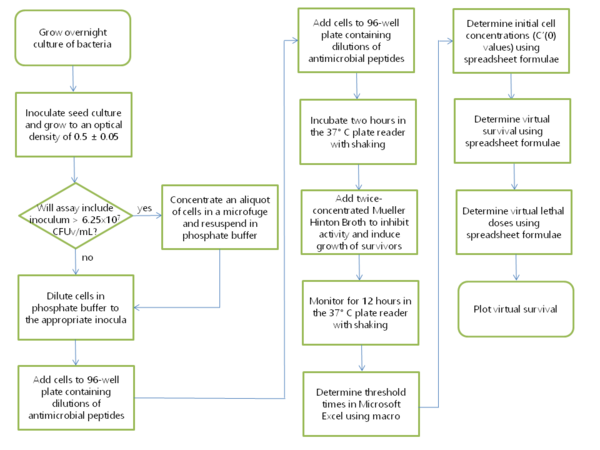
Бактериальную культуру объемом 2 мл инокулируют из одной колонии и выращивают в течение ночи в среде фосфатного Мюллера-Хинтона (PMH) или фосфатно-триптического соевого бульона Мюллера-Хинтона (PMHT). ПМГ представляет собой смесь бульона Мюллера-Хинтона и 10 мМ фосфата натрия в соотношении 1:1, pH 7,4. Можно использовать как катион-скорректированный, так и некатион-скорректированный MHB. В некоторых экспериментах в фосфатном буфере присутствовал 1% триптико-соевый бульон (TSB) для усиления активности дефензина в течение двухчасовой инкубации; в этом случае аналогичная смесь буфера и бульона в соотношении 1:1 содержала 0,5% TSB и называлась PMHT. 250 мкл этой культуры переносят в 25 мл ПМГ в одноразовой фильтрующей колбе емкостью 125 мл. Эту культуру выращивают при 37°C, встряхивая со скоростью 250 об/мин, обычно в течение 2–3 часов, пока оптическая плотность культуры при длине волны 650 нм не станет между 0,45 и 0,55. Тем временем антимикробные пептиды разбавляют на 96-луночном планшете (Costar 3595, обработанном тканевой культурой) в 10 мМ фосфате натрия, pH 7,4, так что конечный объем составляет 90 микролитров. Виртуальные колониеобразующие единицы, или CFUv, определены в оригинальной публикации VCC. [1] и его определение повторяется здесь: КОЕv поддерживалось постоянным среди шести протестированных штаммов, так что мутность и, следовательно, количество клеточных мембран в каждом эксперименте были примерно одинаковыми. Поскольку КОЕv стандартизировано по КОЕ Escherichia coli ATCC 25922, для этого штамма можно указать КОЕ, а не КОЕv. Для экспериментальной части анализа клетки разбавляют 10 мМ фосфатом натрия, pH 7,4, так, чтобы конечная концентрация клеток в 10 микролитрах составляла 5×10. 6 КОЕv/мл. 10 мкл этой клеточной суспензии вносят пипеткой под 90 мкл антимикробных пептидов в растворе, в результате чего образуется клеточная суспензия со стандартным инокулятом 5×10. 5 КОЕ(мл) при воздействии на клетки антимикробных пептидов. Несколько лунок 96-луночного планшета используются для контроля, не подвергавшегося воздействию противомикробного агента; они называются «выходными» элементами управления. Затем 96-луночный планшет инкубировали в течение двух часов в планшет-ридере, встряхивали и снимали показания каждые пять минут. В течение этого времени инкубации посевную культуру хранили на льду. Для построения калибровочной кривой 1 мл посевной культуры добавляли к 1,5 мл ПМГ после двухчасовой инкубации для получения суспензии из 10 8 КОЕv/мл. Была проведена серия 10-кратных разведений этой суспензии в диапазоне от 10 7 до 10 0 КОЕv/мл в общем объеме PMH 200 мкл, занимающем восемь лунок 96-луночного планшета. В это время клетки, не подвергавшиеся воздействию противомикробного агента, добавляли в несколько лунок планшета из культуры, хранившейся на льду; их называют «входными» контролями, поскольку они указывают количество клеток, присутствующих в начале двухчасовой инкубации. В первоначально опубликованных экспериментах VCC [1] использовали только внутренние 60 лунок планшета, поскольку испарение изменяло объем краевых лунок в течение 12-часовой инкубации. Однако все 96 лунок 96-луночного планшета можно использовать для эксперимента при условии, что край планшета обернут куском парафильма М размером шесть квадратов длиной и половиной квадрата шириной. Газопроницаемый парафильм замедляет испарение, обеспечивая при этом клеточное дыхание и предотвращая попадание твердых частиц в 96-луночный планшет в планшет-ридере. После того как планшет обернут парафильмом, его переносят из бокса биобезопасности в устройство для считывания планшетов. Несколько моделей планшет-ридеров с контролируемой температурой успешно использовались в анализах VCC, в том числе Molecular Devices Vmax, хранившийся в теплом помещении, Molecular Devices Spectramax и Tecan Infinite M1000. Устройство для считывания планшетов настроено на считывание оптической плотности при длине волны 650 нм каждые 5 минут в течение 12 часов, встряхивая перед каждым считыванием. Необработанные данные импортируются в Microsoft Excel, где запускается макрос VCC Calculate, чтобы определить время, необходимое для достижения каждой кривой роста пороговой оптической плотности 0,02.
Количественная кинетика роста
[ редактировать ]
Метод перечисления [9] выживших клеток, используемых VCC, называется количественной кинетикой роста (QGK). Он связывает кинетическое время, необходимое для достижения мутностью бактериальной периодической микробиологической культуры в лунке 96-луночного микропланшета пороговой разницы в мутности, с серией 10-кратных разбавлений калибровочных кривых роста.
Количественная оценка количества жизнеспособных клеток проводится с использованием процесса, математически идентичного количественной полимеразной цепной реакции в реальном времени (ПЦР), за исключением того, что клетки QGK , а не копии продуктов ПЦР, растут экспоненциально. Время, необходимое для достижения порога, называется «пороговым временем», T t , которое эквивалентно QPCR «времени цикла» или C t .
Существует как минимум пять процессов, которые вызывают задержки порогового времени в анализах VCC:
- Адгезия, вызывающая прилипание клеток к микропланшету и возможное образование биопленок . Если эти клетки не окажутся непосредственно на пути света, их рост не повлияет на показания оптической плотности.
- Сплоченность, заставляющая клетки объединяться в комки разного размера вместо гомогенной суспензии отдельных клеток, подвергающихся бинарному делению . Сплоченность может вызвать неточности и колебания T t . Сплоченные комки также могут быть клейкими, что приводит как к неточностям из-за когезии, так и к неточности (повышению T t ) из-за адгезии.
- Бактериостатическая активность, из-за которой клетки становятся неспособными к экспоненциальному росту, даже если они не убиты. Временная бактериостатическая активность может вызывать задержку, увеличивая T t .
- Метаболическая лаг-фаза роста бактерий . Ожидается, что такая лаг-фаза возникнет в анализе, поскольку клетки, растущие медленно или не растущие вообще во время первоначального воздействия антимикробных пептидов в буфере с низким содержанием соли, смещаются к экспоненциальному росту при добавлении дважды концентрированной богатой среды. Если эта метаболическая лаг-фаза увеличивается в присутствии антимикробного пептида, это можно рассматривать как форму временной бактериостатической активности в категории 3 выше, хотя другие источники временной бактериостатической активности, такие как задержка из-за времени, необходимого для восстановления повреждения клеточных структур, таких как клеточные стенки или клеточные мембраны . возможны
- Бактерицидное действие, или убийство. Меньшее количество выживших клеток вызывает задержку T t, поскольку выжившим требуется больше времени, чтобы произвести такое же количество мути за счет экспоненциального роста. Если все другие процессы, вызывающие увеличение T t, незначительны, анализ VCC становится бактерицидным анализом, и T t можно использовать для подсчета жизнеспособных бактерий с помощью QGK. В этом упрощенном случае результаты «виртуального выживания» VCC эквивалентны результатам «выживаемости» традиционного бактерицидного анализа подсчета колоний.
Бактерии
[ редактировать ]Первоначально VCC использовался для количественной оценки антибактериальной активности пептидов против шести штаммов Escherichia coli , Staphylococcus aureus , Bacillus cereus и Enterobacter aerogenes . [1] стандартные грамотрицательные и грамположительные штаммы контроля качества Обычно сравнивают Escherichia coli ATCC 25922 и Staphylococcus aureus . В качестве стандартных грамотрицательных и грамположительных штаммов использовали ATCC 29213 соответственно. VCC также применялся к Bacillus anthracis , возбудителю сибирской язвы . [10] Кроме того, VCC был применен к Salmonella enterica Typhimurium. серовару [11] и Acinetobacter baumannii . [12]
Антимикробные пептиды
[ редактировать ]В ходе первоначального исследования виртуального подсчета колоний измерялась активность всех шести альфа-дефенсинов человека одновременно на одном и том же 96-луночном планшете: HNP1 , HNP2 , HNP3 , HNP4 , HD5 и HD6 . [1] Впоследствии мутированные формы некоторых из этих шести дефензинов были изучены VCC. Консервативный глицин в бета-выпуклости в HNP2 был заменен серией D-аминокислот, что привело к активности VCC, пропорциональной гидрофобности и заряду боковой цепи. [13] VCC показал, что ацетилированная по N-концу и/или амидированная по C-концу активность HNP2 пропорциональна электростатическому заряду. [14] Результаты VCC снова были пропорциональны заряду для ряда мутантов, разрушающих солевой мостик, что указывает на то, что солевой мостик не необходим для функции HNP2. [15] VCC измерил важность N-концевых природных и искусственных про-сегментов пропептида HNP1 , резко изменяющих активность против Escherichia coli и Staphylococcus aureus . [16] [17] Энантиомерные формы HNP1, HNP4, HD5 и бета-дефензина 2, полностью состоящие из D-аминокислот, позволяют предположить разные механизмы активности дефенсина против грамположительных и грамотрицательных бактерий. [18] Результаты VCC для мономерных и связанных димерных форм HNP1 с нарушенной димеризацией продемонстрировали важность димеризации . [19] Замена консервативного глицина на L- аланин привела к тонким различиям VCC. [20] Комплексный аланиновый сканирующий мутагенез HNP1 [21] [22] и HD5 [23] продемонстрировали важность объемных гидрофобных остатков. Снижение дисульфида HD5 нарушало активность VCC, но усиливало активность связывания липополисахаридов против трех грамотрицательных штаммов. [11] Варианты HD5 с одной дисульфидной связью или без дисульфидных связей демонстрировали значительно сниженную активность VCC против A. baumannii , тогда как упрощенное производное HD5, созданное путем восстановления дисульфида и введения аргинина, проявляло сильную активность против штамма A. baumannii с множественной лекарственной устойчивостью . [12] Эти исследования были расширены и теперь включают дополнительные бета-дефензины , тета-дефензины , [10] и человеческий кателицидин LL-37 и родственные пептиды. [2] Результаты виртуального подсчета колоний при исследовании криптдинов мыши показали, что уничтожение E. coli криптдинами, как правило, не зависит от их третичной и четвертичной структур, которые важны для уничтожения S. aureus , что указывает на два различных механизма действия. . [24]
Эффект инокулята
[ редактировать ]Эффект инокулята был ранее описан для многих противомикробных агентов, так что агент становится менее эффективным, когда к анализу добавляется больше бактерий. [25] Этот эффект часто наблюдается при использовании бета-лактамов при анализе против бактерий, продуцирующих бета-лактамазу. Эффект инокулята потенциально имел отношение к исследованию HNP1, pro LL-37 и LL-37, которое включало как традиционный подсчет колоний, так и VCC параллельно. [2] В этом отчете было обнаружено, что традиционные значения выживаемости при подсчете колоний были меньше, чем виртуальные значения выживаемости для всех протестированных пептидов и штаммов. Поскольку инокулят бактерий в анализе VCC был в 20 раз больше по сравнению с используемым стандартизированным традиционным протоколом подсчета колоний, разница могла быть связана с эффектом инокулята, хотя эффект был бы обратным эффекту инокулята, обычно наблюдаемому при другие противомикробные средства, поскольку более высокий инокулят показал большую активность. Эта возможность была исследована в серии экспериментов VCC, в основном с упором на дефенсин HNP1 и бактериальные штаммы E. coli, S. aureus и B. cereus . Результаты шести экспериментов продемонстрировали выраженный инокулятивный эффект HNP1 против E. coli . [26]
Алгоритмы анализа кинетики количественного роста
[ редактировать ]Были опубликованы сложные электронные таблицы Microsoft Excel, используемые для расчета значений виртуальной выживаемости и виртуальной смертельной дозы, а также макрос Visual Basic, используемый для расчета порогового времени. [26]
Безопасная и эффективная техника пипетирования.
[ редактировать ]Пользователям VCC рекомендуется переносить клетки в небольшом объеме, например 10 микролитров, под больший объем, например 90 микролитров, аналогично калибровочным кривым QGK, показанным выше, и калибровочным кривым, указанным в первоначальной публикации VCC. [1] но в отличие от экспериментальной процедуры, использованной для проверки активности дефенсина в той же статье. Усовершенствованная техника пипетирования была описана в 2011 году при исследовании уровня биобезопасности 3 (BSL-3) патогена Bacillus anthracis . [10] Оригинальный метод, опубликованный в 2005 году, включал перенос 50 микролитров клеточной суспензии в 50 микролитров жидкости, что приводит к образованию пены, пузырьков и мутности, что несовместимо с турбидиметрическим методом, когда клетки переносят непосредственно на дно лунок под фосфатный буфер. решения. Чтобы избежать этой проблемы, добавляя суспензии клеток в виде капель сверху, можно вызвать образование аэрозолей , что приведет к перекрестному загрязнению. [27] Биоаэрозоли опасных бактерий также могут представлять угрозу безопасности, которую можно снизить, проводя эксперименты в боксе биобезопасности .
Ссылки
[ редактировать ]![]() Эта статья была отправлена в WikiJournal of Science на внешнюю академическую рецензию в 2019 году ( отчеты рецензентов ). Обновленный контент был реинтегрирован на страницу Википедии по лицензии CC-BY-SA-3.0 ( 2021 г. ). Проверенная версия записи:
Брайан Эриксен; и др. (16 февраля 2020 г.). «Виртуальный подсчет колоний» (PDF) . Викижурнал науки . 3 (1): 3. дои : 10.15347/WJS/2020.003 . ISSN 2470-6345 . Викиданные Q86161728 .
Эта статья была отправлена в WikiJournal of Science на внешнюю академическую рецензию в 2019 году ( отчеты рецензентов ). Обновленный контент был реинтегрирован на страницу Википедии по лицензии CC-BY-SA-3.0 ( 2021 г. ). Проверенная версия записи:
Брайан Эриксен; и др. (16 февраля 2020 г.). «Виртуальный подсчет колоний» (PDF) . Викижурнал науки . 3 (1): 3. дои : 10.15347/WJS/2020.003 . ISSN 2470-6345 . Викиданные Q86161728 .
- ^ Jump up to: а б с д и ж Эриксен Б., Ву З, Лу В., Лерер Р.И. (2005). «Антибактериальная активность и специфичность шести α-дефенсинов человека» . Антимикроб. Агенты Чематер . 49 (1): 269–75. doi : 10.1128/AAC.49.1.269-275.2005 . ПМК 538877 . ПМИД 15616305 .
- ^ Jump up to: а б с д Пазгер М., Эриксен Б., Линг М., Тот Э.А., Ши Дж., Ли Х, Галлихер-Бекли А., Лан Л., Цзоу Г., Чжан С., Юань В., Пожарски Э., Лу В. (2013). «Структурный и функциональный анализ продомена кателицидина человека, LL-37» . Биохимия . 52 (9): 1547–58. дои : 10.1021/bi301008r . ПМЦ 3634326 . ПМИД 23406372 .
- ^ Хоффманн С., Вальтер С., Блюм А.К., Фукс С., Шмидт С., Шольц А., Герлах Р.Г. (2018). «Высокопроизводительная количественная оценка взаимодействий бактериальных клеток с использованием виртуального подсчета колоний» . Передняя клетка заражает микробиол . 8 (43): 43. дои : 10.3389/fcimb.2018.00043 . ПМЦ 5818393 . ПМИД 29497603 .
- ^ Дженкинс С.Г., Шуец А.Н. (2012). «Современные концепции лабораторных исследований для определения антимикробной терапии» . Мэйо Клин Proc . 87 (3): 290–308. дои : 10.1016/j.mayocp.2012.01.007 . ПМЦ 3496983 . ПМИД 22386185 .
- ^ Йоргенсен Дж. Х., Ферраро М. Дж. (2009). «Тестирование чувствительности к противомикробным препаратам: обзор общих принципов и современной практики» . Клин Инфекционный Дис . 49 (11): 1749–55. дои : 10.1086/647952 . ПМИД 19857164 .
- ^ Жанно К., Плезиа П (2014). «Тестирование лекарственной чувствительности методом разведения». Методы и протоколы Pseudomonas . Методы Мол Биол. Том. 1149. стр. 49–58. дои : 10.1007/978-1-4939-0473-0_6 . ISBN 978-1-4939-0472-3 . ПМИД 24818896 .
- ^ Порода РС, Доттеррер WD (1916). «Допустимое количество колоний на чашках с удовлетворительным агаром» . J Бактериол . 1 (3): 321–31. дои : 10.1128/JB.1.3.321-331.1916 . ПМЦ 378655 . ПМИД 16558698 .
- ^ M07 Методы определения разведения бактерий, растущих аэробно, на чувствительность к противомикробным препаратам (PDF) . Институт клинических и лабораторных стандартов. 2018.
- ^ Брюстер, Джей Ди. (2003). «Простой анализ микророста для подсчета бактерий». J Микробиологические методы . 53 (1): 77–86. дои : 10.1016/S0167-7012(02)00226-9 . ПМИД 12609726 .
- ^ Jump up to: а б с Велкос С., Кот С.К., Хан У., Шастак О., Джедерманн Дж., Бозу Дж., Юнг Г., Ручала П., Пратикья П., Тан Т., Лерер Р.И., Бейер В. (2011). «Гуманизированные тета-дефензины (ретроциклины) улучшают работу макрофагов и защищают мышей от экспериментальных инфекций сибирской язвы» . Антимикроб. Агенты Чематер . 55 (9): 4238–50. дои : 10.1128/AAC.00267-11 . ПМК 3165295 . ПМИД 21768520 .
- ^ Jump up to: а б Ван, Чэн, Чжан, Найсин; Ван, Сюй, Ян; Чэнь, Ке; Ван, Айпин; Чэн, Тяньминь; Цзинхонг, Цзюньпин (2016). Снижение ухудшает антибактериальную активность, но улучшает способность энтерального дефенсина человека 5 Bibcode / . » « : 2016NatSR ... 622875W doi : 10.1038 . srep22875 4785407. PMID 26960718 .
- ^ Jump up to: а б Ван С, Чжао Г, Ван С, Чен Ю, Гун Ю, Чен С, Сюй Ю, Ху М, Ван Х, Цзэн Х, Ван А, Лю Д, Су Ю, Ченг Т, Чен Ф, Ван Дж (2011) . «Упрощенное производное человеческого дефенсина 5 с мощной и эффективной активностью против Acinetobacter baumannii с множественной лекарственной устойчивостью» . Антимикроб. Агенты Чематер . 62 (2): e01504-17. Бибкод : 2016NatSR...622875W . дои : 10.1038/srep22875 . ПМК 5786806 . ПМИД 29158275 .
- ^ Се С, Прал А, Эриксен Б, Ву З, Цзэн П, Ли Х, Лу Вай, Лубковски Дж, Лу В (2005). «Реконструкция консервативной бета-выпуклости в дефензинах млекопитающих с использованием D-аминокислот» . J Биол Хим . 280 (38): 32921–9. дои : 10.1074/jbc.M503084200 . ПМИД 15894545 .
- ^ Се С, Цзэн П, Эриксен Б, Ву З, Лу Вай, Лу В (2005). «Влияние концевых зарядов альфа-дефензина 2 нейтрофилов человека на его бактерицидную и мембранную активность». Пептиды . 26 (12): 2377–83. doi : 10.1016/j.peptides.2005.06.002 . ПМИД 16009464 . S2CID 8613489 .
- ^ Ву З, Ли Х, де Леу Э, Эриксен Б, Лу В (2005). «Почему солевой мостик Arg5-Glu13 сохраняется в альфа-дефенсинах млекопитающих?» . J Биол Хим . 280 (52): 43039–47. дои : 10.1074/jbc.M510562200 . ПМИД 16246847 .
- ^ Ву З, Ли Х, Эриксен Б, де Леу Э, Цзоу Г, Цзэн П, Се С, Ли С, Лубковски Дж, Лу WY, Лу В (2007). «Влияние про-сегментов на сворачивание и функцию альфа-дефенсинов нейтрофилов человека» . Дж Мол Биол . 368 (2): 537–49. дои : 10.1016/j.jmb.2007.02.040 . ПМЦ 2754399 . ПМИД 17355880 .
- ^ Зоу Г, де Леу Э, Лубковски Дж, Лу В (2008). «Молекулярные детерминанты взаимодействия альфа-дефенсина 1 нейтрофилов человека с его пропептидом» . Дж Мол Биол . 381 (5): 1281–91. дои : 10.1016/j.jmb.2008.06.066 . ПМЦ 2754386 . ПМИД 18616948 .
- ^ Вэй Г., де Леу Э., Пазгер М., Юань В., Цзоу Г., Ван Дж., Эриксен Б., Лу В.И., Лерер Р.И., Лу В. (2009). «Сквозь зазеркалье: механистические открытия энантиомерных дефенсинов человека» . J Биол Хим . 284 (42): 29180–92. дои : 10.1074/jbc.M109.018085 . ПМЦ 2781462 . ПМИД 19640840 .
- ^ Пазгер М., Вей Г., Эриксен Б., Юнг Г., Ву З, де Леу Э., Юань В., Шмацински Х., Лу В.И., Лубковски Дж., Лерер Р.И., Лу В. (2012). «Иногда для танго нужны двое: вклад димеризации в функции человеческого пептида альфа-дефензина HNP1» . J Биол Хим . 287 (12): 8944–53. дои : 10.1074/jbc.M111.332205 . ПМК 3308808 . ПМИД 22270360 .
- ^ Чжао Л., Эриксен Б., Ву Х, Чжан С., Юань В., Ли Х., Пазгер М., Лу В. (2012). «Инвариантный остаток gly важен для сворачивания, димеризации и функции α-дефензина: тематическое исследование нейтрофильного α-дефенсина HNP1» . J Биол Хим . 287 (23): 18900–12. дои : 10.1074/jbc.M112.355255 . ПМЦ 3365925 . ПМИД 22496447 .
- ^ Вэй Г., Пазгер М., де Леу Э., Раджаби М., Ли Дж., Цзоу Г., Юнг Г., Юань В., Лу В.И., Лерер Р.И., Лу В. (2010). «Trp-26 придает функциональную универсальность альфа-дефензину человека HNP1» . J Биол Хим . 285 (21): 16275–85. дои : 10.1074/jbc.M110.102749 . ПМЦ 2871495 . ПМИД 20220136 .
- ^ Чжао Л., Толберт В.Д., Эриксен Б., Чжан С., Ву Х, Юань В., Ли Х., Пазгер М., Лу В. (2013). «Одиночные, двойные и четверные замены аланина на олигомерных интерфейсах определяют гидрофобность как ключевой фактор, определяющий функцию альфа-дефенсина HNP1 нейтрофилов человека» . ПЛОС ОДИН . 8 (11): е78937. Бибкод : 2013PLoSO...878937Z . дои : 10.1371/journal.pone.0078937 . ПМЦ 3827289 . ПМИД 24236072 .
- ^ Раджаби М, Эриксен Б, Ву X, де Леу Э, Чжао Л, Пазгер М, Лу В (2012). «Функциональные детерминанты кишечного α-дефенсина HD5 человека: решающая роль в гидрофобности на границе раздела димеров» . J Биол Хим . 287 (26): 21615–27. дои : 10.1074/jbc.M112.367995 . ПМЦ 3381126 . ПМИД 22573326 .
- ^ Ван Ц, Ян Й, Луо Г, Чжоу Й, Толберт В.Д., Пазгер М., Ляо С., Лу В (2023). «Мышиные α-дефензины: структурный и функциональный анализ 17 изоформ криптдина, идентифицированных из одной криптины еюнала» . Заразить иммунитет . 91 (1): e0036122. дои : 10.1128/iai.00361-22 . ПМЦ 9872612 . ПМИД 36472443 .
- ^ Брук I (1989). «Инокулятивный эффект». Преподобный Заразить Дис . 11 (3): 361–8. дои : 10.1093/clinids/11.3.361 . ПМИД 2664999 .
- ^ Jump up to: а б Эриксен Б. и др. (2020). «Виртуальный подсчет колоний» . Викижурнал науки . 3 (1): 3. doi : 10.15347/wjs/2020.003 .
- ^ Эриксен Б. (2014). «Безопасность, эффективность и полезность методов переноса клейких и когезивных клеток Escherichia coli на микропланшеты во избежание аэрозолей» . F1000Рес . 3 : 267. doi : 10.12688/f1000research.5659.2 . ПМК 4309163 . ПМИД 25671086 .