Кателицидин противомикробный пептид
| кателицидин | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | кателицидины | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Генные карты : [1] ; ОМА : - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Кателицидин противомикробный пептид (CAMP) представляет собой противомикробный пептид. кодируемый у человека геном CAMP . [ 1 ] Активная форма — LL-37 . У людей CAMP кодирует пептид-предшественник CAP-18 (18 кДа), который процессируется внеклеточным расщеплением, опосредованным протеиназой 3, до активной формы LL-37. [ 2 ] [ 1 ]
Семейство кателицидинов включает 30 типов, из которых LL-37 является единственным кателицидином у человека. [ 3 ] Кателицидины хранятся в секреторных гранулах нейтрофилов и макрофагов и могут высвобождаться после активации лейкоцитами. [ 4 ] Пептиды кателицидина представляют собой молекулы двойной природы, называемые амфифилами : один конец молекулы притягивается к воде и отталкивается жирами и белками, а другой конец притягивается к жиру и белкам и отталкивается водой. Члены этого семейства реагируют на патогены, разрушая, повреждая или прокалывая клеточные мембраны.
Таким образом, кателицидины играют решающую роль во врожденной иммунной защите млекопитающих против инвазивной бактериальной инфекции. [ 5 ] Пептиды семейства кателицидинов классифицируются как антимикробные пептиды (АМП). Семейство AMP также включает дефензины . Хотя дефензины имеют общие структурные особенности, пептиды, родственные кателицидину, весьма гетерогенны. [ 5 ] Члены семейства кателицидиновых антимикробных полипептидов характеризуются высококонсервативной областью (доменом кателицидина) и высоковариабельным пептидным доменом кателицидина. [ 5 ]
Пептиды кателицидина были выделены из многих различных видов млекопитающих , включая сумчатых. [ 6 ] Кателицидины в основном обнаруживаются в нейтрофилах , моноцитах , тучных клетках , дендритных клетках и макрофагах. [ 7 ] после активации бактериями, вирусами, грибками, паразитами или гормоном 1,25-D , который является гормонально активной формой витамина D. [ 8 ] Они были обнаружены в некоторых других клетках, включая эпителиальные клетки и кератиноциты человека . [ 9 ]
Этимология
[ редактировать ]Термин был придуман в 1995 году от кателина из-за характерного кателиноподобного домена, присутствующего в кателицидинах. [ 10 ] Само название кателин происходит от катепсина L ингибитора в 1989 году. [ 11 ]
Механизм антимикробной активности
[ редактировать ]Общее правило механизма, запускающего действие кателицидина, как и других антимикробных пептидов, включает дезинтеграцию (повреждение и прокалывание) клеточных мембран организмов, по отношению к которым пептид активен. [ 4 ]
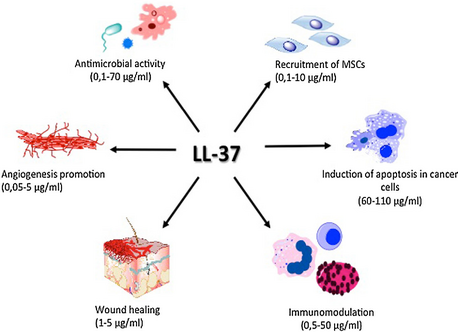
Кателицидины быстро разрушают липопротеиновые мембраны микробов, окутанные фагосомами, слияния с лизосомами макрофагов после . Следовательно, LL-37 может ингибировать образование бактериальных биопленок . [ 12 ]
Другая деятельность
[ редактировать ]LL-37 играет роль в активации пролиферации и миграции клеток, способствуя процессу закрытия раны. [ 13 ] Все эти механизмы в совокупности играют существенную роль в тканевом гомеостазе и регенеративных процессах. Более того, он оказывает агонистическое действие на различные плейотропные рецепторы, например, на рецептор формилпептида-1 (FPRL-1), [ 14 ] пуринергический рецептор P2X 7, рецептор эпидермального фактора роста (EGFR) [ 15 ] или рецептор инсулиноподобного фактора роста-1 (IGF-1R). [ 16 ]
Кроме того, он индуцирует ангиогенез. [ 17 ] и регулирует апоптоз. [ 18 ]
Характеристики
[ редактировать ]Кателицидины имеют размер от 12 до 80 аминокислотных остатков и имеют широкий спектр структур. [ 19 ] Большинство кателицидинов представляют собой линейные пептиды с 23–37 аминокислотными остатками, сворачивающиеся в амфипатические α-спирали . Кроме того, кателицидины могут также представлять собой молекулы небольшого размера (12-18 остатков) со структурой бета-шпильки, стабилизированные одной или двумя дисульфидными связями. Присутствуют также более крупные кателицидиновые пептиды (39–80 аминокислотных остатков). Эти более крупные кателицидины демонстрируют повторяющиеся пролиновые мотивы, образующие расширенные полипролинового типа. структуры [ 5 ]
В 1995 году Гудмундссон и др. предположили, что активный противомикробный пептид состоит из С-концевого домена из 39 остатков (названного FALL-39). Однако только год спустя было заявлено, что созревший AMP, теперь называемый LL-37, на самом деле на две аминокислоты короче, чем FALL-39. [ 20 ] [ 21 ]
Семейство кателицидинов имеет гомологию первичной последовательности с цистатином. [ 22 ] семейство ингибиторов цистеиновых протеиназ, хотя аминокислотные остатки, которые считаются важными для такого ингибирования протеаз, обычно отсутствуют.
Нечеловеческие ортологи
[ редактировать ]Пептиды кателицидина были обнаружены у людей, обезьян, мышей, крыс, кроликов, морских свинок, панд, свиней, крупного рогатого скота, лягушек, овец, коз, кур, лошадей и валлаби. [ 23 ] Антитела к LL-37/hCAP-18 человека были использованы для обнаружения кателицидиноподобных соединений у сумчатых. [ 24 ] У млекопитающих описано около 30 членов семейства кателицидинов, и только один (LL-37) обнаружен у человека. [ 4 ] В настоящее время идентифицированные кателицидиновые пептиды включают следующие: [ 5 ]
- Человек: hCAP-18 (расщепленный до LL-37).
- Макак-резус: RL-37
- Мыши: CRAMP-1/2 (антимикробный пептид, родственный кателицидину). [ 25 ]
- Крысы: судорога
- Кролики: CAP-18
- Морская свинка: CAP-11
- Свиньи: ПР-39, Профенин, ПМАП-23,36,37.
- Крупный рогатый скот: BMAP-27,28,34 (бычьи миелоидные антимикробные пептиды); Бак5, Бак7
- Лягушки: кателицидин-AL (обнаружен у Amolops loloensis ). [ 26 ]
- Куры: четыре кателицидина, фаулицидины 1,2,3 и кателицидин Бета-1. [ 27 ]
- Тасманийский дьявол: Саха-CATH5 [ 28 ]
- Лососевые: CATH1 и CATH2.
Клиническое значение
[ редактировать ]У пациентов с розацеа повышен уровень кателицидина и повышенный уровень триптических ферментов рогового слоя (SCTE). Кателицидин расщепляется до антимикробного пептида LL-37 сериновыми протеазами калликреина 5 и калликреина 7 . Предполагается, что избыточное производство LL-37 является одной из причин всех подтипов розацеа . [ 29 ] В прошлом для лечения розацеа использовались антибиотики, но антибиотики могут работать только потому, что они ингибируют некоторые SCTE. [ 30 ]
Более низкие уровни человеческого антимикробного белка кателицидина ( hCAP18 ) в плазме крови, по-видимому, значительно увеличивают риск смерти от инфекции у пациентов, находящихся на диализе . [ 31 ] регулируется витамином D. Производство кателицидина [ 32 ] [ 33 ]
SAAP-148 ( пептид . ) представляет собой синтетический антимикробный пептид и антибиопленочный модифицированную версию LL-37, обладающую повышенной антимикробной активностью по сравнению с LL-37 В частности, SAAP-148 был более эффективен в уничтожении бактерий в физиологических условиях. [ 34 ] Кроме того, SAAP-148 действует синергично с перепрофилированным антибиотиком галицином против устойчивых к антибиотикам бактерий и биопленок. [ 35 ]
Считается, что LL-37 играет роль в патогенезе псориаза (наряду с другими антимикробными пептидами). При псориазе поврежденные кератиноциты выделяют LL-37, который образует комплексы с собственным генетическим материалом (ДНК или РНК) из других клеток. Эти комплексы стимулируют дендритные клетки (тип антигенпредставляющих клеток), которые затем выделяют интерфероны α и β, что способствует дифференцировке Т-клеток и продолжению воспаления. [ 36 ] Также было обнаружено, что LL-37 является распространенным аутоантигеном при псориазе; Т-клетки, специфичные для LL-37, были обнаружены в крови и коже у двух третей пациентов с псориазом средней и тяжелой степени. [ 36 ]
LL-37 связывается с пептидом Ab, который связан с болезнью Альцгеймера. Дисбаланс между LL-37 и Ab может быть фактором, влияющим на фибриллы и бляшки, связанные с AD. Хронические оральные инфекции, вызванные Porphyromonas gingivalis и герпесвирусом (HSV-1), могут способствовать прогрессированию деменции при болезни Альцгеймера. [ 37 ] [ 38 ]
Приложения
[ редактировать ]Исследования семейства AMP, особенно механизма их действия, продолжаются уже почти 20 лет. Несмотря на устойчивый интерес, методы лечения, созданные или использующие АМП, не получили широкого распространения для клинического применения по нескольким причинам. [ 39 ] Во-первых, кандидаты в лекарства из AMP имеют узкое окно биодоступности, поскольку пептиды быстро расщепляются протеазами. Во-вторых, производство пептидных препаратов обходится дороже, чем низкомолекулярных лекарств, что проблематично, поскольку пептидные препараты необходимо назначать в больших дозах, чтобы противостоять быстрому ферментативному распаду. Эти качества также ограничивают пути введения, обычно это инъекции, инфузии или терапия с медленным высвобождением. [ 40 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б «ЮниПрот» . www.uniprot.org . Проверено 8 февраля 2024 г.
- ^ «Ген Энтреза: антимикробный пептид кателицидина CAMP» .
- ^ Дюрр У, Судхендра У, Рамамурти, А. (сентябрь 2006 г.). «LL-37, единственный человеческий представитель семейства антимикробных пептидов кателицидинов» . Biochimica et Biophysical Acta (BBA) – Биомембраны . 1758 (9): 1408–1425. дои : 10.1016/j.bbamem.2006.03.030 . ПМИД 16716248 .
- ^ Перейти обратно: а б с Костючук Е.М., Лисовский П., Ярчак Дж., Стшалковска Н., Йожвик А., Хорбаньчук Ю. и др. (декабрь 2012 г.). «Кателицидины: семейство антимикробных пептидов. Обзор» . Отчеты по молекулярной биологии . 39 (12): 10957–70. дои : 10.1007/s11033-012-1997-x . ПМК 3487008 . ПМИД 23065264 .
- ^ Перейти обратно: а б с д и Занетти М. (январь 2004 г.). «Кателицидины, многофункциональные пептиды врожденного иммунитета». Журнал биологии лейкоцитов . 75 (1): 39–48. дои : 10.1189/jlb.0403147 . ПМИД 12960280 . S2CID 14902156 .
- ^ Карман Р., Симонян М.Р., Олд Дж.М., Жак Н.А., Дин Э.М. (2008). Иммуногистохимия с использованием антител к кателицидину LL37/hCAP18 у валлаби таммара ( Macropus eugenii ). Ткань и клетка. 40(6), 459-466. DOI: 10.1016/j.tice.2008.05.002
- ^ Вандам Д., Ландуит Б., Люйтен В., Шуфс Л. (ноябрь 2012 г.). «Полное описание LL-37, фактического пептида кателицидина человека». Клеточная иммунология . 280 (1): 22–35. дои : 10.1016/j.cellimm.2012.11.009 . ПМИД 23246832 .
- ^ Лю П.Т., Стенгер С., Ли Х., Венцель Л., Тан Б.Х., Круцик С.Р. и др. (март 2006 г.). «Толл-подобный рецептор, запускающий антимикробную реакцию человека, опосредованную витамином D». Наука . 311 (5768): 1770–3. Бибкод : 2006Sci...311.1770L . дои : 10.1126/science.1123933 . ПМИД 16497887 . S2CID 52869005 .
- ^ Балс Р., Ван Х, Заслов М., Уилсон Дж. М. (август 1998 г.). «Пептидный антибиотик LL-37/hCAP-18 экспрессируется в эпителии легких человека, где он обладает широкой антимикробной активностью на поверхности дыхательных путей» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (16): 9541–6. Бибкод : 1998PNAS...95.9541B . дои : 10.1073/pnas.95.16.9541 . ПМК 21374 . ПМИД 9689116 .
- ^ Занетти М., Дженнаро Р., Ромео Д. (октябрь 1995 г.). «Кателицидины: новое семейство белков с общей прообластью и вариабельным С-концевым антимикробным доменом». Письма ФЭБС . 374 (1): 1–5. дои : 10.1016/0014-5793(95)01050-о . ПМИД 7589491 . S2CID 34865828 .
- ^ Ритонья А., Копитар М., Джерала Р., Тёрк В. (сентябрь 1989 г.). «Первичная структура нового ингибитора цистеиновой протеиназы из лейкоцитов свиньи» . Письма ФЭБС . 255 (2): 211–4. дои : 10.1016/0014-5793(89)81093-2 . ПМИД 2792375 .
- ^ Дослер С., Карааслан Э. (декабрь 2014 г.). «Ингибирование и разрушение биопленок Pseudomonas aeruginosa антибиотиками и антимикробными пептидами». Пептиды . 62 : 32–7. doi : 10.1016/j.peptides.2014.09.021 . ПМИД 25285879 . S2CID 207359996 .
- ^ Шайхиев Р., Байсвенгер С., Кендлер К., Сенске Дж., Пюхнер А., Дамм Т. и др. (ноябрь 2005 г.). «Человеческий эндогенный антибиотик LL-37 стимулирует пролиферацию эпителиальных клеток дыхательных путей и закрытие ран». Американский журнал физиологии. Клеточная и молекулярная физиология легких . 289 (5): L842-8. дои : 10.1152/ajplung.00286.2004 . ПМИД 15964896 .
- ^ Чен К., Шмидт А.П., Андерсон Г.М., Ван Дж.М., Вутерс Дж., Оппенгейм Дж.Дж., Чертов О. (октябрь 2000 г.). «LL-37, кателицидин, полученный из нейтрофильных гранул и эпителиальных клеток, использует рецептор формилпептида, подобный 1 (FPRL1), в качестве рецептора для хемоаттракта нейтрофилов периферической крови человека, моноцитов и Т-клеток» . Журнал экспериментальной медицины . 192 (7): 1069–74. дои : 10.1084/jem.192.7.1069 . ПМК 2193321 . ПМИД 11015447 .
- ^ фон Хауссен Дж., Кочулла Р., Шайхиев Р., Герр С., Пинкенбург О., Реймер Д. и др. (январь 2008 г.). «Защитный пептид хозяина LL-37/hCAP-18 является фактором роста клеток рака легких». Рак легких . 59 (1): 12–23. дои : 10.1016/j.lungcan.2007.07.014 . ПМИД 17764778 .
- ^ Гирнита А, Чжэн Х, Грёнберг А, Гирнита Л, Столе М (январь 2012 г.). «Идентификация кателицидинового пептида LL-37 как агониста рецептора инсулиноподобного фактора роста I типа» . Онкоген . 31 (3): 352–65. дои : 10.1038/onc.2011.239 . ПМК 3262900 . ПМИД 21685939 . (Отозвано, см. два : 10.1038/s41388-022-02567-5 , ПМИД 36494433 )
- ^ Кочулла Р., фон Дегенфельд Г., Купатт С., Крёц Ф., Залер С., Гло Т. и др. (июнь 2003 г.). «Ангиогенная роль человеческого пептидного антибиотика LL-37/hCAP-18» . Журнал клинических исследований . 111 (11): 1665–72. дои : 10.1172/JCI17545 . ПМК 156109 . ПМИД 12782669 .
- ^ Рен С.С., Шен Дж., Ченг А.С., Лу Л., Чан Р.Л., Ли З.Дж. и др. (20 мая 2013 г.). Не Д. (ред.). «FK-16, полученный из противоракового пептида LL-37, индуцирует каспазо-независимый апоптоз и аутофагическую гибель клеток в клетках рака толстой кишки» . ПЛОС ОДИН . 8 (5): e63641. Бибкод : 2013PLoSO...863641R . дои : 10.1371/journal.pone.0063641 . ПМЦ 3659029 . ПМИД 23700428 .
- ^ Дженнаро Р., Занетти М. (2000). «Структурные особенности и биологическая активность антимикробных пептидов, производных кателицидина». Биополимеры . 55 (1): 31–49. doi : 10.1002/1097-0282(2000)55:1<31::AID-BIP40>3.0.CO;2-9 . ПМИД 10931440 .
- ^ Агерберт Б., Ганне Х., Одеберг Дж., Когнер П., Боман Х.Г., Гудмундссон Г.Х. (январь 1995 г.). «FALL-39, предполагаемый человеческий пептидный антибиотик, не содержит цистеина и экспрессируется в костном мозге и семенниках» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (1): 195–9. Бибкод : 1995ПНАС...92..195А . дои : 10.1073/pnas.92.1.195 . ПМК 42844 . ПМИД 7529412 .
- ^ Гудмундссон Г.Х., Агерберт Б., Одеберг Дж., Бергман Т., Олссон Б., Сальседо Р. (июнь 1996 г.). «Человеческий ген FALL39 и процессинг предшественника кателина антибактериального пептида LL-37 в гранулоцитах» . Европейский журнал биохимии . 238 (2): 325–32. дои : 10.1111/j.1432-1033.1996.0325z.x . ПМИД 8681941 .
- ^ Зайу М., Низет В., Галло Р.Л. (май 2003 г.). «Антимикробные и ингибирующие протеазы функции пропоследовательности кателицидина человека (hCAP18/LL-37)» . Журнал исследовательской дерматологии . 120 (5): 810–6. дои : 10.1046/j.1523-1747.2003.12132.x . ПМИД 12713586 .
- ^ Карман Р.Л., Олд Дж.М., Бейкер М., Жак Н.А., Дин Э.М. (2009). Идентификация и экспрессия нового сумчатого кателицидина из таммарского валлаби ( Macropus eugenii ). Ветеринарная иммунология и иммунопатология. 127(3-4), 269-276. DOI: 10.1016/j.vetimm.2008.10.319
- ^ Карман Р.Л., Симонян М.Р., Олд Дж.М., Жак Н.А., Дин Э.М. (декабрь 2008 г.). «Иммуногистохимия с использованием антител к кателицидину LL37/hCAP18 у валлаби таммара Macropus eugenii». Ткани и клетки . 40 (6): 459–466. doi : 10.1016/j.tice.2008.05.002 . ПМИД 18597803 .
- ^ Галло Р.Л., Ким К.Дж., Бернфилд М., Козак К.А., Занетти М., Мерлуцци Л., Дженнаро Р. (май 1997 г.). «Идентификация CRAMP, антимикробного пептида, связанного с кателином, экспрессируемого у эмбрионов и взрослых мышей» . Журнал биологической химии . 272 (20): 13088–93. дои : 10.1074/jbc.272.20.13088 . ПМИД 9148921 .
- ^ Хао X, Ян Х, Вэй Л, Ян С, Чжу В, Ма Д, Ю Х, Лай Р (август 2012 г.). «Кателицидин амфибий заполняет эволюционный пробел кателицидина у позвоночных». Аминокислоты . 43 (2): 677–85. дои : 10.1007/s00726-011-1116-7 . ПМИД 22009138 . S2CID 2794908 .
- ^ Ачанта М., Сункара Л.Т., Дай Г., Бомминени Ю.Р., Цзян В., Чжан Г. (май 2012 г.). «Тканевая экспрессия и регуляция развития антимикробных пептидов кателицидина курицы» . Журнал зоотехники и биотехнологии . 3 (1): 15. дои : 10.1186/2049-1891-3-15 . ПМЦ 3436658 . ПМИД 22958518 .
- ^ Пил Э., Ченг Ю., Джорджевич Дж.Т., Фокс С., Соррелл Т.К., Белов К. (октябрь 2016 г.). «Кателицидины у тасманского дьявола (Sarcophilus harrisii)» . Научные отчеты . 6 : 35019. Бибкод : 2016NatSR...635019P . дои : 10.1038/srep35019 . ПМК 5057115 . ПМИД 27725697 .
- ^ Рейнхольц М., Ружичка Т., Шаубер Дж. (май 2012 г.). «Кателицидин LL-37: антимикробный пептид, играющий роль в воспалительных заболеваниях кожи» . Анналы дерматологии . 24 (2): 126–35. дои : 10.5021/ad.2012.24.2.126 . ПМК 3346901 . ПМИД 22577261 .
- ^ Ямасаки К., Ди Нардо А., Бардан А., Мураками М., Отаке Т., Кода А., Доршнер Р.А., Боннарт С., Дескарг П., Овнанян А., Морэнн В.Б., Галло Р.Л. (август 2007 г.). «Повышенная активность сериновой протеазы и кателицидин способствуют воспалению кожи при розацеа». Природная медицина . 13 (8): 975–80. дои : 10.1038/nm1616 . ПМИД 17676051 . S2CID 23470611 .
- ^ Гомбарт А.Ф., Бхан И., Боррегаард Н., Тамез Х., Камарго К.А., Кеффлер Х.П., Тадхани Р. (февраль 2009 г.). «Низкий уровень антимикробного пептида кателицидина (hCAP18) в плазме предсказывает повышенную смертность от инфекционных заболеваний у пациентов, находящихся на гемодиализе» . Клинические инфекционные болезни . 48 (4): 418–24. дои : 10.1086/596314 . ПМК 6944311 . ПМИД 19133797 .
- ^ Заслов М. (январь 2002 г.). «Антимикробные пептиды многоклеточных организмов». Природа . 415 (6870): 389–95. Бибкод : 2002Natur.415..389Z . дои : 10.1038/415389а . ПМИД 11807545 . S2CID 205028607 .
- ^ Камен Д.Л., Тангприча В. (май 2010 г.). «Витамин D и молекулярное действие на иммунную систему: модуляция врожденного и аутоиммунитета» . Журнал молекулярной медицины . 88 (5): 441–50. дои : 10.1007/s00109-010-0590-9 . ПМЦ 2861286 . ПМИД 20119827 .
- ^ де Брей А., Риол М., Кордфанке Р.А., Маланович Н., де Бур Л., Конинг Р.И. и др. (январь 2018 г.). «Антимикробный пептид SAAP-148 борется с лекарственно-устойчивыми бактериями и биопленками» . Наука трансляционной медицины . 10 (423): eaan4044. doi : 10.1126/scitranslmed.aan4044 . ПМИД 29321257 .
- ^ ван Гент М.Э., ван дер Рейден Т.Дж., Леннард П.Р., де Виссер А.В., Шонкерен-Равенсберген Б., Долезал Н. и др. (май 2022 г.). «Синергизм между синтетическим антибактериальным и антибиопленочным пептидом (SAAP)-148 и галицином» . Антибиотики . 11 (5): 673. doi : 10.3390/ANTIBIOTICS11050673 . ПМЦ 9137631 . ПМИД 35625317 .
- ^ Перейти обратно: а б Рендон А., Шекель К. (март 2019 г.). «Патогенез и лечение псориаза» . Международный журнал молекулярных наук . 20 (6): 1475. doi : 10.3390/ijms20061475 . ПМК 6471628 . ПМИД 30909615 .
- ^ Канагасингам С., Чуккапалли СС, Уэлбери Р., Сингхрао СК (декабрь 2020 г.). « Porphyromonas gingivalis является сильным фактором риска болезни Альцгеймера» . Журнал отчетов о болезни Альцгеймера . 4 (1): 501–511. дои : 10.3233/ДОПОГ-200250 . ПМЦ 7835991 . ПМИД 33532698 .
- ^ Риццо Р. (июнь 2020 г.). Шпиндлер КР (ред.). «Спорная роль герпесвирусов в болезни Альцгеймера» . ПЛОС Патогены . 16 (6): e1008575. дои : 10.1371/journal.ppat.1008575 . ПМК 7302436 . ПМИД 32555685 .
- ^ «Биомиметические исследования из лаборатории Бэррона» . веб-сайт Stanford.edu . Проверено 22 октября 2021 г.
- ^ ДеПальма А (30 июня 2015 г.). «Пептиды: новые процессы, снижение затрат» . GEN – Новости генной инженерии и биотехнологии . Проверено 30 ноября 2021 г.
Дальнейшее чтение
[ редактировать ]- Дюрр У.Х., Судхендра США, Рамамурти А. (сентябрь 2006 г.). «LL-37, единственный человеческий представитель семейства антимикробных пептидов кателицидинов» . Biochimica et Biophysical Acta (BBA) – Биомембраны . 1758 (9): 1408–25. дои : 10.1016/j.bbamem.2006.03.030 . ПМИД 16716248 .
- Хромек М., Сламова З., Бергман П., Ковач Л., Подрачка Л., Эрен И., Хёкфельт Т., Гудмундссон Г.Х., Галло Р.Л., Агерберт Б., Браунер А. (июнь 2006 г.). «Противомикробный пептид кателицидин защищает мочевыводящие пути от инвазивной бактериальной инфекции». Природная медицина . 12 (6): 636–41. дои : 10.1038/nm1407 . ПМИД 16751768 . S2CID 20704807 .
- Гомбарт А.Ф., Боррегаард Н., Кеффлер Х.П. (июль 2005 г.). «Ген человеческого антимикробного пептида кателицидина (CAMP) является прямой мишенью рецептора витамина D и сильно регулируется в миелоидных клетках с помощью 1,25-дигидроксивитамина D3» . Журнал ФАСЭБ . 19 (9): 1067–77. дои : 10.1096/fj.04-3284com . ПМИД 15985530 . S2CID 7563259 .
- Лопес-Гарсия Б., Ли П.Х., Галло Р.Л. (май 2006 г.). «Экспрессия и потенциальная функция антимикробных пептидов кателицидина при дерматофитии и разноцветном лишае» . Журнал антимикробной химиотерапии . 57 (5): 877–82. дои : 10.1093/jac/dkl078 . ПМИД 16556635 .
- Лерер Р.И., Ганц Т. (январь 2002 г.). «Кателицидины: семейство эндогенных антимикробных пептидов». Современное мнение в гематологии . 9 (1): 18–22. дои : 10.1097/00062752-200201000-00004 . ПМИД 11753073 . S2CID 23575052 .
- Ниёнсаба Ф, Хирата М, Огава Х, Нагаока И (сентябрь 2003 г.). «Антибактериальные пептиды, полученные из эпителиальных клеток, бета-дефенсины человека и кателицидин: многофункциональное действие на тучные клетки». Текущие цели по борьбе с наркотиками. Воспаление и аллергия . 2 (3): 224–31. дои : 10.2174/1568010033484115 . ПМИД 14561157 .
- ван Ветеринг С., Тьябринга Г.С., Химстра П.С. (апрель 2005 г.). «Взаимодействие между антимикробными пептидами нейтрофильного происхождения и эпителиальными клетками дыхательных путей». Журнал биологии лейкоцитов . 77 (4): 444–50. дои : 10.1189/jlb.0604367 . ПМИД 15591123 . S2CID 8261526 .
- Коуленд Дж.Б., Джонсен А.Х., Боррегаард Н. (июль 1995 г.). «hCAP-18, кателин/про-бактенецин-подобный белок специфичных для нейтрофилов гранул человека» . Письма ФЭБС . 368 (1): 173–6. дои : 10.1016/0014-5793(95)00634-L . ПМИД 7615076 . S2CID 3172761 .
- Гудмундссон Г.Х., Магнуссон К.П., Чоудхари Б.П., Йоханссон М., Андерссон Л., Боман Х.Г. (июль 1995 г.). «Структура гена свиного пептидного антибиотика PR-39, члена семейства генов кателина: сравнительное картирование локуса человеческого пептидного антибиотика FALL-39» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (15): 7085–9. Бибкод : 1995PNAS...92.7085G . дои : 10.1073/pnas.92.15.7085 . ПМК 41476 . ПМИД 7624374 .
- Ларрик Дж.В., Хирата М., Балинт Р.Ф., Ли Дж., Чжун Дж., Райт С.К. (апрель 1995 г.). «Человеческий CAP18: новый противомикробный липополисахарид-связывающий белок» . Инфекция и иммунитет . 63 (4): 1291–7. дои : 10.1128/IAI.63.4.1291-1297.1995 . ПМК 173149 . ПМИД 7890387 .
- Ларрик Дж.В., Ли Дж., Ма С., Ли Х, Франк У., Райт С.К., Балинт Р.Ф. (ноябрь 1996 г.). «Структурный, функциональный анализ и локализация гена CAP18 человека» . Письма ФЭБС . 398 (1): 74–80. дои : 10.1016/S0014-5793(96)01199-4 . ПМИД 8946956 . S2CID 35329283 .
- Фром М., Агерберт Б., Ахангари Г., Стале-Бекдал М., Лиден С., Вигцелль Х., Гудмундссон Г.Х. (июнь 1997 г.). «Экспрессия гена, кодирующего антибактериальный пептид LL-37, индуцируется в кератиноцитах человека во время воспалительных заболеваний» . Журнал биологической химии . 272 (24): 15258–63. дои : 10.1074/jbc.272.24.15258 . ПМИД 9182550 .
- Балс Р., Ван Х, Заслов М., Уилсон Дж. М. (август 1998 г.). «Пептидный антибиотик LL-37/hCAP-18 экспрессируется в эпителии легких человека, где он обладает широкой антимикробной активностью на поверхности дыхательных путей» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (16): 9541–6. Бибкод : 1998PNAS...95.9541B . дои : 10.1073/pnas.95.16.9541 . ПМК 21374 . ПМИД 9689116 .
- Чен К., Шмидт А.П., Андерсон Г.М., Ван Дж.М., Вутерс Дж., Оппенгейм Дж.Дж., Чертов О. (октябрь 2000 г.). «LL-37, кателицидин, полученный из нейтрофильных гранул и эпителиальных клеток, использует рецептор формилпептида, подобный 1 (FPRL1), в качестве рецептора для хемоаттракта нейтрофилов периферической крови человека, моноцитов и Т-клеток» . Журнал экспериментальной медицины . 192 (7): 1069–74. дои : 10.1084/jem.192.7.1069 . ПМК 2193321 . ПМИД 11015447 .
- Агерберт Б., Чаро Дж., Верр Дж., Олссон Б., Идали Ф., Линдбом Л., Кисслинг Р., Йорнвалль Х., Вигцелль Х., Гудмундссон Г.Х. (ноябрь 2000 г.). «Человеческие антимикробные и хемотаксические пептиды LL-37 и альфа-дефенсины экспрессируются специфическими популяциями лимфоцитов и моноцитов». Кровь . 96 (9): 3086–93. дои : 10.1182/blood.V96.9.3086 . ПМИД 11049988 .
- Балс Р., Ланг С., Вайнер Д.Д., Фогельмайер С., Уэлш У., Уилсон Дж.М. (март 2001 г.). «Антимикробные пептиды слизистой оболочки макаки-резуса (Macaca mulatta) являются близкими гомологами молекул человека» . Клинико-диагностическая лаборатория иммунологии . 8 (2): 370–5. doi : 10.1128/CDLI.8.2.370-375.2001 . ПМК 96065 . ПМИД 11238224 .
- Нагаока И., Хирота С., Ниёнсаба Ф., Хирата М., Адачи Ю., Тамура Х., Хойманн Д. (сентябрь 2001 г.). «Семейство кателицидиновых антибактериальных пептидов CAP18 и CAP11 ингибирует экспрессию TNF-альфа, блокируя связывание LPS с клетками CD14 (+)» . Журнал иммунологии . 167 (6): 3329–38. дои : 10.4049/jimmunol.167.6.3329 . ПМИД 11544322 .
- Хасе К., Экманн Л., Леопард Дж.Д., Варки Н., Кагнофф М.Ф. (февраль 2002 г.). «Дифференцировка клеток является ключевым фактором, определяющим экспрессию кателицидина LL-37/катионного антимикробного белка человека 18 эпителием толстой кишки человека» . Инфекция и иммунитет . 70 (2): 953–63. дои : 10.1128/IAI.70.2.953-963.2002 . ПМЦ 127717 . ПМИД 11796631 .
- Джулиани А., Пирри Дж., Николетто С. (2007). «Антимикробные пептиды: обзор перспективного класса терапевтических средств» . Цент. Евро. Ж. Биол . 2 (1): 1–33. дои : 10.2478/s11535-007-0010-5 .
- Бертон М.Ф., Steel PG (декабрь 2009 г.). «Химия и биология ЛЛ-37». Отчеты о натуральных продуктах . 26 (12): 1572–84. дои : 10.1039/b912533g . ПМИД 19936387 .