Орто -карборан

| |
 Загрязненный ортокарборан
| |
| Имена | |
|---|---|
| Другие имена
1,2 -дикарбадодекаборан (12), орто -дикарбадодекаборан
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Чеби | |
| Chemspider | |
| Echa Infocard | 100.037.164 |
| ЕС номер |
|
Comptox Dashboard ( EPA )
|
|
| Характеристики | |
| C 2 H 12 B 10 | |
| Молярная масса | 144.22 g·mol −1 |
| Появление | бесцветный твердый |
| Точка плавления | 320 ° C (608 ° F; 593 K) |
| Опасности | |
| GHS Маркировка : | |
 
| |
| Предупреждение | |
| H228 , H302 , H312 , H332 | |
| P210 , P240 , P241 , P261 , P264 , P270 , P271 , P280 , P301+P312 , P302+P352 , P304+P312, P304 , +P340 , P312 P501, P501, P501, P501 , P322 P501 , P501 , , P330, P363 , P370+P378 , P3330, P363, P370+P378, P501, P333 | |
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |
Ortho -carborane является соединением органоборона с формулой C 2 B 10 H 12 . Префикс орто получен из орто . Это самый выдающийся карборан . Эта производная была рассмотрена для широкого спектра применения от теплостойких полимеров до медицинских применений. Это бесцветное твердое вещество, которое тает без разложения, при 320 ° C
Структура
[ редактировать ]Кластер имеет симметрию C 2V . [ 1 ]
Подготовка
[ редактировать ]Орто-карборан готовится добавлением ацетиленов в декаборан (14) . Современные синтезы включают в себя два этапа, первую, включающую генерацию аддукта декаборана: [ 2 ] [ 3 ]
- B 10 H 14 + 2 SET 2 → B 10 H 12 (SET 2 ) 2 + H 2
На втором этапе алкин устанавливается в качестве источника двух углеродных вершин: [ 3 ]
- B 10 H 12 (SET 2 ) 2 + C 2 H 2 → C 2 B 10 H 12 + 2 SET 2 + H 2
Заменившие ацетилен могут использоваться более удобно, чем ацетиленовый газ. Например, бис (ацетоксиметил) ацетилен легко добавляет к декарборину.
- B 10 H 12 (SET 2 ) 2 + C 2 (Ch 2 O 2 CCH 3 ) 2 → C 2 B 10 H 10 (CH 2 O 2 CCH 3 ) 2 + 2 SET 2 + H 2
Органические заместители удаляются гидролизом эфира с последующим окислением: [ 2 ]
- 3 C 2 B 10 H 10 (CH 2 O 2 CH 3 ) 2 + 10 KOH + + 8 кмно 4 → 3 C 2 B 10 H 12 + 6 CH 3 CO 2 K + 8 MNO 2 + 6 K 2 CO 3 + 8 H 2 O
Реакция
[ редактировать ]Тепловая перестройка
[ редактировать ]После нагрева до 420 ° C он переставляется, образуя мета -изомер. Para изомер производится путем нагрева до температуры выше 600 ° C.

Сокращение и «обратная изомеризация»
[ редактировать ]Ortho-Carborane подвергается 2E-снижению при обработке раствором лития в аммиаке. Результатом является Nido Cluster 7,9- [C 2 B 10 H 12 ] 2- Полем В Дианионе углеродные вершины не смежны. Тот же кластер производится путем уменьшения мета-карборана. Окисление полученного 7,9- [C 2 B 10 H 12 ] 2- дает орто Карборан. [ 4 ]
Депротонирование
[ редактировать ]Лечение реагентами организма дает производное дилитио. [ 5 ]
- C 2 B 10 H 12 + 2 Bullying → Li 2 C 2 B 10 H 10 + 2 BUH
Это расширенное соединение реагирует с различными электрофилами, например, хлорфосфинами, хлорсиланами и серной. [ 6 ]
Базовая распределение в дикарболлид
[ редактировать ]Базовая деградация Ortho Carborane дает анионное производное 11-вертекс, предшественник комплексов дикарболлида : [ 7 ]
- C 2 B 10 H 12 + Naoaet + 2 Lears + C 2 B 9 H 12 − + H 2 + b (oet) 3
- НА + C 2 B 9 H 12 − + Nah → na 2 c 2 b 8 h 11 + h 2
Дикарболлиды (C 2 B 8 H 11 2- ) функционировать как лиганды для переходных металлов и F-элементов. [ 8 ] Дианион образует сэндвич -соединения , бис (дикарболлиды). Дикарболлиды, являющиеся сильными донорами электронов, стабилизируют более высокие состояния окисления, например, Ni (IV).
Депротонирование Карборан
[ редактировать ]Вершины CH ближайших к дигарбадодекаборанам подвергаются депротонированию при лечении реагентами организма : [ 9 ]
- C 2 B 10 H 12 + 2 Bullying → Li 2 C 2 B 10 H 10 + 2 BUH
Эти расширенные соединения реагируют с различными электрофилами, например, хлорфосфинами, хлорсиланами и серной. [ 10 ] Многие из тех же соединений могут быть произведены путем гидроброрации алкинов:
- Li 2 C 2 B 10 H 10 + 2 RX → R 2 C 2 B 10 H 10 + 2 LIX
- L 2 B 10 H 10 + RC 2 R → R 2 C 2 B 10 H 10 + 2 L (L = MECN и т. Д.)
Ortho-Carborane может быть преобразован в высокореактивные карборины с формулой B 10 C 2 H 10 .
Замена на вершине бора
[ редактировать ]В отличие от гидрогидов на углеродных вершин, гидрогины на вершинах бора не являются кислыми и не реагируют с сильными основаниями. Это связано с тем, что бор не такой электроотрицательный, как углерод, и, следовательно, полярность связей B -H относительно низкая. Замена на вершинах бора все еще возможна с использованием галогенитных агентов посредством электрофильной замещения или фотохимических реакций. [ 11 ]
Например, вершины бора в положениях 9 и 12, противоположных углеродным вершинам, могут быть йодированы с использованием йода и каталитического количества Alcl 3, когда в рефлюксте дихлорметана. [ 12 ]

Экзогедральное галогенирование приводит к увеличению эффекта отмены электронов Карборан, который увеличивает кислотность связей C -H, особенно когда галогены расположены в 9 и 12 положениях. [ 13 ] Возможна также возможна, и при увеличении количества атомов галогенидов способность π-обратной поддержки галогенида уменьшается, что позволяет образовать интрамолекулярные нековалентные связи внутримолекулярного галогенида. [ 14 ]

Йодированные производные карбона могут быть дополнительно изменены для доступа к алкилированным продуктам бора посредством реакции поперечного соединения. Это можно сделать путем обработки галогенированного карбояна с помощью реагента Гриньяра в присутствии комплекса фосфина палладиевого комплекса. Соединения Bromo и Chloro не реагируют в тех же условиях. [ 15 ]
Димеризация Карборан
[ редактировать ]
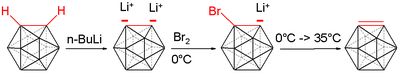
После обработки орто-карборанов с помощью реагентов организма, таких как N-бутиллития, вершины CH в клетке Carboran Используя эту более активную связь углерода-лития, металлированные карборановые клетки можно затем обрабатывать хлоридом меди (i) , в то время как в органических растворителях, что приводит к медной опосредованной углеродной реакции углеродного углеродного соединения в клетках карборан. Медная соль необходима, чтобы избежать нежелательных реакций сочетания углерода и борона. Реакционную смесь позволяет перемешивать при комнатной температуре в течение двух дней, образуя клетку карбона с медью. Наконец, смесь обрабатывается 3 -метровой соляной кислотой, чтобы гасить процесс реакции. Затем сырой продукт очищается с помощью колоночной хроматографии и обеспечивает один полу-эквивалент из углеродного углеродного димера оригинального орто-карбана с высокой урожайностью. Стоит отметить влияние пожертвования растворителей на урожайность реакций, как урожайность в растворителях, таких как тетрагидрофуран и диэтиловый эфир предоставляют продукт с значительно сниженной урожайностью. [ 16 ]
История
[ редактировать ]Подготовка близовых дицидикарбадодекаборанов независимо сообщалась группами в Корпорации Olin и подразделении реакционных двигателей Thiokol Chemical Corporation, работающей при ВВС США и опубликовано в 1963 году. Эти группы продемонстрировали высокую стабильность в воздухе 1,2-корозо-додекаборана. и связанные с ними соединения представлены общий синтез, описали преобразование заместителей без разрушения кластера Карборан, и продемонстрировали орто в мета изомеризации. [ 17 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Дэвидсон, мг; Хибберт, Тг; Говард, Джейк; Mackinnon, A.; Уэйд, К. (1996). «Окончательные кристаллические структуры орто-, мета- и пара Карборинов: супрамолекулярные структуры, направленные исключительно C-H ⋯ O-водородной связью с HMPA (HMPA = гексаметилфосфорамид)». Химический Общение (19): 2285–2286. doi : 10.1039/cc9960002285 .
- ^ Jump up to: а беременный Чарльз Р. Кутал Дэвид А. Оуэн Ли Дж. Тодд (1968). « Клопа -1,2-дикарбадодекаборан (12): [ 1,2-дикарбакловододекаборан (12 )]». Неорганические синтезы . Тол. 11. С. 19–24. doi : 10.1002/9780470132425.CH5 . ISBN 978-0-470-13170-1 .
- ^ Jump up to: а беременный М. Фредерик Хоторн; Тимоти Д. Эндрюс; Филипп М. Гаррет; Фред П. Олсен; Мартен Рейнтжес; Фред Н. Теббе; Лес Ф. Уоррен; Патрик А. Вегнер; Дональд С. Янг (1967). «Icosahedral Carboranes и промежуточные соединения, ведущие к приготовлению производных карбаметаллического бора гидрида». Неорганические синтезы . Тол. 10. С. 91–118. doi : 10.1002/9780470132418.CH17 . ISBN 978-0-470-13241-8 .
- ^ Рассел Н. Граймс (2016). «10. Icosahedral Carboranes: 1,7-C 2 B 10 H 12 и 1,12-C 2 B 10 H 12 ». Карборан, 3 -е издание . Elsevier. ISBN 978-0-12-801905-4 .
- ^ Popescu, A.-R.; МУСТИ, AD; Ферре-Угальде, а.; Виньяс, С.; Нуньес, Р.; Teixidor, F. (2012). «Влиятельная роль эфирного растворителя в соединениях органолита: случай карбораниллития». Химия - европейский журнал . 18 (11): 3174–3184. doi : 10.1002/chem.201102626 . PMID 22334417 .
- ^ Джин, Г.-Х. (2004). «Достижения в химии органометаллических комплексов с 1,2-дихалкогенолато-O-карбороновыми лигандами». Координат Химический Преподобный 248 (7–8): 587–602. doi : 10.1016/j.ccr.2004.01.002 .
- ^ Плешек, Дж.; Heřmánek, S.; Штибр, Б. (1983). «Калиум Dodecahydro-7, 8-дикарба-нидо-некаборат (1-), K [7, 8-C2 B9 H12], промежуточные продукты, стоковое раствор и безводом соль». Калиум Dodecahydro-7,8-дикарба- нидо -некаборат (1-), K [7,8-C 2 B 9 H 12 ], промежуточные звена, раствор на основе и безводную соль . Неорганические синтезы. Тол. 22. С. 231–234. doi : 10.1002/9780470132531.CH53 . ISBN 978-0-470-13253-1 .
- ^ Хоторн, MF; Молодой, округ Колумбия; Wegner, PA (1965). «Производные карбаметаллические производные гидрида бора. I. Очевидные аналоги ферроцена и иона железа». Журнал Американского химического общества . 87 (8): 1818–1819. doi : 10.1021/ja01086a053 .
- ^ Popescu, A.-R.; МУСТИ, AD; Ферре-Угальде, а.; Виньяс, С.; Нуньес, Р.; Teixidor, F. (2012). «Влиятельная роль эфирного растворителя в соединениях органолита: случай карбораниллития». Химия - европейский журнал . 18 (11): 3174–3184. doi : 10.1002/chem.201102626 . PMID 22334417 .
- ^ Джин, Г.-Х. (2004). «Достижения в химии органометаллических комплексов с 1,2-дихалкогенолато-O-карбороновыми лигандами». Координат Химический Преподобный 248 (7–8): 587–602. doi : 10.1016/j.ccr.2004.01.002 .
- ^ Граймс, Рассел Н. (2016). Карборан (третье изд.). Амстердам Бостон Гейдельберг: Elsevier, академическая пресса. ISBN 978-0-12-801894-1 .
- ^ Эндрюс, Джон С.; Зарас, Джозеф; Джонс, Мейтленд (октябрь 1985). "9-IDO-O-Carborne " Неорганическая химия . 24 (22): 3715–3716. doi : 10.1021/ ic00216a0 ISSN 0020-1
- ^ Шиваев, Игорь Б.; Ануфрив, Сергей А.; Шмалко, Аким В. (март 2023 г.). «Как заместители на атомах бора влияют на CH-ацильность и электрон-снижающий эффект клетки орто-коренной клетки: пристальный взгляд на спектры ЯМР 1H» . Inorganica chimica acta . 547 : 121339. DOI : 10.1016/j.ica.2022.121339 .
- ^ Потер, Джорди; Остаться, Сильвия; Потер, Альберт; Уивер, Франческ; Оттоссон, Хенрик; Виноградники, ясные; Один, Майкл (2023-10-18). Closos Closo . Общество 145 (41): 22527–2 два 10.1021/jacs.3c07335: ISSN 0002-7 10591335PMC 37728951PMID
- ^ Ли, Джи; Логан, Кэмерон Ф.; Джонс, Мейтленд (декабрь 1991 г.). «Простые синтезы и реакции алкилирования 3-iodo-O-Carborane и 9,12-диоидо-O-карборан» . Неорганическая химия . 30 (25): 4866–4868. doi : 10.1021/ic00025a037 . ISSN 0020-1669 .
- ^ Рен, Шикуо; Xie, Zuowei (2008-10-13). «Свободный и практический синтетический маршрут до 1,1' -бис (O -карборан)» . Органометаллики . 27 (19): 5167–5168. doi : 10.1021/om8005323 . ISSN 0276-7333 .
- ^ Heying, tl; Ager, JW; Кларк, SL; Мангольд, диджей; Гольдштейн, HL; Hillman, M.; Полак, RJ; Szymanski, JW (1963). «Новая серия органоборанов. I. Карборан от реакции декаборана с ацетиленовыми соединениями». Неорганическая химия . 2 (6): 1089–1092. doi : 10.1021/ic50010a002 .