UBA Protein Domain
| ОТЕЦ | |||
|---|---|---|---|
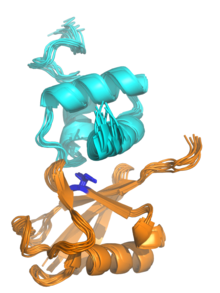 Структура ЯМР домена UBA из белкового убиквилина-1 (вверху, голубой), связанной с убиквитином (внизу, оранжевым), иллюстрируя структуру пакета с тремя спинками домена UBA. Изолецин 44, центр гидрофобного пятна на поверхности убиквитина, которая взаимодействует с рядом убиквитин-связывающих доменов , выделяется синим цветом. Рендерирован из PDB : 2JY6 . [ 1 ] | |||
| Идентификаторы | |||
| Символ | ОТЕЦ | ||
| Pfam | PF00627 | ||
| PFAM клан | CL0214 | ||
| Эко | 103.1.1 | ||
| InterPro | IPR015940 | ||
| PROSITE | PDOC50030 | ||
| Краткое содержание | 1EFU / SCOPE / SUPFAM | ||
| CDD | CD00194 | ||
| |||
Домены, ассоциированные с убиквитином (UBA), представляют собой белковые домены , которые не ковалентно взаимодействуют с убиквитином с помощью белкового белкового взаимодействия . Убиквитин - это небольшой белок, который ковалентно связан с другими белками как часть внутриклеточных сигнальных путей, часто в качестве сигнала для разложения белка . Домены UBA являются одними из наиболее распространенных убиквитин-связывающих доменов . [ 2 ] [ 3 ]
Функция
[ редактировать ]Белки, содержащие домены UBA, участвуют в различных дополнительных клеточных процессах, таких как репарация нуклеотидного удаления (NER), дублирование тела шпинделя и рост клеток . [ 4 ]
Деградация белка через систему протеасом убиквитина (UPS) позволяет клетке избирательно негативно регулировать внутриклеточные белки. Разложение белка помогает поддерживать контроль качества белка, передачу сигналов и прогрессирование клеточного цикла. [ 5 ] [ 6 ] Было предложено UBA для ограничения удлинения убиквитиновой цепи и нацеливаться на полиубиквитинированные белки на 26S Протеасома для деградации. [ 7 ] Они были идентифицированы в модульных белках, участвующих в транспортировке белков, репарации ДНК , протеасомной деградации и регуляции клеточного цикла.
Структура
[ редактировать ]UBA Домены имеют общий мотив последовательности из приблизительно 45 аминокислотных остатков . [ 8 ] Они складываются в структуры пучка с тремя спинками . [ 2 ]
Примеры
[ редактировать ]
Человеческий концевой гомолог дрожжевой домен RAD23A является одним из примеров белка нуклеотидного удаления, который содержит как внутренний, так и C- UBA . решения Структура человеческой RAD23A UBA (2) показала , что домен образует компактный пакет с тремя списками. [ 10 ]
Сравнение структур UBA (1) и UBA (2) показывает, что оба образуют очень похожие складки и имеют консервативную большую гидрофобную поверхностную пятно, которая может быть распространенной белковой поверхностью, присутствующей в различных доменах UBA . Доказательства того, что убиквитин связывается с доменами UBA, приводит к предсказанию, что гидрофобный поверхностный участок доменов UBA взаимодействует с гидрофобной поверхностью на пятицепочечном бета-листе убиквитина. [ 11 ]
Этот домен похож по последовательности с N-концевым доменом трансляции фактора удлинения EF1B (или EF-TS) из бактерий, митохондрий и хлоропластов . [ 9 ]
Ссылки
[ редактировать ]- ^ Zhang D, Raasi S, Fushman D (март 2008 г.). «Аффинность имеет значение: неселективное взаимодействие домена UBA убиквилина-1 с мономерными убиквитиновыми и полиубиквитиновыми цепями» . Журнал молекулярной биологии . 377 (1): 162–80. doi : 10.1016/j.jmb.2007.12.029 . PMC 2323583 . PMID 18241885 .
- ^ Jump up to: а беременный Dikic I, Wakatsuki S, Walters KJ (октябрь 2009 г.). «Убиквитинсвязывающие домены - от структур к функциям» . Природные обзоры. Молекулярная клеточная биология . 10 (10): 659–71. doi : 10.1038/nrm2767 . PMC 7359374 . PMID 19773779 .
- ^ Husnjak K, Dikic I (7 июля 2012 г.). «Убиквитинсвязывающие белки: декодеры убиквитин-опосредованных клеточных функций». Ежегодный обзор биохимии . 81 (1): 291–322. doi : 10.1146/annurev-biochem-051810-094654 . PMID 22482907 .
- ^ SU V, Lau AF (сентябрь 2009 г.). «Убиквитиноподобные и убиквитин-ассоциированные доменные белки: значимость при протеасомной деградации» . Клеточные и молекулярные науки о жизни . 66 (17): 2819–33. doi : 10.1007/s00018-009-0048-9 . PMC 2725189 . PMID 19468686 .
- ^ Гомес Т.А., Колава Н., Джи М., Сэредски М.Дж., Дешай Р.Дж. (май 2011 г.). «Идентификация функционального сайта стыковки в домене RPN1 LRR для белка DDI1 домена UBA-UBA» . BMC Biology . 9 : 33. DOI : 10.1186/1741-7007-9-33 . PMC 3126750 . PMID 21627799 .
- ^ TSE MK, Hui SK, Yang Y, Yin St, Hu Hy, Zou B, et al. (2011). «Структурный анализ домена UBA ингибитора X-связанного белка апоптоза выявляет различные поверхности для убиквитин-связывания и самооссоциации» . Plos один . 6 (12): E28511. Bibcode : 2011ploso ... 628511t . doi : 10.1371/journal.pone.0028511 . PMC 3240630 . PMID 22194841 .
- ^ Li J, Chu H, Zhang Y, Mou T, Wu C, Zhang Q, Xu J (2012). «Ген риса HGW кодирует белок домена, ассоциированного с убиквитином (UBA), который регулирует дату заголовка и вес зерна» . Plos один . 7 (3): E34231. BIBCODE : 2012PLOSO ... 734231L . doi : 10.1371/journal.pone.0034231 . PMC 3311617 . PMID 22457828 .
- ^ Hofmann K, Bucher P (май 1996 г.). «Домен UBA: мотив последовательности, присутствующий в нескольких классах ферментов пути убиквитинирования». Тенденции в биохимических науках . 21 (5): 172–3. doi : 10.1016/s0968-0004 (96) 30015-7 . PMID 8871400 .
- ^ Jump up to: а беременный Кавашима, Такемаса; Бертет-Коломинас, Кармен; Вулфф, Майкл; Кьюсак, Стивен; Леберман, Рувим (8 февраля 1996 г.). «Структура комплекса Escherichia coli ef-tu · ef-ts с разрешением 2,5 Å». Природа . 379 (6565): 511–518. Bibcode : 1996natur.379..511k . doi : 10.1038/379511A0 . PMID 8596629 . S2CID 4273375 .
- ^ Dieckmann T, Withers-Ward ES, Jarosinski MA, Liu CF, Chen IS, Feigon J (декабрь 1998 г.). «Структура домена белка для восстановления ДНК человека, который взаимодействует с ВПР ВИЧ-1». Природа структурная биология . 5 (12): 1042–7. doi : 10.1038/4220 . PMID 9846873 . S2CID 30478711 .
- ^ Mueller TD, Feigon J (июнь 2002 г.). «Растворные структуры доменов UBA выявляют консервативную гидрофобную поверхность для белковых взаимодействий». Журнал молекулярной биологии . 319 (5): 1243–55. doi : 10.1016/s0022-2836 (02) 00302-9 . PMID 12079361 .