Ламеллиподий
Эта статья нуждается в дополнительных цитатах для проверки . ( апрель 2012 г. ) |
Ламеллиподий ) ( мн.: lamellipodia проекцию (от латинского lamella , родственного lamina , «тонкий лист», и греческого радикального pod- , «нога») представляет собой цитоскелетного белка актина на переднем крае клетки . Он содержит квазидвумерную актиновую сетку; вся структура перемещает клетку по подложке. [1] Внутри ламеллиподий имеются ребра актина, называемые микрошипами , которые, когда они распространяются за пределы границы ламеллиподий, называются филоподиями . [2] Ламеллиподий возникает в результате зарождения актина в плазматической мембране клетки. [1] и является основной областью включения актина или образования микрофиламентов в клетке.
Описание
[ редактировать ]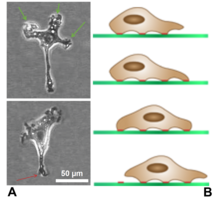
Ламеллиподии обнаруживаются преимущественно во всех подвижных клетках, например в кератиноцитах рыб и лягушек, которые участвуют в быстром заживлении ран . Ламеллиподии этих кератиноцитов позволяют им передвигаться со скоростью 10–20 мкм/мин по поверхности эпителия . Отделившись от основной части клетки, ламеллиподий все еще может свободно передвигаться самостоятельно.
Ламеллиподии являются характерной особенностью переднего края подвижных клеток. Считается, что они являются настоящим двигателем, который тянет клетку вперед в процессе миграции клеток . Кончик ламеллиподия является местом, где происходит экзоцитоз в мигрирующих клетках млекопитающих как часть их клатрин -опосредованного эндоцитарного цикла . Это, вместе с полимеризацией актина, помогает выдвинуть пластинку вперед и, таким образом, продвинуть вперед переднюю часть клетки. Таким образом, он действует как управляющее устройство для клеток в процессе хемотаксиса . Это также место, откуда частицы или агрегаты, прикрепленные к поверхности клетки, мигрируют в процессе, известном как образование кепки .
- Структура
Структурно зазубренные концы микрофиламентов (локализованные мономеры актина в АТФ -связанной форме) обращены к «ищущему» краю клетки, а заостренные концы (локализованные мономеры актина в АДФ -связанной форме) обращены к пластинке сзади. [4] Это создает беговую дорожку по всему ламеллиподию, что способствует ретроградному потоку частиц по всему периметру. [4] Комплексы Arp2/3 присутствуют в соединениях микрофиламент-микрофиламент в ламеллиподиях и помогают создавать актиновую сеть. Arp2/3 может присоединяться только к ранее существовавшим микрофиламентам, но после присоединения он создает сайт для расширения новых микрофиламентов, что создает ветвление. [5] Другой молекулой, которая часто обнаруживается при полимеризации актина с Arp2/3, является кортактин , который, по-видимому, связывает передачу сигналов тирозинкиназы с реорганизацией цитоскелета в ламеллиподии и связанных с ней структурах. [5]
Rac и Cdc42 представляют собой две Rho -семейства ГТФазы , которые обычно находятся в цитозоле, но при определенных условиях также могут быть обнаружены в клеточной мембране. [2] Когда Cdc42 активирован, он может взаимодействовать с рецепторами семейства белков синдрома Вискотта-Олдрича (WASp), в частности с N-WASp , который затем активирует Arp2/3. Это стимулирует ветвление актина и увеличивает подвижность клеток . [2] Rac1 индуцирует локализацию кортактина на клеточной мембране, где он одновременно связывает F-актин и Arp2/3. Результатом является структурная реорганизация ламеллиподия и, как следствие, подвижность клеток. [5] Rac способствует развитию ламеллиподий, тогда как cdc42 способствует развитию филоподий. [6]
Белки Ena/VASP обнаружены на переднем крае ламеллиподий, где они способствуют полимеризации актина, необходимой для выпячивания ламеллиподий и хемотаксиса. Кроме того, Ena/VASP предотвращает действие кэпирующего белка , который останавливает полимеризацию актина. [7]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Альбертс, Брюс; Джонсон, Александр; Льюис, Джулиан; Рафф, Мартин; Робертс, Кейт; Уолтер, Питер (2002). Молекулярная биология клетки (4-е изд.). Нью-Йорк, штат Нью-Йорк: Garland Science. стр. 908, 931, 973–975. ISBN 978-0-8153-3218-3 .
- ^ Перейти обратно: а б с Смолл, Дж. Виктор; Страдал, Терезия; Виньяль, Эммануэль; Роттнер, Клеменс (2002). «Ламелиподий: где начинается подвижность». Тенденции в клеточной биологии . 12 (3): 112–120. дои : 10.1016/S0962-8924(01)02237-1 . ПМИД 11859023 .
- ^ «Что такое ламеллиподии и пластинки?» . МБИнфо . Проверено 4 ноября 2022 г.
- ^ Перейти обратно: а б Крамер, Луиза П. (1997). «Молекулярный механизм актин-зависимого ретроградного потока в ламеллиподиях подвижных клеток» (PDF) . Границы бионауки . 2 (4): d260–270. дои : 10.2741/a189 . ПМИД 9206973 .
- ^ Перейти обратно: а б с Виид, Скотт А.; Каргинов Андрей Владимирович; Шафер, Дороти А.; Уивер, Алисса М.; Кинли, Эндрю В.; Купер, Джон А.; Парсонс, Дж. Томас (2000). «Локализация кортактина в местах сборки актина в ламеллиподиях требует взаимодействия с F-актином и комплексом Arp2/3» . Журнал клеточной биологии . 151 (1): 29–40. дои : 10.1083/jcb.151.1.29 . ПМК 2189811 . ПМИД 11018051 .
- ^ Холл, Алан (1998). «Rho GTPases и актиновый цитоскелет». Наука . 279 (5350): 509–514. Бибкод : 1998Sci...279..509H . дои : 10.1126/science.279.5350.509 . ПМИД 9438836 .
- ^ Медведь, Джеймс Э.; Гертлер, Фрэнк Б. (2009). «Эна / VASP: к разрешению острого противоречия с колючим концом» . Журнал клеточной науки . 122 (12): 1947–1953. дои : 10.1242/jcs.038125 . ПМЦ 2723151 . ПМИД 19494122 .
Внешние ссылки [1]
[ редактировать ]- ^ «Что такое ламеллиподии и пластинки?» . МБИнфо . Проверено 28 ноября 2022 г.