Легочная микробиота
Эта статья нуждается в дополнительных цитатах для проверки . ( сентябрь 2011 г. ) |
Легочная микробиота представляет собой легочное микробное сообщество, состоящее из сложного разнообразия микроорганизмов, обнаруженных в нижних дыхательных путях, особенно на слизистом слое и на эпителиальных поверхностях. К этим микроорганизмам относятся бактерии , грибы , вирусы и бактериофаги . Бактериальная часть микробиоты изучена более тщательно. Состоит из ядра из девяти родов : Prevotella , Sphingomonas , Pseudomonas , Acinetobacter , Fusobacterium , Megasphaera , Veillonella , Staphylococcus и Streptococcus . [1] [2] [3] Это аэробы, а также анаэробы и аэротолерантные бактерии. Микробные сообщества весьма разнообразны у отдельных особей и состоят примерно из 140 различных семейств. Например, бронхиальное дерево содержит в среднем 2000 бактериальных геномов на см. 2 поверхность. Вредные или потенциально вредные бактерии также регулярно выявляются в образцах дыхательных путей. Наиболее значимыми являются Moraxella cataralis , Haemophilus influenzae и Streptococcus pneumoniae . Известно, что они вызывают респираторные нарушения при определенных условиях, а именно при нарушении иммунной системы человека. Механизм, посредством которого они сохраняются в нижних дыхательных путях у здоровых людей, неизвестен.
Роды грибов, которые обычно встречаются, составляют микобиом легких , в микробиоте легких, и включают Candida , Malassezia , Neosartorya , Saccharomyces и Aspergillus , среди других. [4] [5]
Роль эпителиального барьера
[ редактировать ]Эпителий дыхательных путей вместе с альвеолярными макрофагами и дендритными клетками играют важную роль в первичном распознавании продуктов бактерий, попадающих в нижние дыхательные пути с воздухом. Поскольку некоторые из этих продуктов являются мощными провоспалительными раздражителями, для иммунной системы чрезвычайно важно различать патогены и непатогенные комменсалы. Это предотвращает развитие постоянного воспаления и формирует толерантность к безвредной микробиоте. [6]
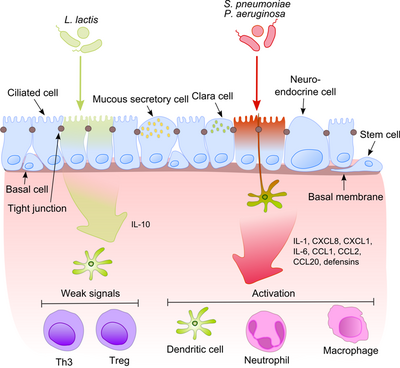
Этот процесс становится гораздо более интригующим, если принять во внимание, что комменсалы часто разделяют свои поверхностные молекулы с патогенами. Эпителиальные клетки оснащены очень чувствительными инструментами распознавания – толл-подобными рецепторами (TLR), нуклеотид-связывающими доменами олигомеризации (NOD)-подобными рецепторами (NLR) и рецепторами, индуцируемыми ретиноевой кислотой (RIG)-I-подобными рецепторами (RLR), которые распознают широкий спектр микробных структурных компонентов. После распознавания патогенных бактерий активируются провоспалительные пути и к очагу инфекции привлекаются клеточные компоненты адаптивного и врожденного иммунитета. [7] Одним из ключевых регуляторов этого процесса является NF-κB , который перемещается из цитоплазмы в ядро и активирует провоспалительные гены в эпителиальных клетках и макрофагах. ДНК-связывающий белковый комплекс распознает дискретную нуклеотидную последовательность (5'-GGG ACT TTC T-3') в расположенной выше области различных генов ответа. Активация NF-κB рядом стимулов: стенками бактериальных клеток или воспалительными цитокинами приводит к его транслокации в ядро.
Напротив, безвредные бактерии не вызывают транслокацию NF-κB в ядро, тем самым предотвращая воспаление, хотя они могут выражать те же молекулярные паттерны, связанные с микробами (MAMP). Один из возможных механизмов, объясняющих этот эффект, был предложен Нейшем, показавшим, что непатогенные S. typhimurium PhoPc и S. pullorum способны запрещать убиквитинирование молекулы-ингибитора NF-κB, ядерного фактора энхансера гена легкого полипептида NF-κB в ингибиторе B-клеток. альфа (IκB-κ). [8] Другое объяснение комменсальной толерантности эпителия относится к посттрансляционной модификации белка путем ковалентного присоединения одного или нескольких мономеров убиквитина (Ub). Ингибирование убиквитинирования приводит к уменьшению воспаления, поскольку только полиубиквитинированный (IκB-κ подвергается деградации с помощью 26S-протеасомы, что позволяет транслокировать NF-κB в ядро и активировать транскрипцию эффекторных генов (например, IL-8). Пробиотические бактерии, такие как лактобациллы, способны модулировать активность убикбиб-протеасомной системы, индуцируя выработку активных форм кислорода (АФК) в эпителиальных клетках. Было показано, что в клетках млекопитающих АФК служат важными вторичными посредниками в многочисленных путях передачи сигнала. ответ на провоспалительные цитокины. Бактериально индуцированные АФК вызывают окислительную инактивацию каталитического остатка цистеина Ub 12, что приводит к неполной, но временной потере неддилирования куллина-1 и последующему воздействию на передачу сигналов NF-κB и β-катенина. B. thetaiotaomicron ослабляет экспрессию провоспалительных цитокинов, способствуя ядерному экспорту субъединицы RelA NF-κB через путь, зависимый от рецептора γ, активируемого пролифератором пероксисом (PPAR-γ). PPAR-γ нацелен на транскрипционно активный Rel A и индуцирует ранний ядерный клиренс, ограничивая продолжительность действия NF-κB.
Баланс между возбудителями и комменсалами чрезвычайно важен для поддержания гомеостаза в дыхательных путях.
Физиология
[ редактировать ]Дыхательные пути постоянно подвергаются воздействию множества микроорганизмов, некоторые из которых способны персистировать и даже колонизировать дыхательные пути. Это возможно благодаря наличию питательных веществ, кислорода и оптимальной температуры роста. Существует несколько источников питательных веществ, полученных от хозяина, для микробов-резидентов: секреты эпителиальных клеток дыхательных путей (особенно бокаловидных клеток), секреты подслизистых желез и транссудат из плазмы. Более того, пул доступных питательных веществ увеличивается за счет деятельности некоторых представителей микробиоты. Макромолекулярные компоненты респираторного секрета (белки, гликопротеины, липиды, нуклеиновые кислоты) превращаются в питательные вещества (например, углеводы, аминокислоты). Таким образом, метаболическая активность нынешних бактерий позволяет колонизировать новые виды. Комменсальные бактерии непатогенны и защищают наши дыхательные пути от патогенов. Существует несколько возможных механизмов. Комменсалы являются естественными конкурентами болезнетворных бактерий, поскольку имеют тенденцию занимать одну и ту же экологическую нишу внутри организма человека. Во-вторых, они способны вырабатывать антибактериальные вещества, называемые бактериоцины, которые подавляют рост болезнетворных микроорганизмов.
Роды Bacillus , Lactobacillus , Lactococcus , Staphylococcus , Streptococcus и Streptomyces являются основными продуцентами бактериоцинов в дыхательных путях. Кроме того, известно, что комменсалы индуцируют ответ Th1 и выработку противовоспалительного интерлейкина (IL)-10, антимикробных пептидов, FOXP3, секреторного иммуноглобулина А (sIgA).
Клиническое значение
[ редактировать ]
Изменения в составе микробного сообщества, по-видимому, играют роль в прогрессировании таких легочных заболеваний, как хроническая обструктивная болезнь легких (ХОБЛ), астма и муковисцидоз . [9] [10] У человека S. aureus является частью нормальной микробиоты, присутствующей в верхних дыхательных путях. [11] и на коже, и в слизистой оболочке кишечника. [12] S. aureus , наряду с аналогичными видами, которые могут колонизироваться и действовать симбиотически, но могут вызывать заболевания, если начинают захватывать колонизированные ими ткани или проникать в другие ткани, были названы «патобионтами». [11] MRSA может аналогичным образом колонизировать людей, не вызывая у них заболевания. [13] Наличие таких родов, как Mycoplasma , Pseudomonas и Staphylococcus, коррелирует со стабильным состоянием ХОБЛ. С другой стороны, Prevotella , Mesorhizobium , Microbacterium , Micrococcus , Veillonela , Rhizobium , Stenotropomonas и Lactococcus присутствуют преимущественно в когорте здоровых людей. Относительная численность протеобактерий повышена у детей-астматиков. Pseudomonas aeruginosa , Staphylococcus aureus и Burkholderia cepacia У больных муковисцидозом чаще всего обнаруживают .
Высокопроизводительное секвенирование и полногеномное секвенирование предоставят дополнительную информацию о сложности и физиологическом значении комменсальных бактерий в нижних дыхательных путях.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Эрб-Даунворд, Джон Р.; Томпсон, Дебора Л.; Хан, Мейлан К.; Фриман, Кристин М.; Макклоски, Лиза; Шмидт, Линдси А.; Янг, Винсент Б.; Тэйвз, Гален Б.; и др. (2011). Бересвилл, Стефан (ред.). «Анализ легочного микробиома у «здорового» курильщика и при ХОБЛ» . ПЛОС ОДИН . 6 (2): e16384. Бибкод : 2011PLoSO...616384E . дои : 10.1371/journal.pone.0016384 . ПМК 3043049 . ПМИД 21364979 .
- ^ Хилти, Маркус; Берк, Конор; Педро, Хелдер; Карденас, Пол; Буш, Энди; Боссли, Кара; Дэвис, Джейн; Эрвин, Аарон; и др. (2010). Нейроль, Оливье (ред.). «Нарушенные микробные сообщества в астматических дыхательных путях» . ПЛОС ОДИН . 5 (1): е8578. Бибкод : 2010PLoSO...5.8578H . дои : 10.1371/journal.pone.0008578 . ПМЦ 2798952 . ПМИД 20052417 .
- ^ Бек, Джеймс М.; Янг, Винсент Б.; Хаффнэгл, Гэри Б. (1 февраля 2012 г.). «Микробиом легких» . Трансляционные исследования . 160 (4): 258–66. дои : 10.1016/j.trsl.2012.02.005 . ПМК 3440512 . ПМИД 22683412 .
- ^ Куи Л., Моррис А., Гедин Э. (июль 2013 г.). «Микобиом человека в здоровье и болезни» . Геном Мед . 5 (7): 63. дои : 10,1186/gm467 . ПМЦ 3978422 . ПМИД 23899327 .
Рисунок 2: Распределение родов грибов на разных участках тела.
{{cite journal}}: Внешняя ссылка в|quote= - ^ Ричардсон, М; Бойер, П; Сабино Р. (1 апреля 2019 г.). «Человеческие легкие и аспергиллы: вы — то, чем вы дышите?» . Медицинская микология . 57 (Дополнение_2): S145–S154. дои : 10.1093/mmy/myy149 . ПМК 6394755 . ПМИД 30816978 .
- ^ Кумар, Химаншу; Каваи, Таро; Акира, Шизуо (2011). «Распознавание патогенов врожденной иммунной системой». Международные обзоры иммунологии . 30 (1): 16–34. дои : 10.3109/08830185.2010.529976 . ПМИД 21235323 . S2CID 42000671 .
- ^ Ша, К.; Труонг-Тран, AQ; Плитт-младший; Бек, Луизиана; Шлеймер, Р.П. (2004). «Активация эпителиальных клеток дыхательных путей агонистами Toll-подобных рецепторов». Американский журнал респираторной клеточной и молекулярной биологии . 31 (3): 358–64. CiteSeerX 10.1.1.314.5790 . дои : 10.1165/rcmb.2003-0388OC . ПМИД 15191912 .
- ^ Кумар, Амрита; У, Хуйся; Коллиер-Хайамс, Лорен С; Хансен, Джейсон М; Ли, Тэнго; Ямоа, Косж; Пан, Чжэнь-Цян; Джонс, Дин П; Нейш, Эндрю С. (2007). «Комменсальные бактерии модулируют куллин-зависимую передачу сигналов посредством генерации активных форм кислорода» . Журнал ЭМБО . 26 (21): 4457–66. дои : 10.1038/sj.emboj.7601867 . ПМК 2063476 . ПМИД 17914462 .
- ^ Хуанг, Ивонн Дж.; Ким, Евгения; Кокс, Майкл Дж.; Броди, Эоин Л.; Браун, Рон; Винер-Крониш, Жанин П.; Линч, Сьюзен В. (2010). «Постоянная и разнообразная микробиота дыхательных путей, присутствующая во время обострения хронической обструктивной болезни легких» . OMICS: Журнал интегративной биологии . 14 (1): 9–59. дои : 10.1089/omi.2009.0100 . ПМК 3116451 . ПМИД 20141328 .
- ^ Кокс, Майкл Дж.; Аллгайер, Мартин; Тейлор, Байрон; Бэк, Маршалл С.; Хуанг, Ивонн Дж.; Дейли, Ребекка А.; Караоз, Улас; Андерсен, Гэри Л.; и др. (2010). Ратнер, Адам Дж. (ред.). «Микробиота дыхательных путей и распространенность патогенов у пациентов с муковисцидозом с разбивкой по возрасту» . ПЛОС ОДИН . 5 (6): e11044. Бибкод : 2010PLoSO...511044C . дои : 10.1371/journal.pone.0011044 . ПМК 2890402 . ПМИД 20585638 .
- ^ Перейти обратно: а б Шенк, LP; Сюретт, МГ; Боудиш, DM (ноябрь 2016 г.). «Состав и иммунологическое значение микробиоты верхних дыхательных путей» . Письма ФЭБС . 590 (21): 3705–3720. дои : 10.1002/1873-3468.12455 . ПМК 7164007 . ПМИД 27730630 .
- ^ Воллина, У (2017). «Микробиом при атопическом дерматите» . Клиническая, косметическая и исследовательская дерматология . 10 : 51–56. дои : 10.2147/ccid.s130013 . ПМК 5327846 . ПМИД 28260936 .
- ^ Улеманн, AC; Отто, М; Лоуи, Флорида; ДеЛео, Франция (январь 2014 г.). «Эволюция золотистого стафилококка, устойчивого к метициллину и связанного со здравоохранением» . Инфекция, генетика и эволюция . 21 : 563–74. дои : 10.1016/j.meegid.2013.04.030 . ПМЦ 3884050 . ПМИД 23648426 .