Двусторонняя лобно-теменная полимикрогирия
| Двусторонняя лобно-теменная полимикрогирия | |
|---|---|
| Другие имена | БФПП |
Двусторонняя лобно-теменная полимикрогирия — генетическое заболевание с аутосомно-рецессивным наследованием, вызывающее корковые пороки развития. В нашем мозге есть складки в коре головного мозга , которые увеличивают площадь поверхности, называемую извилинами , а у пациентов с полимикрогирией количество складок увеличивается и они становятся меньше, чем обычно. [1] Полимикрогирия определяется как порок развития коры головного мозга, при котором нормальный рисунок извилин на поверхности мозга заменяется чрезмерным количеством мелких, слившихся извилин, разделенных неглубокими бороздками и аномальной кортикальной пластинкой. Согласно продолжающимся исследованиям, мутация в GPR56, члене семейства рецепторов, связанных с G-белком адгезии (GPCR), приводит к BFPP. Эти мутации расположены в разных областях белка без каких-либо доказательств связи между положением мутации и выраженностью фенотипа. [2] Также обнаружено, что GPR56 играет роль в корковом паттерне. [3]
Презентация
[ редактировать ]
- Симптомы : задержка развития, задержка психомоторного развития , умственная отсталость средней и тяжелой степени, усиление рефлексов и судорог (эпилепсия).
Сопутствующие условия
[ редактировать ]BFPP — это корковая аномалия головного мозга, напоминающая булыжник. Нарушения развития коры головного мозга из-за аномальной миграции и расположения нейронов обычно приводят к корковым расстройствам, в том числе к булыжной лиссэнцефалии. Лиссэнцефалия булыжника обычно наблюдается при трех различных синдромах врожденной мышечной дистрофии человека: врожденной мышечной дистрофии Фукуямы , синдроме Уокера-Варбурга и заболевании мышц-глаз-мозга. [4] При булыжной лиссэнцефалии поверхность мозга фактически имеет неровный контур, вызванный наличием скоплений аномально расположенных нейронов и глиальных клеток , которые мигрировали за пределы нормальных границ поверхности мозга. Иногда области, населенные этими аномально расположенными клетками, приводят к ошибочному радиологическому диагнозу полимикрогирии. Однако наличие других аномалий при этих синдромах лиссэнцефалии, включая глазные аномалии, врожденную мышечную дистрофию, вентрикуломегалию и дисплазию мозжечка, обычно отличает эти нарушения от полимикрогирии. [5] Анатомопатологических исследований, характеризующих картину кортикальных ламинарных изменений у пациентов с мутациями гена GPR56, не существует, но было высказано предположение, что визуализирующие характеристики BFPP, включая дефекты миелинизации и кортикальную дисплазию мозжечка , напоминают характеристики так называемого BFPP. пороки развития булыжника (болезнь «мышцы-глаз-мозг» и врожденная мышечная дистрофия Фукуямы), которые также связаны с дефектами N-гликозилирования в развивающемся мозге. [6]
Лиссэнцефалия («гладкий мозг») — крайняя форма пахигирии . При лиссэнцефалии на поверхности коры наблюдается небольшое количество борозд или их отсутствие, в результате чего весь мозг выглядит широким и гладким. Лиссэнцефалию можно спутать с рентгенологической точки зрения с полимикрогирией, особенно при визуализации с низким разрешением, но лиссэнцефалию отличает гладкость и отсутствие неровностей серо-белого перехода, а также заметно увеличенная толщина коры.
Мутация GPR56 также может вызывать тяжелую энцефалопатию, которая связана с электроклиническими особенностями синдрома Леннокса-Гасто . Это заболевание может быть криптогенным или симптоматическим, но симптоматические формы связаны с множественной этиологией и аномальным развитием коры головного мозга. BFPP, вызванный мутациями GPR56, является проявлением порока развития коры головного мозга, вызывающего синдром Леннокса-Гасто. [6]
Полимикрогирию часто путают с пахигирией; поэтому его необходимо отличать от пахигирии, отчетливого порока развития головного мозга, при котором поверхностные складки чрезмерно широкие и редкие. Пахигирия и полимикрогирия могут выглядеть одинаково при нейровизуализации с низким разрешением, такой как КТ, поскольку толщина коры головного мозга может казаться увеличенной, а извилины могут казаться широкими и гладкими в обоих случаях. Вот почему для правильной диагностики необходима нейровизуализация с более высоким разрешением, такая как МРТ. [5]
Генетика
[ редактировать ]GPR56 сгруппирован в семействе B GPCR. Эта группа GPCR имеет длинные N-концы, характеризующиеся внеклеточным «цистеиновым ящиком» и гидрофильные, потенциально богатые муцином . Цистеиновый ящик содержит четыре консервативных цистеина и два триптофана, расположенных определенным образом (C-x2-W-x6-16-W-x4-C-x10-22-CxC) непосредственно перед первым трансмембранным доменом и служит местом расщепления. у некоторых членов этой группы рецепторов, связанных с G-белком. [7] Однако молекулярные и клеточные механизмы того, как GPR56 регулирует развитие мозга, остаются в значительной степени неизвестными. [8] Эти типы рецепторов играют важную роль в биологических процессах, включая эмбриональное развитие, центральную нервную систему (ЦНС), иммунную систему и онкогенез . [9]

Способ наследования
[ редактировать ]Родители пробанда
[ редактировать ]- Родители больного человека являются облигатными гетерозиготами и, следовательно, несут один мутантный аллель.
- Гетерозиготы (носители) не имеют симптомов.
Сестры пробанда
[ редактировать ]- При зачатии каждый брат или сестра больного человека имеет 25%-ную вероятность заболеть, 50%-ную вероятность быть бессимптомным носителем и 25%-ную вероятность не заболеть, а не быть носителем.
- Если известно, что брат или сестра из группы риска здоровы, риск того, что он/она станет носителем, составляет 2/3.
- Гетерозиготы (носители) не имеют симптомов .
Потомок пробанда
[ редактировать ]- Потомство пробанда является облигатным гетерозиготом и, следовательно, будет нести один мутантный аллель.
- В популяциях с высоким уровнем кровного родства потомство человека с GPR56-связанным BFPP и репродуктивного партнера, который является носителем GPR56-связанного BFPP, имеет 50% вероятность унаследовать два болезнетворных аллеля GPR56 и иметь BFPP и 50% шанс быть носителями.
Другие члены семьи пробанда
[ редактировать ]- Каждый брат или сестра родителей пробанда подвергается 50% риску стать носителем. [5]
Диагностика
[ редактировать ]Диагностические критерии для пациента с BFPP включают гетерозиготный генотип по делеции области хромосомы 16q12.1-q21,включая ген GPR56. [10] На сегодняшний день единственным известным геном, связанным с полимикрогирией, является GPR56. Клинически доступно тестирование на двустороннюю лобно-теменную полимикрогирию, связанную с GPR56. Мутации в GPR56 препятствуют коллагена III, его специфического лиганда связыванию , в развивающемся мозге. На сегодняшний день идентифицировано в общей сложности четырнадцать мутаций, связанных с BFPP, включая одну делецию, две сплайсинговые и одиннадцать миссенс-мутаций . Две мутации в домене протеолитического сайта GPCR (GPS), C346S и W349S, вызывают пороки развития головного мозга из-за захвата мутировавших белков в эндоплазматическом ретикулуме . [11]
GPR56 являются частью класса B семейства GPCR , крупнейшего семейства генов клеточной поверхности в геноме человека . В этом семействе существуют различные типы биоактивных молекул, которые передают свой сигнал во внутриклеточный компартмент посредством взаимодействия с этим типом рецепторов. У детей часто наблюдается задержка развития, спастичность или судороги; они также часто являются микроцефалическими . Некоторым пациентам полимикрогирия не диагностируется до тех пор, пока у них не рождаются дети с заболеванием, имеющим более тяжелые проявления. Ретроспективно эти пациенты часто сообщают о некоторых трудностях в своей истории болезни или образования. [12] Пациенты с BFPP демонстрируют умственную отсталость, речевые нарушения, задержку моторного развития и судорожные расстройства, такие как эпилепсия. [13] Ассоциация эпилепсии наблюдается примерно у 50–85% пациентов с BFPP.
Клиническими проявлениями полимикрогирии являются стойкий неврологический дефицит:
В самой легкой форме полимикрогирия является односторонней и поражает только одну небольшую область мозга; неврологические проблемы могут быть неочевидными.
В более тяжелых формах могут наблюдаться очаговые двигательные, сенсорные, зрительные или когнитивные проблемы, в зависимости от расположения пораженного участка мозга.
В наиболее тяжелых формах полимикрогирия бывает двусторонней и генерализованной, что приводит к тяжелой умственной отсталости, церебральному параличу и рефрактерной эпилепсии.
Лица с более легкими формами полимикрогирии доживают до взрослого возраста, тогда как лица с наиболее тяжелыми формами, такими как BFPP, могут умереть в молодом возрасте в результате таких осложнений, как судороги или пневмония. [5] Распространенность изолированной полимикрогирии неизвестна. Исследователи полагают, что в целом это заболевание может быть относительно распространенным, хотя BFPP, вероятно, встречается редко. [14]
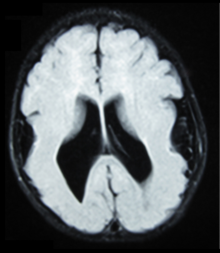
- Рентгенологические данные (МРТ) продемонстрировали симметричную генерализованную полимикрогирию с уменьшением передне-заднего градиента, наиболее выраженную в лобно-теменной коре. [5]
- Многочисленные извилины коры
- Малые извилины и бороздки
- Тонкая кора
Методы/тесты
[ редактировать ]
Существуют различные тесты или методы, используемые для определения экспрессии GPR56 или визуализации мозга для анализа конкретных пораженных участков. Эти тесты, например, с использованием животных, таких как мыши, RNAi , поведенческий анализ, электронная микроскопия, компьютерная томография или МРТ, демонстрируют разные результаты, которые позволяют сделать вывод о наличии у пациента BFPP. [15] МРТ выявляет либо неравномерность поверхности коры, напоминающую множественные мелкие складки, либо неровный, фестончатый вид соединения серого и белого вещества.
Нейровизуализация
[ редактировать ]Диагноз полимикрогирии обычно ставится с помощью магнитно-резонансной томографии (МРТ), поскольку компьютерная томография (КТ) и другие методы визуализации обычно не имеют достаточно высокого разрешения или адекватного контраста для выявления небольших складок, которые определяют это состояние. Кора головного мозга часто выглядит аномально толстой, поскольку множественные мелкие извилины сливаются, складываются и накладываются друг на друга. [5]
Невропатология
[ редактировать ]При общем невропатологическом обследовании выявляют структуру сложных извилин коры головного мозга с миниатюрными извилинами, сросшимися и наложенными друг на друга, что часто приводит к неравномерной поверхности мозга. Кортикальная лента может оказаться чрезмерно толстой в результате сгибания и слияния множества мелких извилин. [5]
Микроскопическое исследование показывает, что кора головного мозга на самом деле аномально тонкая и имеет аномальную слоистость; обычно кора однослойная или имеет четыре слоя, в отличие от обычных шести слоев. Самые поверхностные слои между соседними небольшими извилинами кажутся слитыми, при этом мягкая мозговая оболочка (слой мозговых оболочек) пересекает несколько извилин. Пренатальная диагностика BFPP также доступна для беременных с риском, если мутации GPR56 были выявлены у пораженного члена семьи. [5]
Уход
[ редактировать ]Планы лечения будут различаться в зависимости от тяжести состояния и его проявлений у каждого пациента.Области, которые, вероятно, потребуется оценить и оценить, включают речь, зрение, слух и ЭЭГ . Меры лечения могут включать физиотерапию, трудотерапию, логопедию, противосудорожные препараты и ортопедические устройства. Для облегчения спастических двигательных проблем может потребоваться хирургическое вмешательство. Различные вспомогательные меры, такие как контрактуры суставов, могут предотвратить осложнения.Также может быть рекомендовано генетическое консультирование. [16]
Прогноз
[ редактировать ]После установления диагноза полимикрогирии для обсуждения прогноза можно использовать следующий подход:
Следует изучить историю беременности, уделив особое внимание инфекциям, травмам, многоплодной беременности и другим документально подтвержденным проблемам. скрининг распространенных врожденных Может оказаться целесообразным инфекций, связанных с полимикрогирией, с помощью стандартного теста TORCH. Другие специфические тесты, нацеленные на отдельные нейрометаболические расстройства, могут быть проведены, если это клинически предложено.
Следующие данные могут помочь в определении генетической этиологии:
Семейная история
[ редактировать ]Важно выяснить наличие неврологических проблем у членов семьи, включая судороги, задержку когнитивных функций, двигательные нарушения, псевдобульбарные симптомы и очаговую слабость, поскольку многим затронутым членам семьи, особенно пожилым, возможно, не проводилась МРТ, даже если эти проблемы обратились за медицинской помощью. Кроме того, хотя у большинства людей с полимикрогирией наблюдаются неврологические трудности в младенчестве, детстве или взрослом возрасте, у людей с легкой формой может не быть явного дефицита или иметь лишь незначительные проявления, такие как простая шепелявость или изолированная неспособность к обучению. Таким образом, при подозрении на семейный синдром полимикрогирии может быть разумным выполнить МРТ родственникам, у которых нет симптомов или имеются незначительные изменения. Наличие кровного родства у родителей ребенка может указывать на аутосомно-рецессивный синдром семейной полимикрогирии.
Физический осмотр
[ редактировать ]Общий осмотр пробанда может выявить сопутствующие черепно-лицевые , скелетно-мышечные или висцеральные пороки развития, которые могут указывать на конкретный синдром. Неврологическое обследование должно оценить когнитивные и умственные способности, функцию черепных нервов, двигательную функцию, глубокие сухожильные рефлексы, сенсорную функцию, координацию и походку (при необходимости). [5]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Геррини Р. (5 ноября 2012 г.). «Двусторонняя лобно-теменная полимикрогирия (БФПП)» .
- ^ Бахи-Бюиссон Н., Пуарье К., Боддарт Н., Фалле-Бьянко С., Спеккио Н., Бертини Е. и др. (ноябрь 2010 г.). «Двусторонняя лобно-теменная полимикрогирия, связанная с GPR56: дополнительные доказательства совпадения с комплексом булыжника». Мозг . 133 (11): 3194–3209. дои : 10.1093/brain/awq259 . ПМИД 20929962 .
- ^ Пяо X, Уолш, Калифорния (сентябрь 2004 г.). «Новый сигнальный механизм в развитии мозга». Педиатрические исследования . 56 (3): 309–310. дои : 10.1203/01.PDR.0000139720.67707.D0 . ПМИД 15269343 .
- ^ Линь, доктор Си-Сянь. Личное интервью. 29 октября 2012 г.
- ^ Jump up to: а б с д и ж г час я Статерд К.А., Добинс В.Б., Янсен А., Мирзаа Г., Левентер Р.Дж. (1993). «Обзор полимикрогирии». Адам М.П., Фельдман Дж., Мирзаа Г.М., Пагон Р.А., Уоллес С.Е., Бин Л.Дж., Грипп К.В., Амемия А. (ред.). Джин Обзоры . Вашингтонский университет, Сиэтл. ПМИД 20301504 .
Устаревшая глава, только для исторической справки.
- ^ Jump up to: а б Паррини Э., Феррари А.Р., Дорн Т., Уолш К.А., Геррини Р. (июнь 2009 г.). «Двусторонняя лобно-теменная полимикрогирия, синдром Леннокса-Гасто и мутации гена GPR56» . Эпилепсия . 50 (6): 1344–1353. дои : 10.1111/j.1528-1167.2008.01787.x . ПМЦ 4271835 . ПМИД 19016831 .
- ^ Пяо X, Чанг Б.С., Боделл А., Вудс К., Бензеев Б., Топку М. и др. (ноябрь 2005 г.). «Генотип-фенотипический анализ синдромов лобно-теменной полимикрогирии человека». Анналы неврологии . 58 (5): 680–687. дои : 10.1002/ana.20616 . ПМИД 16240336 .
- ^ Луо Р., Чон С.Дж., Джин З., Строукс Н., Ли С., Пяо Икс (август 2011 г.). «Рецептор 56, связанный с G-белком, и коллаген III, пара рецептор-лиганд, регулируют развитие и ламинирование коры» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (31): 12925–12930. Бибкод : 2011PNAS..10812925L . дои : 10.1073/pnas.1104821108 . ПМК 3150909 . ПМИД 21768377 .
- ^ Чан Нью-Йорк, Сяо CC, Хуан Ю.С., Чен Хю, Се И.Дж., Чанг Г.В. и др. (апрель 2011 г.). «Связанные с заболеванием мутации GPR56 вызывают двустороннюю лобно-теменную полимикрогирию посредством нескольких механизмов» . Журнал биологической химии . 286 (16): 14215–14225. дои : 10.1074/jbc.M110.183830 . ПМЦ 3077623 . ПМИД 21349848 .
- ^ Боргатти Р., Марелли С., Бернардини Л., Новелли А., Каваллини А., Тонелли А. и др. (декабрь 2009 г.). «Синдром двусторонней лобно-теменной полимикрогирии (BFPP) вследствие делеции хромосомы 16q12.1-q21 с участием гена GPR56». Клиническая генетика . 76 (6): 573–576. дои : 10.1111/j.1399-0004.2009.01262.x . ПМИД 19807741 .
- ^ Сингер К., Луо Р., Чон С.Дж., Пяо Икс (февраль 2013 г.). «GPR56 и развивающаяся кора головного мозга: клетки, матрикс и миграция нейронов» . Молекулярная нейробиология . 47 (1): 186–196. дои : 10.1007/s12035-012-8343-0 . ПМЦ 3538897 . ПМИД 23001883 .
- ^ Сарнат ХБ. «Полимикрогирия» . МедЛинк .
- ^ Чон С.Дж., Луо Р., Ли С., Строукс Н., Пяо Икс (сентябрь 2012 г.). «Характеристика экспрессии белка рецептора 56, связанного с G-белком, в развивающемся неокортексе мыши» . Журнал сравнительной неврологии . 520 (13): 2930–2940. дои : 10.1002/cne.23076 . ПМЦ 3908671 . ПМИД 22351047 .
- ^ «Полимикрогирия» . Домашний справочник по генетике . Национальная медицинская библиотека США.
- ^ Койрала С., Джин З., Пяо Х., Корфас Дж. (июнь 2009 г.). «GPR56-регулируемая адгезия гранулярных клеток необходима для развития рострального мозжечка» . Журнал неврологии . 29 (23): 7439–7449. doi : 10.1523/JNEUROSCI.1182-09.2009 . ПМЦ 2744696 . ПМИД 19515912 .
- ^ Геррини Р., Добинс В.Б., Баркович А.Дж. (март 2008 г.). «Аномальное развитие коры головного мозга человека: генетика, функциональные последствия и варианты лечения». Тенденции в нейронауках . 31 (3): 154–162. дои : 10.1016/j.tins.2007.12.004 . ПМИД 18262290 .