Агрегация белков

В молекулярной биологии агрегация белков — это явление, при котором внутренне неупорядоченные или неправильно свернутые белки агрегируются (т. е. накапливаются и слипаются) внутри или внеклеточно. [1] [2] Белковые агрегаты вовлечены в широкий спектр заболеваний, известных как амилоидозы , включая БАС , болезнь Альцгеймера , Паркинсона и прионную болезнь. [3] [4]
После синтеза белки обычно сворачиваются в определенную трехмерную конформацию , которая является наиболее термодинамически выгодной : в их нативное состояние . [5] Этот процесс сворачивания обусловлен гидрофобным эффектом : тенденцией гидрофобных (боящихся воды) частей белка защищать себя от гидрофильной (любящей воду) среды клетки, погружаясь во внутреннюю часть белка. Таким образом, внешняя часть белка обычно гидрофильна, тогда как внутренняя часть обычно гидрофобна.
Белковые структуры стабилизируются за счет нековалентных взаимодействий и дисульфидных связей между двумя остатками цистеина . К нековалентным взаимодействиям относятся ионные взаимодействия и слабые взаимодействия Ван-дер-Ваальса . Ионные взаимодействия возникают между анионом и катионом и образуют солевые мостики , которые помогают стабилизировать белок. Взаимодействия Ван-дер-Ваальса включают неполярные взаимодействия (т.е. дисперсионную силу Лондона ) и полярные взаимодействия (т.е. водородные связи , диполь-дипольную связь ). белка Они играют важную роль во вторичной структуре , например, в формировании альфа-спирали или бета-листа , а также третичной структуры. Взаимодействия между аминокислотными остатками в конкретном белке очень важны для окончательной структуры этого белка.
Когда происходят изменения в нековалентных взаимодействиях, что может произойти при изменении аминокислотной последовательности, белок становится склонным к неправильному сворачиванию или разворачиванию. В этих случаях, если клетка не помогает белку в повторной укладке или не разрушает развернутый белок, развернутый/неправильно свернутый белок может агрегировать, при этом открытые гидрофобные части белка могут взаимодействовать с открытыми гидрофобными участками других белков. . [6] [7] Могут образовываться три основных типа белковых агрегатов: аморфные агрегаты, олигомеры и амилоидные фибриллы. [8]
Причины
[ редактировать ]Агрегация белков может происходить по разным причинам. Эти причины можно разделить на четыре класса, которые подробно описаны ниже.
Мутации
[ редактировать ]Мутации , возникающие в последовательности ДНК, могут влиять или не влиять на аминокислотную последовательность белка. Когда последовательность изменена, другая аминокислота может изменить взаимодействие между боковыми цепями, которые влияют на сворачивание белка. Это может привести к обнажению гидрофобных участков белка, которые агрегируются с тем же неправильно свернутым/развернутым белком или с другим белком. [9]
Помимо мутаций в самих затронутых белках, агрегация белков также может быть вызвана косвенно через мутации в белках в регуляторных путях, таких как путь рефолдинга (молекулярные шапероны ) или путь убиквитин-протеасома (убиквитинлигазы). [10] Шапероны помогают в рефолдинге белка, обеспечивая безопасную среду для его сворачивания. Убиквитинлигазы направляют белки на деградацию посредством модификации убиквитина. [11]
Проблемы с синтезом белка
[ редактировать ]Агрегация белка может быть вызвана проблемами, возникающими во время транскрипции или трансляции . Во время транскрипции ДНК копируется в мРНК, образуя цепь пре-мРНК, которая подвергается процессингу РНК с образованием мРНК. [12] Во время трансляции рибосомы и тРНК помогают перевести последовательность мРНК в аминокислотную последовательность. [12] Если на любом из этапов возникают проблемы, связанные с образованием неправильной цепи мРНК и/или неправильной аминокислотной последовательности, это может привести к неправильному сворачиванию белка, что приведет к агрегации белка. [ нужна ссылка ]
Экологические стрессы
[ редактировать ]Экологические стрессы, такие как экстремальные температуры и pH или окислительный стресс , также могут привести к агрегации белков. [13] Одним из таких заболеваний является криоглобулинемия .
Экстремальные температуры могут ослабить и дестабилизировать нековалентные взаимодействия между аминокислотными остатками. Показатель pH за пределами диапазона pH белка может изменить состояние протонирования аминокислот, что может увеличить или уменьшить нековалентные взаимодействия. Это также может привести к менее стабильным взаимодействиям и привести к разворачиванию белка.
Окислительный стресс может быть вызван радикалами, такими как активные формы кислорода (АФК). Эти нестабильные радикалы могут атаковать аминокислотные остатки, приводя к окислению боковых цепей (например, ароматических боковых цепей, боковых цепей метионина ) и/или расщеплению полипептидных связей. [14] Это может повлиять на нековалентные взаимодействия, которые правильно удерживают белок вместе, что может вызвать дестабилизацию белка и привести к его разворачиванию. [13]
Старение
[ редактировать ]В клетках есть механизмы, которые могут рефолдировать или разрушать белковые агрегаты. Однако по мере старения клеток эти механизмы контроля ослабевают, и клетка становится менее способна расщеплять агрегаты. [13]
Гипотеза о том, что агрегация белков является причинным процессом старения, теперь поддается проверке, поскольку существуют некоторые модели замедленного старения. Если развитие белковых агрегатов было процессом, независимым от старения, то замедление старения не покажет никакой эффективности.влияние на скорость протеотоксичности с течением времени. Однако если старение связаносо снижением активности защитных механизмов против протеотоксичности,модели медленного старения продемонстрируют снижение агрегации и протеотоксичности. КДля решения этой проблемы было проведено несколько исследований токсичности C. elegans .Эти исследования показали, что снижение активности передачи сигналов инсулина/IGF(IIS), известный путь регуляции старения защищает отагрегация токсичных белков, связанная с нейродегенерацией. Обоснованность этого подходабыло протестировано и подтверждено на млекопитающих как снижение активности IGF-1.сигнальный путь защищал модельных мышей с болезнью Альцгеймера от поведенческих ибиохимические нарушения, связанные с заболеванием. [15]
Совокупная локализация
[ редактировать ]Несколько исследований показали, что клеточные реакции на агрегацию белков хорошо регулируются и организованы. Белковые агрегаты локализуются в определенных областях клетки, и исследования этой локализации проводились у прокариот (E.coli) и эукариотов (дрожжи, клетки млекопитающих). [16] С макроскопической точки зрения индикаторы позитронно-эмиссионной томографии используются для обнаружения некоторых неправильно свернутых белков. [17] Недавно группа исследователей под руководством доктора Алессандро Крими предложила метод машинного обучения для прогнозирования будущих отложений в мозге. [18]
Бактерии
[ редактировать ]Агрегаты у бактерий асимметрично оказываются на одном из полюсов клетки, «старшем полюсе». После деления клетки дочерние клетки со старшим полюсом получают белковый агрегат и растут медленнее, чем дочерние клетки без агрегата. Это обеспечивает механизм естественного отбора для уменьшения белковых агрегатов в бактериальной популяции. [19]
Дрожжи
[ редактировать ]
Большинство белковых агрегатов в дрожжевых клетках рефолдируются молекулярными шаперонами. Однако некоторые агрегаты, такие как окислительно-поврежденные белки или белки, подлежащие деградации, не могут быть повторно свернуты. Скорее, есть два компартмента, в которых они могут оказаться. Белковые агрегаты могут быть локализованы в околоядерном компартменте контроля качества ( JUNQ ), который находится рядом с ядерной мембраной, или в депозитарном нерастворимом белке ( IPOD ), рядом с вакуолью. дрожжевые клетки. [13] Белковые агрегаты локализуются в JUNQ, когда они убиквитинированы и направлены на деградацию. Агрегированные и нерастворимые белки локализуются на IPOD в виде более постоянных отложений. Есть свидетельства того, что белки здесь могут быть удалены путем аутофагии. [20] Эти два пути работают вместе, поскольку белки имеют тенденцию поступать в IPOD, когда протеасомный путь перегружен. [20]
Клетки млекопитающих
[ редактировать ]В клетках млекопитающих эти белковые агрегаты называются «агресомами» и образуются при заболевании клетки. Это связано с тем, что агрегаты имеют тенденцию образовываться, когда в клетке присутствуют гетерологичные белки , что может возникнуть при мутации клетки. Разные мутанты одного и того же белка могут образовывать агресомы разной морфологии: от диффузного рассеяния растворимых частиц до крупных точек, которые, в свою очередь, несут разную патогенность. [21] Убиквитинлигаза Е3 способна распознавать неправильно свернутые белки и убиквинизировать их. HDAC6 может затем связываться с убиквитином и моторным белком динеином, чтобы доставить меченные агрегаты в центр организации микротрубочек ( MTOC ). Там они объединяются в сферу, окружающую ЦМТО. Они приносят шапероны и протеасомы и активируют аутофагию. [22]
Устранение
[ редактировать ]В клетке существуют две основные системы контроля качества белка, которые отвечают за устранение белковых агрегатов. Неправильно свернутые белки могут повторно сворачиваться с помощью бишапероновой системы или разрушаться с помощью убиквитиновой протеасомной системы или аутофагии. [23]
Переворачивание
[ редактировать ]Бишаперонная система использует шапероны Hsp70 (DnaK-DnaJ-GrpE в E. coli и Ssa1-Ydj1/Sis1-Sse1/Fe1 в дрожжах) и Hsp100 (ClpB в E. coli и Hsp104 в дрожжах) для дезагрегации и рефолдинга белков. . [24]
Hsp70 взаимодействует с агрегатами белков и рекрутирует Hsp100. Hsp70 стабилизирует активированный Hsp100. Белки Hsp100 имеют ароматические петли пор, которые используются для распутывания отдельных полипептидов. Эта активность нити может быть инициирована на N-конце, С-конце или в середине полипептида. Полипептид транслоцируется через Hsp100 в несколько этапов, на каждом этапе используя АТФ. [24] Полипептид разворачивается, а затем ему разрешается повторно сворачиваться либо сам по себе, либо с помощью белков теплового шока. [25]
Деградация
[ редактировать ]Неправильно свернутые белки можно устранить с помощью системы убиквитин-протеасома ( UPS ). Он состоит из пути E1-E2-E3, который убиквинизирует белки, чтобы пометить их для деградации. У эукариот белки разрушаются протеасомой 26S. В клетках млекопитающих лигаза E3, карбокси-концевой белок, взаимодействующий с Hsp70 (CHIP), нацелена на белки, связанные с Hsp70. У дрожжей лигазы E3 Doa10 и Hrd1 имеют сходные функции в отношении эндоплазматической сети . белков [26] На молекулярном уровне скорость деградации агрегатов варьируется от белка к белку из-за их разной внутренней среды и, следовательно, разной доступности для молекул протеаз. [27]

Неправильно свернутые белки также можно устранить посредством аутофагии, при которой белковые агрегаты доставляются в лизосому. [26]
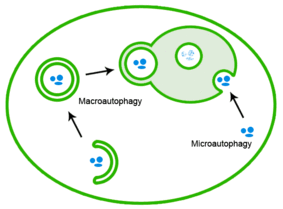
Токсичность
[ редактировать ]Хотя считалось, что зрелые белковые агрегаты сами по себе токсичны, данные свидетельствуют о том, что на самом деле наиболее токсичными являются незрелые белковые агрегаты. [28] [29] Гидрофобные участки этих агрегатов могут взаимодействовать с другими компонентами клетки и повреждать их. Гипотезы заключаются в том, что токсичность белковых агрегатов связана с механизмами секвестрации клеточных компонентов, генерацией активных форм кислорода и связыванием со специфическими рецепторами в мембране или посредством разрушения мембран. [30] Количественный анализ был использован для определения того, что виды с более высокой молекулярной массой ответственны за проникновение через мембрану. [31] Известно, что белковые агрегаты in vitro могут дестабилизировать искусственные фосфолипидные бислои , приводя к проницаемости мембраны. [ нужна ссылка ]
В биопроизводстве
[ редактировать ]Агрегация белков также является распространенным явлением в процессе производства биофармацевтических препаратов, которое может представлять риск для пациентов из-за возникновения неблагоприятных иммунных реакций. [32]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Агуцци А., О'Коннор Т. (март 2010 г.). «Болезни агрегации белков: патогенность и терапевтические перспективы». Обзоры природы. Открытие наркотиков . 9 (3): 237–248. дои : 10.1038/nrd3050 . ПМИД 20190788 . S2CID 5756683 .
- ^ Стефани М., Добсон К.М. (ноябрь 2003 г.). «Агрегация белков и совокупная токсичность: новое понимание сворачивания белков, болезней неправильного сворачивания и биологической эволюции». Журнал молекулярной медицины . 81 (11): 678–699. дои : 10.1007/s00109-003-0464-5 . ПМИД 12942175 . S2CID 23544974 .
- ^ Де Феличе Ф.Г., Виейра М.Н., Мейреллес М.Н., Морозова-Рош Л.А., Добсон К.М., Феррейра С.Т. (июль 2004 г.). «Образование амилоидных агрегатов из лизоцима человека и его связанных с заболеванием вариантов с использованием гидростатического давления» . Журнал ФАСЭБ . 18 (10): 1099–1101. дои : 10.1096/fj.03-1072fje . ПМИД 15155566 . S2CID 13647147 .
- ^ Танзи Р.Э., Бертрам Л. (февраль 2005 г.). «Двадцать лет амилоидной гипотезы болезни Альцгеймера: генетическая перспектива» . Клетка . 120 (4): 545–555. дои : 10.1016/j.cell.2005.02.008 . ПМИД 15734686 . S2CID 206559875 .
- ^ Брюнинг А., Юксток Дж. (01.01.2015). «Неправильно свернутые белки: от маленьких злодеев к маленьким помощникам в борьбе с раком» . Границы онкологии . 5 : 47. doi : 10.3389/fonc.2015.00047 . ПМЦ 4338749 . ПМИД 25759792 .
- ^ Гетинг М.Дж., Сэмбрук Дж. (январь 1992 г.). «Складывание белка в клетке». Природа . 355 (6355): 33–45. Бибкод : 1992Natur.355...33G . дои : 10.1038/355033a0 . ПМИД 1731198 . S2CID 4330003 .
- ^ Робертс CJ (декабрь 2007 г.). «Кинетика агрегации ненативных белков» . Биотехнология и биоинженерия . 98 (5): 927–938. дои : 10.1002/бит.21627 . ПМИД 17705294 . S2CID 21787377 .
- ^ Кокс Д.Л., Нельсон М.М. (2013). Ленингерские принципы биохимии . Нью-Йорк: WH Freeman. п. 143. ИСБН 978-1-4292-3414-6 .
- ^ Паланикумар Л., Карпаускайте Л., Аль-Сайег М., Шехаде И., Алам М., Хасан С. и др. (июнь 2021 г.). «Белковый миметический ингибитор амилоида эффективно устраняет связанную с раком агрегацию мутантного р53 и восстанавливает функцию супрессора опухоли» . Природные коммуникации . 12 (1): 3962. Бибкод : 2021NatCo..12.3962P . дои : 10.1038/s41467-021-23985-1 . ПМЦ 8233319 . ПМИД 34172723 .
- ^ Берке С.Дж., Полсон Х.Л. (июнь 2003 г.). «Агрегация белков и путь протеасомы убиквитина: получение поддержки UPPer в борьбе с нейродегенерацией». Текущее мнение в области генетики и развития . 13 (3): 253–261. дои : 10.1016/S0959-437X(03)00053-4 . ПМИД 12787787 .
- ^ Гриллари Дж., Гриллари-Фоглауэр Р., Янсен-Дюрр П. (2010). Урбани Ф., Магариньос Р., Пуэртас С., Карретеро М., Родригес В., Линьярес Р. и др. (ред.). Посттрансляционная модификация клеточных белков убиквитином и убиквитиноподобными молекулами: роль в клеточном старении и старении . Springer Science+Business Media . стр. 172–196. ISBN 978-1-4419-7002-2 .
- ^ Перейти обратно: а б Уивер РФ (2012). Молекулярная биология . Нью-Йорк: МакГроу-Хилл. стр. 122–156, 523–600. ISBN 978-0-07-352532-7 .
- ^ Перейти обратно: а б с д Тайдмерс Дж., Могк А., Букау Б. (ноябрь 2010 г.). «Клеточные стратегии контроля агрегации белков». Обзоры природы. Молекулярно-клеточная биология . 11 (11): 777–788. дои : 10.1038/nrm2993 . ПМИД 20944667 . S2CID 22449895 .
- ^ Штадтман Э.Р., Левин Р.Л. (декабрь 2003 г.). «Свободнорадикальное окисление свободных аминокислот и аминокислотных остатков в белках». Аминокислоты . 25 (3–4): 207–218. дои : 10.1007/s00726-003-0011-2 . ПМИД 14661084 . S2CID 26844881 .
- ^ Морли Дж. Ф., Бригнулл Х. Р., Вейерс Дж. Дж., Моримото Р. И. (август 2002 г.). «Порог агрегации белков, расширяющих полиглутамин, и клеточной токсичности является динамическим и зависит от старения у Caenorhabditis elegans» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (16): 10417–10422. Бибкод : 2002PNAS...9910417M . дои : 10.1073/pnas.152161099 . ПМК 124929 . ПМИД 12122205 .
- ^ Кокель А.С., Джейкоб Дж.П., Примет М., Демарес А., Димикколи М., Юлу Т. и др. (апрель 2013 г.). «Локализация агрегации белков в Escherichia coli регулируется диффузией и эффектом нуклеоидной макромолекулярной скученности» . PLOS Вычислительная биология . 9 (4): e1003038. arXiv : 1303.1904 . Бибкод : 2013PLSCB...9E3038C . дои : 10.1371/journal.pcbi.1003038 . ПМК 3636022 . ПМИД 23633942 .
- ^ Скотт Джей-Джей (январь 1987 г.). «Реиннервация мышечных веретен кошки скелетофузимоторными аксонами». Исследования мозга . 401 (1): 152–154. дои : 10.1016/0006-8993(87)91175-9 . ПМИД 2949798 . S2CID 42447184 .
- ^ Герардини Л., Зайдел А., Пини Л., Крими А. (октябрь 2023 г.). «Прогнозирование распространения неправильно свернутых белков при болезни Альцгеймера с использованием моделей машинного обучения и распространения» . Кора головного мозга . 33 (24): 11471–11485. дои : 10.1093/cercor/bhad380 . ПМЦ 10724880 . ПМИД 37833822 .
- ^ Беднарска Н.Г., Шимковиц Дж., Руссо Ф., Ван Элдер Дж. (сентябрь 2013 г.). «Агрегация белков у бактерий: тонкая граница между функциональностью и токсичностью» . Микробиология . 159 (Часть 9): 1795–1806. дои : 10.1099/mic.0.069575-0 . ПМИД 23894132 .
- ^ Перейти обратно: а б Такало М, Салминен А, Сойнинен Х, Хилтунен М, Хаапасало А (08 марта 2013 г.). «Механизмы агрегации и деградации белков при нейродегенеративных заболеваниях» . Американский журнал нейродегенеративных заболеваний . 2 (1): 1–14. ПМК 3601466 . ПМИД 23516262 .
- ^ Ван В., Цзэн Л., Цзинь В., Чен Х., Шен Д., Хуан Ю. и др. (декабрь 2021 г.). «Сольватохромный флуоресцентный зонд обнаруживает неоднородность полярности при агрегации белков в клетках». Ангеванде Хеми . 60 (49): 25865–25871. дои : 10.1002/anie.202107943 . ПМИД 34562048 . S2CID 237626399 .
- ^ Гарсиа-Мата Р., Гао Ю.С., Штул Э. (июнь 2002 г.). «Хлопоты с выносом мусора: обострение агресомы» . Трафик . 3 (6): 388–396. дои : 10.1034/j.1600-0854.2002.30602.x . ПМИД 12010457 . S2CID 305786 .
- ^ Грегерсен Н., Болунд Л., Бросс П. (октябрь 2005 г.). «Неправильное сворачивание, агрегация и деградация белков при заболеваниях». Молекулярная биотехнология . 31 (2): 141–150. дои : 10.1385/МБ:31:2:141 . ПМИД 16170215 . S2CID 36403914 .
- ^ Перейти обратно: а б Могк А, Куммер Э, Букау Б (01 января 2015 г.). «Сотрудничество шаперонных машин Hsp70 и Hsp100 в дезагрегации белков» . Границы молекулярной биологии . 2:22 . doi : 10.3389/fmolb.2015.00022 . ПМЦ 4436881 . ПМИД 26042222 .
- ^ Либерек К., Левандовска А., Зиткевич С. (январь 2008 г.). «Шапероны контролируют дезагрегацию белков» . Журнал ЭМБО . 27 (2): 328–335. дои : 10.1038/sj.emboj.7601970 . ПМЦ 2234349 . ПМИД 18216875 .
- ^ Перейти обратно: а б Чен Б., Рецлафф М., Роос Т., Фридман Дж. (август 2011 г.). «Клеточные стратегии контроля качества белка» . Перспективы Колд-Спринг-Харбор в биологии . 3 (8): а004374. doi : 10.1101/cshperspect.a004374 . ПМК 3140689 . ПМИД 21746797 .
- ^ Ван В., Цзэн Л., Цзинь В., Чен Х., Шен Д., Хуан Ю. и др. (декабрь 2021 г.). «Сольватохромный флуоресцентный зонд обнаруживает неоднородность полярности при агрегации белков в клетках». Ангеванде Хеми . 60 (49): 25865–25871. дои : 10.1002/anie.202107943 . ПМИД 34562048 . S2CID 237626399 .
- ^ Чжу Ю.Дж., Линь Х., Лал Р. (июнь 2000 г.). «Свежий и нефибриллярный бета-амилоидный белок (1-40) вызывает быструю клеточную дегенерацию в старых фибробластах человека: доказательства клеточной токсичности, опосредованной AbetaP-каналом» . Журнал ФАСЭБ . 14 (9): 1244–1254. дои : 10.1096/fasebj.14.9.1244 . ПМИД 10834946 . S2CID 42263619 .
- ^ Нильсберт С., Вестлинд-Дэниелссон А., Экман С.Б., Кондрон М.М., Аксельман К., Форселл С. и др. (сентябрь 2001 г.). «Арктическая» мутация APP (E693G) вызывает болезнь Альцгеймера за счет усиленного образования протофибрилл Абета». Природная неврология . 4 (9): 887–893. дои : 10.1038/nn0901-887 . ПМИД 11528419 . S2CID 13516479 .
- ^ Сото С. (январь 2003 г.). «Раскрытие роли неправильного сворачивания белка при нейродегенеративных заболеваниях». Обзоры природы. Нейронаука . 4 (1): 49–60. дои : 10.1038/nrn1007 . ПМИД 12511861 . S2CID 205499427 .
- ^ Флагмейер П., Де С., Виртенсон Д.С., Ли С.Ф., Винке Дж., Мюлдерманс С. и др. (июнь 2017 г.). «Сверхчувствительное измерение Ca 2+ Приток в липидные везикулы, индуцированный белковыми агрегатами» . Angewandte Chemie . 56 (27): 7750–7754. doi : 10.1002/ . PMC 5615231. . PMID 28474754 anie.201700966
- ^ Васкес-Рей М., Ланг Д.А. (июль 2011 г.). «Агрегаты в процессах производства моноклональных антител». Биотехнология и биоинженерия . 108 (7): 1494–1508. дои : 10.1002/бит.23155 . ПМИД 21480193 . S2CID 33285577 .