Гидроксиламмония хлорид
| |

| |

| |
| Имена | |
|---|---|
| Другие имена
Гидроксиламина гидрохлорид
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.024.362 |
| Номер ЕС |
|
| КЕГГ | |
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| Cl Н 4 Н О | |
| Молярная масса | 69.49 g·mol −1 |
| Появление | белое кристаллическое твердое вещество |
| Плотность | 1,67 г/см 3 |
| Температура плавления | От 155 до 157 ° C (от 311 до 315 ° F; от 428 до 430 К) разлагается. |
| Сопряженная база | Гидроксиламин |
| Опасности | |
| СГС Маркировка : | |
    
| |
| Опасность | |
| H290 , H301 , H302 , H312 , H315 , H317 , H319 , H351 , H373 , H400 | |
| P201 , P202 , P234 , P260 , P261 , P264 , P270 , P272 , P273 , P280 , P281 , P301+P310 , P301+P312 , P302+P352 , P305+P351+P338 , P308+P31 3 , П312 , П314 , П321 , P322 , P330 , P332+P313 , P333+P313 , P337+P313 , P362 , P363 , P390 , P391 , P404 , P405 , P501 | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Другие анионы
|
|
Другие катионы
|
|
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
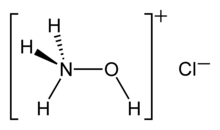
Хлорид гидроксиламмония представляет собой химическое соединение формулы [ NH3OH ] + кл. − . Это солянокислая гидроксиламина соль ( NH 2 OH ). Гидроксиламин является биологическим промежуточным продуктом в процессах нитрификации (биологическое окисление аммиака кислородом в круговороте азота нитрит ) и анаммокса (биологическое окисление нитрита и аммония в газообразный диазот), которые играют важную роль в в почве и на очистных сооружениях .
Приложения
[ редактировать ]Хлорид гидроксиламмония применяется в органическом синтезе для получения оксимов и гидроксамовых кислот из карбоновых кислот , N- и О-замещенных гидроксиламинов, а также в реакциях присоединения двойной углерод-углеродной связи.
При ацетилбромидном методе извлечения лигнина из лигноцеллюлозной биомассы можно использовать хлорид гидроксиламмония для удаления брома и полибромида из раствора .
При обработке поверхностей он используется при приготовлении средств против образования пленки , ингибиторов коррозии и чистящих добавок. Это также исходный материал для производства фармацевтических препаратов и агрохимикатов. В резиновой и пластмассовой промышленности он является антиоксидантом, ускорителем вулканизации и поглотителем радикалов .
Он также используется в качестве фиксатора текстильных красок, вспомогательного средства в некоторых процессах крашения, в качестве средства для экстракции металлов и флотации, в качестве антиоксиданта в жирных кислотах и мыле, а также в качестве стабилизатора цвета и эмульсионной добавки в цветных пленках.
Он также используется в аналитической химии при анализе железа в воде в сочетании с α,α-дипиридилом . Хлорид гидроксиламмония превращает все железо в Fe. 2+ , который затем образует координационный комплекс с дипиридилом.
Ссылки
[ редактировать ]- Фукусима, РС; Дехорити, бакалавр наук; Лёрх, Южная Каролина (1 января 1991 г.). «Модификация колориметрического анализа лигнина и его использование при изучении ингибирующего действия лигнина на переваривание кормов рубцовыми микроорганизмами» . Дж. Аним. наук. 69 (1): 295–304. дои : 10.2527/1991.691295x . ПМИД 2005024 . Архивировано из оригинала 10 октября 2008 года.
- Эльстнер, Э.Ф.; Хойпель, А. (февраль 1976 г.). «Ингибирование образования нитрита из гидроксиламмонийхлорида: простой анализ супероксиддисмутазы». Анальный. Биохим . 70 (2): 616–20. дои : 10.1016/0003-2697(76)90488-7 . ПМИД 817618 .
