Анализ клеточного цикла
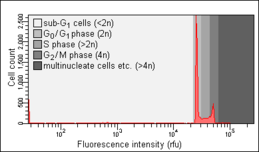
Анализ клеточного цикла путем измерения содержания ДНК — это метод, который чаще всего использует проточную цитометрию для различения клеток на разных фазах клеточного цикла . Перед анализом клетки обычно пермеабилизируют и обрабатывают флуоресцентным красителем , который количественно окрашивает ДНК , например, йодидом пропидия (PI) или 4,6-диамидино-2-фенилиндолом (DAPI). Интенсивность флуоресценции окрашенных клеток коррелирует с количеством содержащейся в них ДНК. Поскольку содержание ДНК удваивается во время фазы S , содержание ДНК (и, следовательно, интенсивность флуоресценции) клеток в G 0 фазе и G 1 фазе (перед S), в фазе S, а также в G 2 фазе и фазе M (после S) идентифицирует положение фазы клеточного цикла в основных фазах (фаза G 0 /G 1 по сравнению с S по сравнению с фазой G 2 /M) клеточного цикла. Содержание клеточной ДНК в отдельных клетках часто изображается в виде гистограммы их частот, чтобы предоставить информацию об относительной частоте (проценте) клеток на основных фазах клеточного цикла.
Аномалии клеточного цикла, выявляемые на гистограмме частоты содержания ДНК, часто наблюдаются после различных типов повреждений клеток, например таких повреждений ДНК , которые прерывают развитие клеточного цикла в определенных контрольных точках . Такая остановка клеточного цикла может привести либо к эффективной репарации ДНК, которая может предотвратить трансформацию нормальной клетки в раковую ( канцерогенез ), либо к гибели клетки, часто по механизму апоптоза . Остановка клеток в G0 или G1 часто наблюдается в результате недостатка питательных веществ (факторов роста), например, после сыворотки депривации .Анализ клеточного цикла был впервые описан в 1969 году в Лос-Аламосской научной лаборатории группой из Калифорнийского университета с использованием техники окрашивания Фельгена . [1] Первый протокол анализа клеточного цикла с использованием окрашивания йодидом пропидия был представлен в 1975 году Автаром Кришаном из Гарвардской медицинской школы и до сих пор широко цитируется. [2]
Многопараметрический анализ клеточного цикла включает, помимо измерения содержания клеточной ДНК, другие компоненты/особенности, связанные с клеточным циклом. Одновременное измерение содержания клеточной ДНК и РНК или восприимчивости ДНК к денатурации при низком pH с использованием метахроматического красителя акридинового оранжевого выявляет компартменты клеточного цикла G1Q , G1A и G1B , а также позволяет различать S, G. 2 и митотические клетки. [3] Клетки в G 1Q находятся в состоянии покоя, временно выведены из клеточного цикла (также обозначаемые как G 0 ), G 1A находятся в фазе роста, тогда как G 1B представляют собой клетки непосредственно перед входом в S, с их ростом (содержание РНК и белка, размер) аналогичен размеру клеток, инициирующих репликацию ДНК. Подобные компартменты клеточного цикла также распознаются с помощью многопараметрического анализа, который включает измерение экспрессии циклина D1 , циклина E , циклина A и циклина B1 , каждого в зависимости от содержания ДНК. [4] Одновременное измерение содержания ДНК и включения предшественника ДНК 5-бром-2'-дезоксиуридина (BrdU) с помощью проточной цитометрии является особенно полезным анализом, который широко используется при анализе клеточного цикла in vitro и in vivo. [5] Однако включение 5-этинил-2'-дезоксиуридина (EdU), предшественника, обнаружение которого дает определенные преимущества по сравнению с BrdU, теперь стало предпочтительным методом обнаружения клеток, реплицирующих ДНК (S-фаза). [6]
Экспериментальная процедура
[ редактировать ]
Если окрашивание не проводится с использованием Hoechst 33342 клеток , первым шагом в подготовке клеток к анализу клеточного цикла является пермеабилизация плазматических мембран . Обычно это делается путем инкубации их в буферном растворе, содержащем мягкое моющее средство. [7] такие как Triton X-100 или NP-40 , или путем фиксации их в этаноле . Большинство флуоресцентных красителей ДНК (одним из исключений является Hoechst 33342 ) не проникают через плазматическую мембрану, то есть не способны проникать через неповрежденную клеточную мембрану. Таким образом, пермеабилизация имеет решающее значение для успеха следующего этапа — окрашивания клеток.
До (или во время этапа окрашивания) клетки часто обрабатывают РНКазой А для удаления РНК . Это важно, потому что некоторые красители, окрашивающие ДНК, также окрашивают РНК, создавая таким образом артефакты , которые искажают результаты. Исключением является метахроматический флуорохром акридиновый оранжевый , который в соответствии со специальным протоколом окрашивания может дифференциально окрашивать как РНК (генерируя красную люминесценцию), так и ДНК (зеленая флуоресценция), или в другом протоколе, после удаления РНК и частичной денатурации ДНК, для дифференциального окрашивания. двухцепочечная ДНК (зеленая флуоресценция) по сравнению с одноцепочечной ДНК (красная люминесценция) [3] . Помимо йодида пропидия и акридинового оранжевого, часто используемые количественные красители включают (но не ограничиваются ими) DRAQ5, 7-аминоактиномицин D , DAPI и Hoechst 33342 .
Дублетная дискриминация
[ редактировать ]Поскольку клетки и особенно фиксированные клетки имеют тенденцию слипаться, агрегаты клеток необходимо исключать из анализа с помощью процесса, называемого дискриминацией дублетов . Это важно, поскольку дублет из двух клеток G 0 /G 1 имеет такое же общее содержание ДНК и, следовательно, ту же интенсивность флуоресценции, что и одна клетка G 2 /M. [8] [9] не будут признаны таковыми, Если дублеты G 0 /G 1 они будут способствовать ложноположительной идентификации и подсчету клеток G 2 /M.
Связанные методы
[ редактировать ]Николетти анализ
[ редактировать ]Анализ Николетти , названный в честь его изобретателя, итальянского врача Ильдо Николетти , представляет собой модифицированную форму анализа клеточного цикла. Он используется для обнаружения и количественной оценки апоптоза , формы запрограммированной гибели клеток , путем анализа клеток с содержанием ДНК менее 2n («клетки суб-G0 / G1 » ). Такие клетки обычно являются результатом апоптотической фрагментации ДНК : во время апоптоза ДНК разрушается клеточными эндонуклеазами . Следовательно, ядра апоптотических клеток содержат меньше ДНК, чем ядра здоровых клеток G 0 /G 1 , что приводит к появлению пика суб-G 0 /G 1 флуоресценции на гистограмме , который можно использовать для определения относительного количества апоптотических клеток в образце. . Этот метод был разработан и впервые описан в 1991 году Николетти и его коллегами из Университета Перуджи . Медицинской школы [10] Оптимизированный протокол, разработанный двумя авторами оригинальной публикации, был опубликован в 2006 году. [11] Объекты, измеренные в пределах суб-пика G 0 /G 1 , с содержанием ДНК менее 5% от содержания пика G 0 G 1 , по всей вероятности, представляют собой апоптотические тельца и, следовательно, не представляют собой отдельные апоптотические клетки. [12]
- Здоровые клетки. Обратите внимание на отсутствие пика суб-G 0 /G 1 .
- Апоптозные клетки через сутки после индукции апоптоза. Обратите внимание на наличие пика суб- G0 / G1 .
- Апоптозные клетки через несколько дней после индукции апоптоза. Обратите внимание на относительное увеличение пика суб-G 0 /G 1 .
Ссылки
[ редактировать ]- ^ Ван Дилла М.А., Трухильо Т.Т., Маллани П.Ф., Коултер-младший (14 марта 1969 г.). «Клеточная микрофлуориметрия: метод быстрого измерения флуоресценции». Наука . 163 (3872): 1213–1214. Бибкод : 1969Sci...163.1213V . дои : 10.1126/science.163.3872.1213 . ПМИД 5812751 . S2CID 13190489 .
- ^ Кришан А. (июль 1975 г.). «Быстропроточный цитофлуориметрический анализ клеточного цикла млекопитающих путем окрашивания йодидом пропидия» . Журнал клеточной биологии . 66 (1): 188–193. дои : 10.1083/jcb.66.1.188 . ПМК 2109516 . ПМИД 49354 .
- ^ Дажинкевич З., Траганос Ф., Меламед М.Р. (1980). «Новые компартменты клеточного цикла, идентифицированные с помощью многопараметрической проточной цитометрии» . Цитометрия . 1 (2): 98–108. дои : 10.1002/cyto.990010203 . ПМИД 6170495 .
- ^ Даржинкевич З., Гонг Дж.П., Хуан Г., Ардельт Б., Траганос Ф. (1996). «Цитометрия белков циклинов» . Цитометрия . 25 (1): 1–13. doi : 10.1002/(SICI)1097-0320(19960901)25:1<1::AID-CYTO1>3.0.CO;2-N . ПМИД 8875049 .
- ^ Грей Дж.В., Долбир Ф., Паллавичини М.Г., Бейскер В., Уолдман Ф. (1986). «Анализ клеточного цикла с использованием проточной цитометрии». Int J Radiat Biol Relat Stud Phys Chem Med . 49 (2): 237–55. дои : 10.1080/09553008514552531 . ПМИД 3510993 .
- ^ Бак С.Б., Брэдфорд Дж., Джи КР, Агнью Б.Дж., Кларк С.Т., Салик А. (2008). «Обнаружение прогрессирования S-фазы клеточного цикла с использованием включения 5-этинил-2'-дезоксиуридина с помощью клик-химии, альтернативы использованию антител к 5-бром-2'-дезоксиуридину» . БиоТехники . 44 (7): 927–9. дои : 10.2144/000112812 . ПМИД 18533904 .
- ^ Винделёв Л.Л., Кристенсен И.Ю., Ниссен Н.И. (март 1983 г.). «Детергентно-трипсиновый метод подготовки ядер для анализа ДНК методом проточной цитометрии» . Цитометрия . 3 (5): 323–327. дои : 10.1002/cyto.990030503 . ПМИД 6188586 .
- ^ Шарплесс Т., Траганос Ф., Дажинкевич З., Меламед М.Р. (1975). «Проточная цитофлуориметрия: различение отдельных клеток и агрегатов клеток путем прямых измерений размера». Акта Цитол . 19 (6): 577–81. ПМИД 1108568 .
- ^ Версто Р.П., Крест Ф.Дж., Лири Дж.Ф., Моррис С., Стетлер-Стивенсон М.А., Габриэльсон Э. (15 октября 2001 г.). «Двойная дискриминация в анализе клеточного цикла ДНК» . Цитометрия . 46 (5): 296–306. дои : 10.1002/cyto.1171 . ПМИД 11746105 .
- ^ Николетти I, Мильорати Дж, Пальаччи MC, Гриньяни Ф, Риккарди К (3 июня 1991 г.). «Быстрый и простой метод измерения апоптоза тимоцитов путем окрашивания йодидом пропидия и проточной цитометрии». Журнал иммунологических методов . 139 (2): 271–279. дои : 10.1016/0022-1759(91)90198-О . ПМИД 1710634 .
- ^ Риккарди С., Николетти I (9 ноября 2006 г.). «Анализ апоптоза с помощью окрашивания йодидом пропидия и проточной цитометрии». Протоколы природы . 1 (3): 1458–1461. дои : 10.1038/nprot.2006.238 . ПМИД 17406435 . S2CID 4469406 .
- ^ Дажинкевич З., Беднер Э., Траганос Ф. (2001). «Трудности и подводные камни анализа апоптоза». Методы Клеточная Биол . 63 : 527–559. дои : 10.1016/s0091-679x(01)63028-0 . ПМИД 11060857 .
Дальнейшее чтение
[ редактировать ]- «Основы клеточного цикла» (PDF) . Университетский колледж Лондона. Архивировано из оригинала (PDF, 0,1 МБ) 06 июня 2011 г. Проверено 20 мая 2010 г.
- Рабинович, Петр. «Введение в анализ клеточного цикла» (PDF, 0,5 МБ) . Феникс Флоу Системс, Инк . Проверено 20 мая 2010 г.