Циклобис(паракват- п -фенилен)

| |
| Идентификаторы | |
|---|---|
| |
3D model ( JSmol )
|
|
| ХимическийПаук | |
ПабХим CID
|
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 36 Ч 32 Н 4 | |
| Молярная масса | 520.663 g· mol −1 |
| Появление | белое твердое вещество [ 1 ] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Циклобис(паракват- п -фенилен) (формально производное параквата ) принадлежит к классу циклофанов и состоит из ароматических звеньев, соединенных метиленовыми мостиками . Он способен включать небольшие молекулы-гости и играет важную роль в химии хозяин-гость и супрамолекулярной химии . [ 2 ]
Циклофан также называют синим ящиком Стоддарта , потому что его изобретатель Дж. Фрейзер Стоддарт иллюстрирует бедные электронами области молекул синим оттенком. [ 3 ]
Синтез
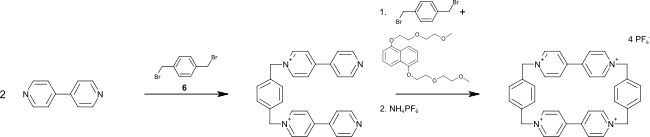
[ редактировать ]Для синтеза циклобис(паракват- п -фенилена) 4,4'-бипиридин подвергают реакции с 1,4-бис(бромметил)бензолом с образованием 1,1'-[1,4-фениленбис-(метилен)]бис(4 ,4'-бипиридин), который в темплатном синтезе снова реагирует с 4,4'-бипиридином до конечного продукта. Обычной матрицей для этого синтеза является 1,5-бис[2-(2-метоксиэтокси)этокси]нафталин. [ 1 ]
Принимающая гостья химия
[ редактировать ]Циклобис (паракват- п -фенилен) способен включать небольшие молекулы гостя, образуя комплекс хозяин-гость . Взаимодействиями, необходимыми для образования комплекса, являются донорно-акцепторные взаимодействия и водородная связь , их сила сильно зависит от способности донора обеспечивать π -электронную плотность . Также расширение π-системы усиливает связывание. Кинетика . комплексообразования и диссоциации зависит от громоздкости гостя [ 4 ]
Одной молекулой, способной образовывать стабильные комплексы с циклобис(паракват- п -фенилен), является тетратиафульвален (ТТФ). Многочисленные производные основаны на хелатирующей способности тетратиафульвалена. Модификации включают механически захваченные соединения, такие как катенаны и ротаксаны , молекулярные переключатели и более крупные супрамолекулярные структуры. [ 4 ]
Взаимодействия с переносом заряда, присутствующие в комплексах циклобиса (паракват- п -фенилена), можно сравнить как структурный мотив с более часто используемыми водородными связями , особенно с точки зрения направленности и комплементарности ( модель замка и ключа ). Комплексы с переносом заряда легче обнаружить спектроскопическими методами и имеют большую толерантность к различным растворителям, но, как правило, имеют более низкую константу ассоциации . Из-за более низкой константы ассоциации известно гораздо меньше комплексов с переносом заряда. Другие нековалентные связи, такие как сольвофобные силы , взаимодействие металл-лиганд, могут быть использованы для увеличения константы ассоциации; В литературе известны многочисленные структуры, основанные на этой стратегии. [ 5 ]
Показано, что выбор противоиона циклобис (паракват- п -фенилена) оказывает большое влияние на константу ассоциации соответствующего комплекса хозяин-гость. [ 6 ] Его часто используют в виде гексафторфосфатной соли, поскольку в этой форме он растворим в органических растворителях.
Использование
[ редактировать ]Для создания катенанов циклобис (паракват- п -фенилен) можно использовать в качестве матрицы для «пронизывания» краун-эфира π-донорным компонентом. В дальнейшем его еще открытые концы соединяют друг с другом, получая два замкнутых кольца. [ 7 ] Бистабильный катенан (кольцо с двумя π-донорными компонентами) уже является простым примером молекулярного переключателя . В настоящем примере выбран циклический эфир с фрагментом TTF и DNP . В то время как циклобис (паракват- п -фенилен) окружает звено TTF в исходном положении, звено DNP стабильно, когда TTF (обратимо) окисляется . Кольцо при этом вращается за счет кулоновского отталкивания вокруг себя до тех пор, пока циклобис(паракват- п -фенилен) не окружит звено ДНП. Обратное движение происходит при повторном сокращении блока ТТФ. Этому первому примеру, доказавшем общую осуществимость, последовали многие другие. [ 8 ]
Производные
[ редактировать ]Были разработаны многочисленные производные циклобиса (паракват- п -фенилена), включая увеличенную версию молекулы, в литературе, обозначенной Ex н Коробка 4+ , где n – количество п – фениленовых колец (n = 0–3). [ 2 ] Эти варианты с большими апертурами способны включать более крупные молекулы разного размера. На основе комплексообразования CBPQT4+ с переносом заряда было создано множество супрамолекулярных структур, включая фибриллярные гели , мицеллы , везикулы , нанотрубки , фолдамеры и жидкокристаллические фазы. По аналогии с биологическими системами, которые собираются с помощью водородных связей с образованием супрамолекулярных структур, альтернативой здесь является комплексообразование с переносом заряда. [ 5 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б Масуми Асакава; Вим Дехаен; Геррит Аббат; Стивен Мензер; Ян Нувен; Фрэнсис М. Раймо; Дж. Фрейзер Стоддарт; Дэвид Дж. Уильямс (январь 1996 г.), «Улучшенный синтез циклобиса (паракват-фенилена) с использованием матрицы», Журнал органической химии , том. 61, нет. 26, с. 9591–9595, номер домена : 10.1021/jo961488i , ISSN 0022-3263.
- ^ Jump up to: а б Джонатан К. Барнс; Михал Юричек; Николаас А. Вермюлен; Эдвард Дж. Дейл; Дж. Фрейзер Стоддарт (2013), «Синтез циклофана ExnBox», Журнал органической химии , том. 78, нет. 23, стр. 11962–11969, номер документа : 10.1021/jo401993n , PMID 24128112.
- ^ Этвуд, Джерри Л.; Стид, Джонатан В. (2013). Супрамолекулярная химия . Хобокен, Нью-Джерси: Уайли. ISBN 978-1-118-68150-3 .
- ^ Jump up to: а б Нильсен, Могенс Бронстед; Джеппесен, Ян Оскар; Лау, Джеспер; Ломхольт, Кристиан; Дамгаард, Дорте; Якобсен, Йенс Петер; Бехер, Ян; Стоддарт, Дж. Фрейзер (2001). «Исследования связывания производных тетратиафульвалена и циклобиса (паракват-фенилена)». Журнал органической химии . 66 (10): 3559–3563. дои : 10.1021/jo010173m . ПМИД 11348145 .
- ^ Jump up to: а б Дас, Аниндита; Гош, Сухрит (17 февраля 2014 г.). «Супрамолекулярные сборки посредством взаимодействий с переносом заряда между донорными и акцепторными хромофорами». Angewandte Chemie, международное издание . 53 (8): 2038–2054. дои : 10.1002/anie.201307756 . ПМИД 24573995 .
- ^ Андерсен, Сиссель С.; Дженсен, Мортен; Соренсен, Энн; Миядзаки, Эйго; Такаямия, Кадзуо; Лаурсен, Бо В.; Флуд, Амар Х.; Джеппесен, Ян О. (2012). «Анионное воздействие на хозяина циклобис (паракват-п-фенилен)». Химические коммуникации . 48 (42): 5157–5159. дои : 10.1039/c2cc31225e . ПМИД 22516888 .
- ^ Милянич, Огнен Ш.; Дихтель, Уильям Р.; Мортезаи, Шахаб; Стоддарт, Дж. Фрейзер (2006). «[2]Катенаны на основе циклобиса (паракват-фенилена), полученные с помощью кинетически контролируемых реакций с участием алкинов». Органические письма . 8 (21): 4835–4838. дои : 10.1021/ol061864d . ПМИД 17020315 .
- ^ Фаренбах, Альберт К.; Уоррен, Скотт С.; Инкорвати, Джаред Т.; Авестро, Алисса-Дженнифер; Барнс, Джонатан К.; Стоддарт, Дж. Фрейзер; Гжибовский, Бартош А. (18 января 2013 г.). «Органические переключатели для поверхностей и устройств». Продвинутые материалы . 25 (3): 331–348. Бибкод : 2013AdM....25..331F . дои : 10.1002/adma.201201912 . ПМИД 22933356 . S2CID 205246256 .