Хинуклидон
Хинуклидоны представляют собой класс бициклических органических соединений с химической формулой C 7 H 11 NO с двумя структурными изомерами основного скелета 3-хинуклидона и 2-хинуклидона .
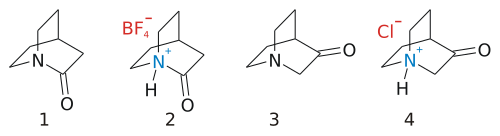
3-Хинуклидон (1-азабицикло[2.2.2]октан-3-он) представляет собой простую молекулу, которую можно синтезировать в виде соляной кислоты соли путем конденсации Дикмана : [ 1 ]
Другой изомер, 2-хинуклидон, выглядит столь же без происшествий, но на самом деле его не удалось синтезировать до 2006 года. [ 2 ] [ 3 ] [ 4 ] Причина в том, что эта молекула очень нестабильна, поскольку ее амидная группа имеет неподеленную аминную пару , а карбонильная группа не выровнена должным образом, как можно было бы ожидать от амида, в результате стерического напряжения . Такое поведение предсказывается правилом Бредта , а формальная амидная группа фактически напоминает амин , о чем свидетельствует легкость образования солей.
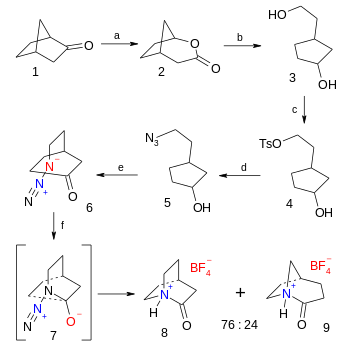
Органический синтез тетрафторборатной 2-хинуклидона представляет соли собой шестистадийный процесс, начиная с норкамфоры, последний этап представляет собой азид - кетоновую реакцию Шмидта (выход 38%): [ 5 ]
Это соединение быстро реагирует с водой с образованием соответствующей аминокислоты с химическим периодом полураспада 15 секунд. Рентгеновская дифракция показывает пирамидализацию атома азота (59° по сравнению с 0 для эталонного диметилформамида ) и кручение вокруг связи углерод-азот до 91°. Попытки получить свободное основание приводят к неконтролируемой полимеризации .
Тем не менее, можно оценить его основность в эксперименте, в котором пары аминов (соль хинуклидония и эталонный амин, такой как диэтиламин или индолин ) вводятся в масс-спектрометр . Относительная основность затем выявляется путем диссоциации гетеродимера, вызванной столкновением. Дальнейший анализ расширенным кинетическим методом позволяет определить сродство к протону и основность газовой фазы 2-хинуклидония. Этот метод определил, что хинуклидон по сродству к протону относится к вторичным и третичным аминам. [ 6 ] Предполагается, что такая высокая основность обусловлена потерей делокализации электронов при скручивании амидной связи - это вызывает несоосность пи-орбиталей, что приводит к потере электронного резонанса.
Ссылки
[ редактировать ]- ^ Х.У. Даеникер, К.А. Гроб (1964). «3-хинуклидона гидрохлорид». Органические синтезы . 44 : 86. дои : 10.15227/orgsyn.044.0086 .
- ^ Тани, Косуке; Штольц, Брайан М. (2006). «Синтез и структурный анализ тетрафторбората 2-хинуклидония». Природа . 441 (7094): 731–734. Бибкод : 2006Natur.441..731T . дои : 10.1038/nature04842 .
- ^ Бетани Хэлфорд (12 июня 2006 г.). «Амид с изюминкой» . Новости химии и техники . 84 (24).
- ^ Клейден, Джонатан; Моран, Уэсли Дж. (2006). «Извращенный амид-2-хинуклидон: 60 лет создания». Angewandte Chemie, международное издание . 45 (43): 7118–7120. дои : 10.1002/anie.200603016 . ISSN 1433-7851 . ПМИД 17009382 .
- ^ Последовательность реакции: первая стадия представляет собой Байеру-Виллигеру норкамфоры по 1 до мета-хлорпероксибензойной кислотой бициклического лактона 2 с последующим органическим восстановлением литийалюминийгидридом окисление в диэтиловом эфире до диола 3 . Первичная спиртовая группа заменяется тозилатной группой в 4 с тозилхлоридом и триэтиламином и, в свою очередь, группой в замещается азидной 5 под действием азида натрия в диметилформамиде . Окисление спирта до кетона 6 происходит периодинаном Десс-Мартена в дихлорметане . Последней стадией получения тетрафторбората 2-хинуклидония 8 является реакция Шмидта через промежуточное соединение 7 с фторборной кислотой в диэтиловом эфире .
- ^ Ли, Тони; Крут, Майкл; Фам, Дон К.; Тани, Косуке; Штольц, Брайан М.; Джулиан, Райан Р. (2007). «Синтез 2-хинуклидония путем удаления воды: экспериментальное количественное определение высокой основности чрезвычайно скрученных амидов» . Журнал Американского химического общества . 129 (7): 1864–1865. дои : 10.1021/ja067703m .