Микродиализ
Эта статья нуждается в дополнительных цитатах для проверки . ( август 2010 г. ) |

Микродиализ — это минимально инвазивный метод отбора проб, который используется для непрерывного измерения концентраций свободных, несвязанных аналитов во внеклеточной жидкости практически любой ткани. Аналиты могут включать эндогенные молекулы (например, нейромедиаторы , гормоны , глюкозу и т. д.) для оценки их биохимических функций в организме или экзогенные соединения (например, фармацевтические препараты ) для определения их распределения в организме. Метод микродиализа требует введения небольшого катетера для микродиализа (также называемого зондом для микродиализа) в интересующую ткань. Зонд для микродиализа имитирует кровеносный капилляр и состоит из стержня с полупроницаемой мембраной из полого волокна на конце, которая соединена с впускной и выпускной трубками. Зонд непрерывно перфузируется водным раствором (перфузатом), который очень напоминает (ионный) состав окружающей тканевой жидкости, при низкой скорости потока примерно 0,1–5 мкл/мин. [1] После попадания в интересующую ткань или жидкость (тела) небольшие растворенные вещества могут пересекать полупроницаемую мембрану путем пассивной диффузии . Направление потока аналита определяется соответствующим градиентом концентрации и позволяет использовать зонды микродиализа как для отбора проб, так и для доставки. [1] Раствор, выходящий из зонда (диализат), собирается через определенные промежутки времени для анализа.
История
[ редактировать ]Принцип микродиализа был впервые использован в начале 1960-х годов, когда канюли «тяни-толкай» [2] и диализные мешочки [3] были имплантированы в ткани животных, особенно в мозг грызунов, для непосредственного изучения биохимии тканей. [1] Хотя эти методы имели ряд экспериментальных недостатков, таких как количество образцов на одно животное или отсутствие/ограниченное временное разрешение, изобретение диалитродов с непрерывной перфузией в 1972 году помогло преодолеть некоторые из этих ограничений. [4] Дальнейшее усовершенствование концепции диалитрода привело к изобретению в 1974 году «полого волокна» — трубчатой полупроницаемой мембраны диаметром ~200-300 мкм. [5] Наиболее распространенная сегодня форма — игольчатый зонд — состоит из стержня с полым волокном на конце и может быть введена с помощью направляющей канюли в мозг и другие ткани. Альтернативный метод, микроперфузия с открытым потоком (OFM), заменяет мембрану макроскопическими отверстиями, что облегчает отбор проб липофильных веществ. [6] [7] [8] и гидрофильные соединения, [9] связанные с белком и несвязанные лекарства, [10] [11] нейротрансмиттеры , пептиды и белки , антитела , [12] [13] [14] наночастицы и наноносители , ферменты и везикулы .
Микродиализные зонды
[ редактировать ]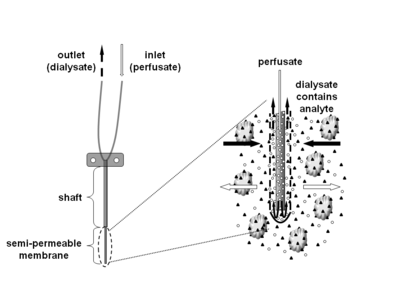
Доступны различные зонды с различными комбинациями длины мембраны и стержня. Пороговая молекулярная масса коммерчески доступных зондов для микродиализа охватывает широкий диапазон примерно 6–100 кДа, но также доступен и 1MD. Хотя водорастворимые соединения обычно свободно диффундируют через микродиализную мембрану, ситуация не столь ясна для высоколипофильных аналитов, где сообщалось как об успешных (например, кортикостероидах), так и о неудачных экспериментах по микродиализу (например, с эстрадиолом, фузидовой кислотой). [15] Однако извлечение водорастворимых соединений обычно быстро снижается, если молекулярная масса аналита превышает 25% предельной молекулярной массы мембраны.
Методы восстановления и калибровки
[ редактировать ]Из-за постоянной перфузии микродиализного зонда свежим перфузатом полное равновесие не может быть установлено. [1] Это приводит к тому, что концентрации диализата оказываются ниже, чем концентрации, измеренные в удаленном месте отбора проб. Чтобы соотнести концентрации, измеренные в диализате, с концентрациями, присутствующими в удаленном месте отбора проб, необходим калибровочный коэффициент (восстановление). [16] Восстановление можно определить в равновесном состоянии, используя постоянную скорость обмена аналита через мембрану микродиализа. Скорость, с которой аналит проходит через полупроницаемую мембрану, обычно выражается как эффективность экстракции аналита. Эффективность экстракции определяется как соотношение между потерей/прибылью аналита во время его прохождения через зонд (C в -C out ) и разницей в концентрации между перфузатом и удаленным местом отбора проб (C в -C образце ).
Теоретически эффективность экстракции зонда для микродиализа можно определить путем: 1) изменения концентрации лекарственного средства при сохранении постоянной скорости потока или 2) изменения скорости потока при сохранении постоянных соответствующих концентраций лекарственного средства. В установившемся режиме достигается одно и то же значение эффективности экстракции, независимо от того, обогащен ли аналит в перфузате или обеднен. [1] Следовательно, зонды для микродиализа можно калибровать либо путем измерения потери аналита с использованием перфузата, содержащего лекарственное средство, либо прироста аналита с использованием растворов проб, содержащих лекарственное средство. На сегодняшний день наиболее часто используемыми методами калибровки являются метод низкого расхода, метод отсутствия чистого потока, [17] динамический (расширенный) метод отсутствия чистого потока, [18] и метод ретродиализа. [19] Правильный выбор подходящего метода калибровки имеет решающее значение для успеха эксперимента по микродиализу. поддерживающие эксперименты in vitro . Поэтому перед использованием на животных или людях рекомендуется провести [1] Кроме того, восстановление, определенное in vitro, может отличаться от восстановления у людей. Поэтому его фактическое значение необходимо определять в каждом эксперименте in vivo. [15]
Метод низкого расхода
[ редактировать ]Метод низкой скорости потока основан на том факте, что эффективность экстракции зависит от скорости потока. При высоких скоростях потока количество лекарственного средства, диффундирующих из места отбора проб в диализат в единицу времени, меньше (низкая эффективность экстракции), чем при более низких скоростях потока (высокая эффективность экстракции). При нулевом расходе устанавливается полное равновесие между этими двумя участками (C out = C sample ). Эта концепция применяется для метода (низкой) скорости потока, при котором в зонд перфузируют пустой перфузат с разными скоростями потока. Концентрацию в месте отбора проб можно определить путем построения графика коэффициентов экстракции в зависимости от соответствующих скоростей потока и экстраполяции до нулевого потока. Метод с низким расходом ограничен тем фактом, что время калибровки может быть довольно длительным, прежде чем будет собран достаточный объем пробы. [ нужна ссылка ]
Метод без чистого потока
[ редактировать ]Во время калибровки методом без суммарного потока зонд для микродиализа перфузируют как минимум четырьмя различными концентрациями интересующего аналита (C in ), а в диализате измеряют равновесные концентрации аналита, выходящего из зонда (C вне ). [17] Уровень восстановления для этого метода можно определить, нанеся график C out −C in на C in и вычислив наклон линии регрессии. Если концентрации аналита в перфузате равны концентрациям в месте отбора проб, не происходит чистого потока. Соответствующие концентрации в точке отсутствия чистого потока представлены точкой пересечения оси x линии регрессии. Сила этого метода заключается в том, что в установившемся состоянии не нужно делать никаких предположений о поведении соединения вблизи зонда, поскольку равновесие существует в определенное время и в определенном месте. [15] Однако в переходных условиях (например, после введения препарата) эффективность зонда может измениться, что приведет к искажению оценок концентраций в месте отбора проб. Чтобы преодолеть это ограничение, было разработано несколько подходов, применимых и в нестационарных условиях. Одним из таких подходов является динамический метод отсутствия чистых потоков. [18]
Динамический метод без чистого потока
[ редактировать ]В то время как одному субъекту/животному перфузируют несколько концентраций во время метода без суммарного потока, нескольким субъектам перфузируют одну концентрацию во время метода динамического отсутствия чистого потока (DNNF). [18] Данные от разных субъектов/животных затем объединяются в каждый момент времени для регрессионного анализа, позволяющего определить восстановление с течением времени. Разработка метода калибровки DNNF оказалась очень полезной для исследований, оценивающих реакцию эндогенных соединений, таких как нейротрансмиттеры, на воздействие лекарственного средства. [18]
Ретродиализ
[ редактировать ]Во время ретродиализа зонд для микродиализа перфузируют раствором, содержащим аналит, и контролируют исчезновение лекарства из зонда. Восстановление для этого метода можно рассчитать как соотношение лекарственного средства, потерянного во время прохождения (C in -C out ), и лекарственного средства, поступающего в зонд для микродиализа (C in ). В принципе, ретродиализ можно проводить с использованием либо самого анализируемого вещества (ретродиализ по лекарственному средству), либо эталонного соединения (ретродиализ по калибратору), которое очень похоже как по физико-химическим, так и по биологическим свойствам на анализируемое вещество. [19] Несмотря на то, что ретродиализ по лекарственному средству нельзя использовать для эндогенных соединений, поскольку он требует отсутствия аналита в месте отбора проб, этот метод калибровки чаще всего используется для экзогенных соединений в клинических условиях. [1]
Приложения
[ редактировать ]Метод микродиализа претерпел значительные изменения с момента его первого использования в 1972 году. [4] когда его впервые использовали для мониторинга концентрации эндогенных биомолекул в мозге. [20] Сегодняшняя область применения расширилась до мониторинга свободных концентраций эндогенных и экзогенных соединений практически в любой ткани. Хотя микродиализ по-прежнему в основном используется в доклинических исследованиях на животных (например, на лабораторных грызунах, собаках, овцах, свиньях), в настоящее время он все чаще применяется у людей для мониторинга концентраций свободного, несвязанного лекарственного средства в тканях, а также интерстициальных концентраций регуляторных цитокинов и метаболитов в ответ на гомеостатические нарушения, такие как питание и/или физические упражнения. [21]
При исследовании мозга микродиализ обычно используется для измерения нейротрансмиттеров (например , дофамина , серотонина , норадреналина , ацетилхолина , [22] глутамат , ГАМК ) и их метаболиты, а также небольшие нейромодуляторы (например, цАМФ , цГМФ , NO ), аминокислоты (например, глицин , цистеин , тирозин ) и энергетические субстраты (например, глюкоза , лактат , пируват ). Экзогенные лекарства, подлежащие анализу с помощью микродиализа, включают новые антидепрессанты , нейролептики , а также антибиотики и многие другие лекарства, фармакологическое действие которых локализовано в головном мозге. Первым неметаболитом, который был проанализирован с помощью микродиализа in vivo в мозге человека, был рифампицин . [23] [24] [25]
Применение в других органах включает кожу (оценка биодоступности и биоэквивалентности дерматологических лекарственных средств местного применения), [26] и мониторинг концентрации глюкозы у больных сахарным диабетом (внутрисосудистое или подкожное введение зонда). Последний может даже быть включен в систему искусственной поджелудочной железы для автоматического введения инсулина.
Микродиализ также находит все большее применение в исследованиях окружающей среды. [27] отбор проб различных соединений из сточных вод и почвенных растворов, включая сахариды, [28] ионы металлов, [29] микроэлементы, [30] органические кислоты, [31] и низкомолекулярный азот. [32] Учитывая разрушительный характер традиционных методов отбора проб почвы, [33] Микродиализ имеет потенциал для оценки потоков почвенных ионов, которые лучше отражают ненарушенную почвенную среду.
Критический анализ
[ редактировать ]Преимущества
[ редактировать ]- На сегодняшний день микродиализ является единственным методом отбора проб in vivo , который позволяет непрерывно контролировать концентрацию лекарственного средства или метаболита во внеклеточной жидкости практически любой ткани. В зависимости от конкретного применения концентрации аналита можно контролировать в течение нескольких часов, дней или даже недель. Свободные, несвязанные концентрации во внеклеточной ткани во многих случаях представляют особый интерес, поскольку они напоминают фармакологически активные концентрации в месте действия или вблизи него. Сочетание микродиализа с современными методами визуализации, такими как позитронно-эмиссионная томография , дополнительно позволяет определять внутриклеточные концентрации.
- Введение зонда в точное место выбранной ткани дополнительно позволяет оценить градиенты внеклеточной концентрации из-за активности транспортера или других факторов, таких как различия в перфузии. Поэтому он был предложен как наиболее подходящий метод для исследования распределения тканей.
- Обмен аналита через полупроницаемую мембрану и постоянная замена жидкости для отбора проб свежим перфузатом предотвращает дренаж жидкости из места отбора проб, что позволяет проводить отбор проб без потери жидкости. Следовательно, микродиализ можно использовать, не нарушая состояние тканей за счет локальной потери жидкости или артефактов давления, которые могут возникать при использовании других методов, таких как микроинъекция или двухтактная перфузия.
- Полупроницаемая мембрана предотвращает попадание клеток, клеточного мусора и белков в диализат. Из-за отсутствия белка в диализате очистка образца перед анализом не требуется, и ферментативная деградация не вызывает беспокойства.
Ограничения
[ редактировать ]- Несмотря на научные достижения в уменьшении размеров и повышении эффективности микродиализных зондов, инвазивный характер этого метода по-прежнему накладывает некоторые практические и этические ограничения. Например, было показано, что имплантация зонда для микродиализа может изменить морфологию тканей , что приводит к нарушению микроциркуляции, скорости метаболизма или целостности физиологических барьеров, таких как гематоэнцефалический барьер . [34] Хотя острые реакции на введение зонда, такие как травмы при имплантации, требуют достаточного времени для восстановления, дополнительные факторы, такие как некроз , воспалительные реакции, [21] При долгосрочном отборе проб необходимо учитывать процессы заживления ран, поскольку они могут повлиять на результат эксперимента. С практической точки зрения было предложено проводить эксперименты по микродиализу в оптимальное время, обычно через 24–48 часов после введения зонда. [35] [36]
- Микродиализ имеет относительно низкое временное и пространственное разрешение по сравнению, например, с электрохимическими биосенсорами . В то время как временное разрешение определяется длительностью интервалов отбора проб (обычно несколько минут), пространственное разрешение определяется размерами зонда. Размер зонда может варьироваться в зависимости от области применения и охватывает диапазон от нескольких миллиметров (внутримозговое применение) до нескольких сантиметров ( подкожное применение) в длину и несколько сотен микрометров в диаметре. [ нужна ссылка ]
- Применение метода микродиализа часто ограничивается определением восстановления зонда, особенно для in vivo экспериментов . Определение восстановления может занять много времени и потребовать дополнительных субъектов или пилотных экспериментов. Извлечение во многом зависит от дебита: чем ниже дебит, тем выше нефтеотдача. Однако на практике скорость потока нельзя уменьшать слишком сильно, так как либо объем полученной для анализа пробы окажется недостаточным, либо будет потеряно временное разрешение эксперимента. Поэтому важно оптимизировать взаимосвязь между скоростью потока и чувствительностью аналитического анализа. Ситуация может быть более сложной для липофильных соединений, поскольку они могут прилипать к трубкам или другим компонентам зонда, что приводит к низкому извлечению аналита или его отсутствию. [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г Чаурасия К.С., Мюллер М., Башоу Э.Д., Бенфельдт Э., Болиндер Дж., Буллок Р., Бунгей П.М., ДеЛанге Э.К., Дерендорф Х., Элмквист В.Ф., Хаммарлунд-Уденаес М., Джухадар К., Келлогг Д.Л., Лунте CE, Нордстром CH, Роллема Х., Савчук Р.Дж., Чунг Б.В., Шах В.П., Стале Л., Унгерстедт У., Велти Д.Ф., Йео Х. (май 2007 г.). «Информационный документ семинара AAPS-FDA: принципы микродиализа, перспективы применения и регулирования». Фармацевтические исследования . 24 (5): 1014–25. дои : 10.1007/s11095-006-9206-z . ПМИД 17458685 . S2CID 8087765 .
- ^ «Труды Физиологического общества». Журнал физиологии . 155 : 1–28. 1961. doi : 10.1113/jphysicalol.1961.sp006651 . S2CID 222200988 .
- ^ Бито Л., Дэвсон Х., Левин Э., Мюррей М., Снайдер Н. (ноябрь 1966 г.). «Концентрация свободных аминокислот и других электролитов в спинномозговой жидкости, диализате головного мозга in vivo и плазме крови собаки». Журнал нейрохимии . 13 (11): 1057–67. дои : 10.1111/j.1471-4159.1966.tb04265.x . ПМИД 5924657 . S2CID 32976369 .
- ^ Jump up to: а б Дельгадо Дж. М., ДеФеудис Ф. В., Рот Р. Х., Рюго Д. К., Митрука Б. М. (1972). «Диалитрод для долгосрочной внутримозговой перфузии у бодрствующих обезьян». Archives Internationales de Pharmacodynamie et de Therapie . 198 (1): 9–21. ПМИД 4626478 .
- ^ Унгерстедт У, Пикок К. (июль 1974 г.). «Функциональные корреляты нейротрансмиссии дофамина». Бюллетень Швейцарской академии медицинских наук . 30 (1–3): 44–55. ПМИД 4371656 .
- ^ Ли, Туо; Ян, Хуэй; Ли, Син; Хоу, Иньчжу; Чжао, Яо; У, Вэньцзин; Чжао, Линъюй; Ван, Фуйи; Чжао, Чжэньвэнь (2021). «Микроперфузия с открытым потоком в сочетании с масс-спектрометрией для липидомного анализа печени in vivo» . Аналитик . 146 (6): 1915–1923. Бибкод : 2021Ана...146.1915Л . дои : 10.1039/D0AN02189J . ISSN 0003-2654 . ПМИД 33481970 . S2CID 231689183 .
- ^ Боденленц, Манфред; Хёфферер, Кристиан; Магнес, Кристоф; Шаллер-Амманн, Роланд; Шаупп, Лукас; Файхтнер, Франц; Ратцер, Мария; Пикл, Карин; Грешник, Фрэнк; Вутте, Андреа; Корсатко, Стефан (август 2012 г.). «Дермальная ФК/ПД липофильного препарата для местного применения у пациентов с псориазом путем непрерывного внутрикожного бесмембранного отбора проб» . Европейский журнал фармацевтики и биофармацевтики . 81 (3): 635–641. дои : 10.1016/j.ejpb.2012.04.009 . ПМИД 22554768 .
- ^ Боденленц, Манфред; Хёфферер, Кристиан; Магнес, Кристоф; Шаллер-Амманн, Роланд; Шаупп, Лукас; Файхтнер, Франц; Ратцер, Мария; Пикл, Карин; Грешник, Фрэнк; Вутте, Андреа; Корсатко, Стефан (август 2012 г.). «Дермальная ФК/ПД липофильного препарата для местного применения у пациентов с псориазом путем непрерывного внутрикожного бесмембранного отбора проб» . Европейский журнал фармацевтики и биофармацевтики . 81 (3): 635–641. дои : 10.1016/j.ejpb.2012.04.009 . ISSN 0939-6411 . ПМИД 22554768 .
- ^ Альтендорфер-Крот, Томас; Шимек, Дениз; Эберл, Анита; Раутер, Гюнтер; Ратцер, Мария; Рамл, Рейнгард; Грешник, Фрэнк; Бирнгрубер, Томас (январь 2019 г.). «Сравнение церебральной микроперфузии с открытым потоком и микродиализа при отборе проб малых липофильных и малых гидрофильных веществ» . Журнал методов нейробиологии . 311 : 394–401. doi : 10.1016/j.jneumeth.2018.09.024 . ISSN 0165-0270 . ПМИД 30266621 . S2CID 52883354 .
- ^ Шаупп, Л.; Эллмерер, М.; Бруннер, Джорджия; Вутте, А.; Зендльхофер, Г.; Траяноски, З.; Скрабаль, Ф.; Пибер, ТР ; Вах, П. (1 февраля 1999 г.). «Прямой доступ к интерстициальной жидкости в жировой ткани у человека с помощью микроперфузии с открытым потоком» . Американский журнал физиологии. Эндокринология и обмен веществ . 276 (2): E401–E408. дои : 10.1152/ajpendo.1999.276.2.e401 . ISSN 0193-1849 . ПМИД 9950802 .
- ^ Эллмерер, Мартин; Шаупп, Лукас; Бруннер, Гернот А.; Зендльхофер, Джеральд; Вутте, Андреа; Вах, Пол; Пибер, Томас Р. (1 февраля 2000 г.). «Измерение интерстициального альбумина в скелетных мышцах и жировой ткани человека методом микроперфузии с открытым потоком» . Американский журнал физиологии. Эндокринология и обмен веществ . 278 (2): E352–E356. дои : 10.1152/ajpendo.2000.278.2.e352 . ISSN 0193-1849 . ПМИД 10662720 . S2CID 11616153 .
- ^ Драгатин, Кристиан; Полюс, Флорина; Боденленц, Манфред; Калондер, Клаудио; Айгнер, Биргит; Тиффнер, Катрин Ирен; Мадер, Юлия Катарина; Ратцер, Мария; Весснер, Ральф; Пибер, Томас Рудольф; Ченг, И (23 ноября 2015 г.). «Секукинумаб распределяется в дермальной интерстициальной жидкости пациентов с псориазом, что продемонстрировано с помощью микроперфузии с открытым потоком» . Экспериментальная дерматология . 25 (2): 157–159. дои : 10.1111/exd.12863 . ISSN 0906-6705 . ПМИД 26439798 .
- ^ Колбингер, Фрэнк; Леше, Кристиан; Валентин, Мари-Анн; Цзян, Сяоюй; Ченг, Йи; Джарвис, Филип; Питерс, Томас; Калондер, Клаудио; Брюин, Жерар; Полюс, Флорина; Айгнер, Биргит (март 2017 г.). «β-дефенсин 2 является чувствительным биомаркером патологии кожи, вызванной IL-17A, у пациентов с псориазом» . Журнал аллергии и клинической иммунологии . 139 (3): 923–932.e8. дои : 10.1016/j.jaci.2016.06.038 . ISSN 0091-6749 . ПМИД 27502297 .
- ^ Кляйнерт, Максимилиан; Коцбек, Петра; Альтендорфер-Крот, Томас; Бирнгрубер, Томас; Чоп, Матиас Х.; Клемменсен, Кристофер (декабрь 2019 г.). «Исправление к «Микроперфузия гипоталамуса с открытым потоком с разрешением по времени выявляет нормальный транспорт лептина через гематоэнцефалический барьер у мышей, устойчивых к лептину» [Molecular Metabolism 13 (2018) 77–82]» . Молекулярный метаболизм . 30 : 265. doi : 10.1016/j.molmet.2019.11.001 . ISSN 2212-8778 . ПМК 6889745 . ПМИД 31767178 .
- ^ Jump up to: а б с Шталь М., Боу Р., Джексон А., Пэй В. (июнь 2002 г.). «Человеческий микродиализ». Современная фармацевтическая биотехнология . 3 (2): 165–78. дои : 10.2174/1389201023378373 . ПМИД 12022259 .
- ^ Боу, М. Рене; Хаммарлунд-Уденаес, Маргарета (1998). «Методические аспекты применения калибратора при микродиализе in vivo – дальнейшее развитие метода ретродиализа» . Фармацевтические исследования . 15 (11): 1673–1679. дои : 10.1023/А:1011992125204 . ПМИД 9833986 . S2CID 11177946 .
- ^ Jump up to: а б Лённрот П., Янссон П.А., Смит У. (август 1987 г.). «Метод микродиализа, позволяющий охарактеризовать межклеточное водное пространство человека». Американский журнал физиологии . 253 (2 ч. 1): E228-31. дои : 10.1152/ajpendo.1987.253.2.E228 . ПМИД 3618773 . S2CID 5766876 .
- ^ Jump up to: а б с д Олсон Р.Дж., Судья Дж.Б. (2002). «Количественный микродиализ в переходных условиях». Аналитическая химия . 65 (8): 1017–1022. дои : 10.1021/ac00056a012 . ПМИД 8494171 .
- ^ Jump up to: а б Ван Ю, Вонг С.Л., Савчук Р.Дж. (октябрь 1993 г.). «Калибровка микродиализа с использованием ретродиализа и нулевого чистого потока: применение к исследованию распределения зидовудина в спинномозговой жидкости кролика и таламусе». Фармацевтические исследования . 10 (10): 1411–9. дои : 10.1023/А:1018906821725 . ПМИД 8272401 . S2CID 20232288 .
- ^ Бенвенист Х, Хюттемайер ПК (1990). «Микродиализ - теория и применение». Прогресс нейробиологии . 35 (3): 195–215. дои : 10.1016/0301-0082(90)90027-E . ПМИД 2236577 . S2CID 29998649 .
- ^ Jump up to: а б Карсон Б.П., МакКормак В.Г., Конвей С., Кук Дж., Сондерс Дж., О'Коннор В.Т., Джейкман П.М. (февраль 2015 г.). «Характеристика микродиализа in vivo временных изменений интерстициальной концентрации метаболитов и цитокинов в диализате в скелетных мышцах человека в ответ на введение зонда для микродиализа». Цитокин . 71 (2): 327–33. дои : 10.1016/j.cyto.2014.10.022 . ПМИД 25528289 .
- ^ Ёсикава М., Кавагути М. (апрель 2021 г.). «In vivo мониторинг высвобождения ацетилхолина из нервных окончаний слюнной железы» . Биология . 10 (5): 351. doi : 10.3390/biology10050351 . ПМЦ 8143079 . ПМИД 33919193 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Миндерманн Т., Циммерли В., Грацль О. (октябрь 1998 г.). «Концентрация рифампицина в различных отделах головного мозга человека: новый метод определения уровней препарата во внеклеточном пространстве головного мозга» . Антимикробные средства и химиотерапия . 42 (10): 2626–9. дои : 10.1128/aac.42.10.2626 . ПМЦ 105908 . ПМИД 9756766 .
- ^ Мюллер М., Дела Пенья А., Дерендорф Х. (май 2004 г.). «Вопросы фармакокинетики и фармакодинамики противоинфекционных средств: распределение в тканях» . Антимикробные средства и химиотерапия . 48 (5): 1441–53. doi : 10.1128/aac.48.5.1441-1453.2004 . ПМК 400530 . ПМИД 15105091 .
- ^ Чефер В.И., Томпсон А.С., Сапата А., Шиппенберг Т.С. (апрель 2009 г.). «Обзор микродиализа головного мозга» . Современные протоколы в неврологии . Глава 7: 7.1.1–7.1.28. дои : 10.1002/0471142301.ns0701s47 . ПМЦ 2953244 . ПМИД 19340812 .
- ^ Шмидт С., Бэнкс Р., Кумар В., Рэнд К.Х., Дерендорф Х. (март 2008 г.). «Клинический микродиализ кожи и мягких тканей: обновленная информация». Журнал клинической фармакологии . 48 (3): 351–64. дои : 10.1177/0091270007312152 . ПМИД 18285620 . S2CID 12379638 .
- ^ Миро М., Френцель В. (2005). «Потенциал микродиализа как метода автоматической обработки проб для исследований окружающей среды». TrAC Тенденции в аналитической химии . 24 (4): 324–333. дои : 10.1016/j.trac.2004.10.004 .
- ^ Торто Н., Лобело Б., Гортон Л. (2000). «Определение сахаридов в сточных водах производства напитков с помощью микродиализа, микрокапиллярной высокоэффективной анионообменной хроматографии и интегрированного импульсного электрохимического обнаружения». Аналитик . 125 (8): 1379–1381. Бибкод : 2000Ана...125.1379Т . дои : 10.1039/b004064i .
- ^ Торто Н., Мвацетеза Дж., Савула Г. (2002). «Исследование микродиализного отбора ионов металлов». Аналитика Химика Акта . 456 (2): 253–261. Бибкод : 2002AcAC..456..253T . дои : 10.1016/S0003-2670(02)00048-X .
- ^ Хамфри, О.С., Янг, С.Д., Краут, Н.М., Бэйли, Э.Х., Андер, Э.Л., и Уоттс, М.Дж. (2020). Кратковременная динамика йода в почвенном растворе. Экологические науки и технологии, 54 (3), 1443–1450.
- ^ Сулёк М., Миро М., Стингедер Г., Келленспергер Г. (август 2005 г.). «Возможности проточного микродиализа для исследования низкомолекулярных органических анионов в почвенном растворе ризосферы». Аналитика Химика Акта . 546 (1): 1–10. Бибкод : 2005AcAC..546....1S . дои : 10.1016/j.aca.2005.05.027 . ПМИД 29569545 .
- ^ Инзельсбахер, Эрих; Олунд, Йонас; Ямтгорд, Сандра; Хасс-Данелл, Керстин; Нэшхольм, Торгни (2011). «Потенциал микродиализа для мониторинга органических и неорганических соединений азота в почве». Биология и биохимия почвы . 43 (6): 1321–1332. Бибкод : 2011SBiBi..43.1321I . doi : 10.1016/j.soilbio.2011.03.003 .
- ^ Инзельсбахер, Эрих (2014). «Восстановление отдельных форм почвенного азота после просеивания и экстракции». Биология и биохимия почвы . 71 : 76–86. Бибкод : 2014SBiBi..71...76I . doi : 10.1016/j.soilbio.2014.01.009 .
- ^ Морган М.Э., Сингхал Д., Андерсон Б.Д. (май 1996 г.). «Количественная оценка повреждения гематоэнцефалического барьера при микродиализе». Журнал фармакологии и экспериментальной терапии . 277 (2): 1167–76. ПМИД 8627529 .
- ^ Ди Кьяра Дж., Танда Дж., Карбони Э. (ноябрь 1996 г.). «Оценка высвобождения нейромедиаторов in vivo с помощью микродиализа головного мозга: вопрос достоверности». Поведенческая фармакология . 7 (7): 640–657. дои : 10.1097/00008877-199611000-00009 . ПМИД 11224460 .
- ^ Дасма Г., Вестеринк Б.Х., Императо А., Роллема Х., де Врис Дж.Б., Хорн А.С. (август 1987 г.). «Автоматический диализ ацетилхолина головного мозга у свободно движущихся крыс: обнаружение базального ацетилхолина». Науки о жизни . 41 (7): 873–6. дои : 10.1016/0024-3205(87)90695-3 . ПМИД 3613848 .