орто -карборан

| |
 Загрязненный ортокарборан
| |
| Имена | |
|---|---|
| Другие имена
1,2-Дикарбадодекаборан(12), орто -дикарбадодекаборан
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.037.164 |
| Номер ЕС |
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 2 Ч 12 Б 10 | |
| Молярная масса | 144.22 g·mol −1 |
| Появление | бесцветное твердое вещество |
| Температура плавления | 320 ° С (608 ° F; 593 К) |
| Опасности | |
| СГС Маркировка : | |
 
| |
| Предупреждение | |
| Х228 , Х302 , Х312 , Х332 | |
| P210 , P240 , P241 , P261 , P264 , P270 , P271 , P280 , P301+P312 , P302+P352 , P304+P312 , P304+P340 , P312 , P322 , P330 , P363 , П370+П378 , П501 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
орто -Карборан представляет собой борорганическое соединение формулы C 2 B 10 H 12 . Префикс орто происходит от орто . Это наиболее известный карборан . Это производное рассматривалось для широкого спектра применений: от термостойких полимеров до медицинских применений. Это бесцветное твердое вещество, плавящееся без разложения при 320 °C.
Структура
[ редактировать ]Кластер имеет симметрию C 2v . [ 1 ]
Подготовка
[ редактировать ]Ортокарборан получают присоединением ацетиленов к декаборану(14) . Современные синтезы включают две стадии, первая из которых включает образование аддукта декаборана: [ 2 ] [ 3 ]
- Б 10 Ч 14 + 2 SEt 2 → B 10 H 12 (SEt 2 ) 2 + H 2
На втором этапе алкин устанавливается как источник двух углеродных вершин: [ 3 ]
- B 10 H 12 (SEt 2 ) 2 + C 2 H 2 → C 2 B 10 H 12 + 2 SEt 2 + H 2
Замещенные ацетилены можно использовать более удобно, чем газообразный ацетилен. Например, бис(ацетоксиметил)ацетилен легко присоединяется к декарборану.
- B 10 H 12 (SEt 2 ) 2 + C 2 (CH 2 O 2 CCH 3 ) 2 → C 2 B 10 H 10 (CH 2 O 2 CCH 3 ) 2 + 2 SEt 2 + H 2
Органические заместители удаляют гидролизом сложного эфира с последующим окислением: [ 2 ]
- 3 C 2 B 10 H 10 (CH 2 O 2 CH 3 ) 2 + 10 KOH + + 8 KMnO 4 → 3 C 2 B 10 H 12 + 6 CH 3 CO 2 K + 8 MnO 2 + 6 K 2 CO 3 + 8 Н 2 О
Реакции
[ редактировать ]Термическая перегруппировка
[ редактировать ]При нагревании до 420°С он перегруппировывается с образованием мета-изомера. Пара-изомер получают нагреванием до температуры выше 600 °C.

Восстановление и «обратная изомеризация»
[ редактировать ]орто-карборан претерпевает 2е-восстановление при обработке раствором лития в аммиаке. В результате образуется нидо-кластер 7,9-[C 2 B 10 H 12 ] 2- . В дианионе углеродные вершины не соседствуют. Тот же кластер образуется восстановлением метакарборана. Окисление образующегося 7,9-[C 2 B 10 H 12 ] 2- дает орто-карборан. [ 4 ]
Депротонирование
[ редактировать ]Обработка литийорганическими реагентами дает дилитиопроизводное. [ 5 ]
- C 2 B 10 H 12 + 2 BuLi → Li 2 C 2 B 10 H 10 + 2 BuH
Это дилитированное соединение реагирует с различными электрофилами, например, с хлорфосфинами, хлорсиланами и серой. [ 6 ]
Разложение оснований до дикарболлида
[ редактировать ]Базовая деградация орто-карборана дает анионное производное с 11 вершинами, предшественник дикарболлидных комплексов: [ 7 ]
- C 2 B 10 H 12 + NaOEt + 2 EtOH → Na + С 2 Б 9 Ч 12 − + Н 2 + Б(ОЭт) 3
- Уже + С 2 Б 9 Ч 12 − + NaH → Na 2 C 2 B 8 H 11 + H 2
Дикарболлиды (C 2 B 8 H 11 2- ) действуют как лиганды для переходных металлов и f-элементов. [ 8 ] Дианион образует сэндвичевые соединения – бис(дикарболлиды). Дикарболлиды, будучи сильными донорами электронов, стабилизируют высшие степени окисления, например Ni(IV).
Депротонирование карборана
[ редактировать ]Вершины CH клозо -дикарбадодекаборанов подвергаются депротонированию при обработке литийорганическими реагентами: [ 9 ]
- C 2 B 10 H 12 + 2 BuLi → Li 2 C 2 B 10 H 10 + 2 BuH
Эти дилитированные соединения реагируют с различными электрофилами, например, с хлорфосфинами, хлорсиланами и серой. [ 10 ] Многие из тех же соединений можно получить гидроборированием алкинов:
- Li 2 C 2 B 10 H 10 + 2 RX → R 2 C 2 B 10 H 10 + 2 LiX
- L 2 B 10 H 10 + RC 2 R → R 2 C 2 B 10 H 10 + 2 L (L = MeCN и т. д.)
орто-карборан можно превратить в высокореактивные карборины формулы B 10 C 2 H 10 .
Замена в вершинах бора
[ редактировать ]В отличие от атомов водорода на углеродных вершинах, атомы водорода на борных вершинах не являются кислотными и не реагируют с сильными основаниями. Это связано с тем, что бор не так электроотрицательен, как углерод, и поэтому полярность связей B—H относительно низкая. Замещение в вершинах бора все еще возможно с использованием галогенирующих агентов посредством электрофильного замещения или фотохимических реакций. [ 11 ]
Например, борные вершины в положениях 9 и 12, противоположные углеродным вершинам, можно иодировать с использованием йода и каталитического количества AlCl 3 при кипячении дихлорметана. [ 12 ]

Экзоэдрическое галогенирование приводит к усилению электроноакцепторного эффекта карборана, что повышает кислотность связей С—Н, особенно когда галогены расположены в положениях 9 и 12. [ 13 ] Также возможно пергалогенирование, и при увеличении числа атомов галогенида π-обратная способность галогенида уменьшается, что позволяет образовывать внутримолекулярные нековалентные связи галогенид-галогенид. [ 14 ]

Йодированные производные карборана можно дополнительно модифицировать для получения доступа к алкилированным продуктам бора посредством реакции перекрестного сочетания. Это можно сделать, обработав галогенированный карборан реактивом Гриньяра в присутствии фосфин-палладиевого комплекса. Соединения брома и хлора не реагируют в одинаковых условиях. [ 15 ]
Димеризация карборана
[ редактировать ]
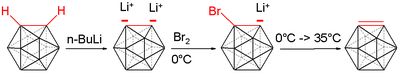
При обработке орто-карборанов литийорганическими реагентами, такими как н-бутиллитий, вершины CH карборанового каркаса могут быть депротонированы, образуя дилитированный орто-карборановый каркас. Воспользовавшись преимуществами этой более активной связи углерод-литий, металлизированные карборановые каркасы затем можно обработать хлоридом меди (I) в органических растворителях, что приводит к опосредованной медью реакции сочетания углерода с углеродом карборановых каркасов. Соль меди необходима, чтобы избежать нежелательных реакций сочетания углерод-бор и бор-бор. Реакционной смеси дают перемешиваться при комнатной температуре в течение двух дней, образуя карборановый каркас, содержащий металлическую медь. Наконец, смесь обрабатывают 3М соляной кислотой для гашения реакционного процесса. Затем неочищенный продукт очищают колоночной хроматографией и получают один полуэквивалент димера, связанного углерод-углеродной связью, исходного орто-карборана с высокими выходами. Стоит отметить влияние донорских растворителей на выходы реакций, поскольку выходы растворителей, таких как тетрагидрофуран и диэтиловый эфир дают продукт со значительно меньшими выходами. [ 16 ]
История
[ редактировать ]О получении клозо-дикарбадодекаборанов независимо сообщили группы Olin Corporation и подразделения Reaction Motors Thiokol Chemical Corporation, работающие при ВВС США , и опубликовали их в 1963 году. Эти группы продемонстрировали высокую стабильность на воздухе 1,2-клозо-додекаборана. и родственных соединений, представлен общий синтез, описана трансформация заместителей без разрушения карборанового кластера и продемонстрирована орто-изомеризация в мета-изомеризацию. [ 17 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Дэвидсон, МГ; Хибберт, Т.Г.; Ховард, JAK; Маккиннон, А.; Уэйд, К. (1996). «Определенные кристаллические структуры орто-, мета- и пара-карборанов: супрамолекулярные структуры, управляемые исключительно водородной связью C – H⋯O с гмпа (гмпа = гексаметилфосфорамид)». хим. Коммун. (19): 2285–2286. дои : 10.1039/CC9960002285 .
- ^ Jump up to: а б Чарльз Р. Кутал Дэвид А. Оуэн Ли Дж. Тодд (1968). « Клозо -1,2-Дикарбадодекаборан(12): [ 1,2-Дикарбакловододекаборан(12 )]». Неорганические синтезы . Том. 11. С. 19–24. дои : 10.1002/9780470132425.ch5 . ISBN 978-0-470-13170-1 .
- ^ Jump up to: а б М. Фредерик Хоторн; Тимоти Д. Эндрюс; Филип М. Гарретт; Фред П. Олсен; Мартен Рейнджес; Фред Н. Теббе; Лес Ф. Уоррен; Патрик А. Вегнер; Дональд К. Янг (1967). «Икосаэдрические карбораны и промежуточные соединения, ведущие к получению карбаметаллических производных гидрида бора». Неорганические синтезы . Том. 10. С. 91–118. дои : 10.1002/9780470132418.ch17 . ISBN 978-0-470-13241-8 .
- ^ Рассел Н. Граймс (2016). «10. Икосаэдрические карбораны: 1,7-С 2 В 10 Н 12 и 1,12-С 2 В 10 Н 12 ». Карбораны, 3-е издание . Эльзевир. ISBN 978-0-12-801905-4 .
- ^ Попеску, А.-Р.; Мусстети, АД; Феррер-Угальде, А.; Виньяс, К.; Нуньес, Р.; Тейксидор, Ф. (2012). «Влиятельная роль эфирного растворителя на литийорганических соединениях: случай карбораниллития». Химия – Европейский журнал . 18 (11): 3174–3184. дои : 10.1002/chem.201102626 . ПМИД 22334417 .
- ^ Джин, Г.-Х. (2004). «Достижения химии металлоорганических комплексов с 1,2-дихалькогенолато-о-карборановыми лигандами». Коорд. хим. Преподобный . 248 (7–8): 587–602. дои : 10.1016/j.ccr.2004.01.002 .
- ^ Плешек Ю.; Хержманек, С.; Штибр, Б. (1983). «Додекагидро-7,8-дикарбанидо-ундекаборат калия (1-), k[7,8-c2 b9 h12 ], промежуточные продукты, маточный раствор и безводная соль». Додекагидро-7,8-дикарбанидо-ундекаборат калия ( 1-), k[7,8-C 2 B 9 H 12 ], промежуточные продукты, маточный раствор и безводная соль . Неорганические синтезы. Том. 22. С. 231–234. дои : 10.1002/9780470132531.ch53 . ISBN 978-0-470-13253-1 .
- ^ Хоторн, МФ; Янг, округ Колумбия; Вегнер, Пенсильвания (1965). «Производные карбаметаллического боргидрида. I. Очевидные аналоги ферроцена и иона феррициния». Журнал Американского химического общества . 87 (8): 1818–1819. дои : 10.1021/ja01086a053 .
- ^ Попеску, А.-Р.; Мусстети, АД; Феррер-Угальде, А.; Виньяс, К.; Нуньес, Р.; Тейксидор, Ф. (2012). «Влиятельная роль эфирного растворителя на литийорганических соединениях: случай карбораниллития». Химия – Европейский журнал . 18 (11): 3174–3184. дои : 10.1002/chem.201102626 . ПМИД 22334417 .
- ^ Джин, Г.-Х. (2004). «Достижения химии металлоорганических комплексов с 1,2-дихалькогенолато-о-карборановыми лигандами». Коорд. хим. Преподобный . 248 (7–8): 587–602. дои : 10.1016/j.ccr.2004.01.002 .
- ^ Граймс, Рассел Н. (2016). Карбораны (Третье изд.). Амстердам Бостон Гейдельберг: Elsevier, Academic Press. ISBN 978-0-12-801894-1 .
- ^ Эндрюс, Джон С.; Заяс, Хосе; Джонс, Мейтленд (октябрь 1985 г.). «9-Йод-о-карборан» . Неорганическая химия . 24 (22): 3715–3716. дои : 10.1021/ic00216a053 . ISSN 0020-1669 .
- ^ Сиваев Игорь Б.; Ануфриев Сергей А.; Шмалько Аким В. (март 2023 г.). «Как заместители при атомах бора влияют на CH-кислоту и электроноакцепторный эффект орто-карборанового каркаса: внимательный взгляд на спектры ЯМР 1H» . Неорганика Химика Акта . 547 : 121339. doi : 10.1016/j.ica.2022.121339 .
- ^ Поттер, Джордж; Эскайола, Сильвия; Поутер, Альберт; Уивер, Франческ; Оттоссон, Хенрик; Виньяс, Клара; Сола, Микель (18 октября 2023 г.). «Одиночная — не двойная — 3D-ароматика в окисленном клозо-икосаэдрическом кластере додекайодо-додекабората» . Журнал Американского химического общества . 145 (41): 22527–22538. дои : 10.1021/jacs.3c07335 . ISSN 0002-7863 . ПМЦ 10591335 . ПМИД 37728951 .
- ^ Ли, Цзи; Логан, Кэмерон Ф.; Джонс, Мейтленд (декабрь 1991 г.). «Простые синтезы и реакции алкилирования 3-йод-о-карборана и 9,12-дииод-о-карборана» . Неорганическая химия . 30 (25): 4866–4868. дои : 10.1021/ic00025a037 . ISSN 0020-1669 .
- ^ Рен, Сикуо; Се, Цзовэй (13 октября 2008 г.). «Простой и практичный путь синтеза 1,1'-бис(о-карборана)» . Металлоорганические соединения . 27 (19): 5167–5168. дои : 10.1021/om8005323 . ISSN 0276-7333 .
- ^ Привет, ТЛ; Агер, Дж.В.; Кларк, СЛ; Мангольд, диджей; Гольдштейн, Х.Л.; Хиллман, М.; Полак, Р.Дж.; Шимански, JW (1963). «Новая серия органоборанов. I. Карбораны из реакции декаборана с ацетиленовыми соединениями». Неорганическая химия . 2 (6): 1089–1092. дои : 10.1021/ic50010a002 .