Домен гистидинового фосфопереноса
| Домен гистидинового фосфопереноса | |||
|---|---|---|---|
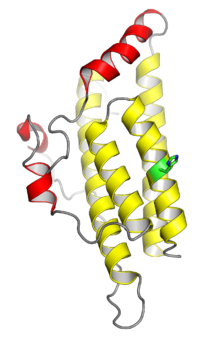 Кристаллическая структура дрожжевого белка гистидинфосфотрансферазы Ypd1 . Четыре спирали, показанные желтым цветом, представляют собой консервативный пучок из четырех спиралей, типичный для мономерных доменов HPt; спирали, показанные красным, представляют собой вставки, специфичные для Ypd1. Сайт фосфорилирования гистидина показан зеленым цветом. Из PDB : 1C02 . [ 1 ] | |||
| Идентификаторы | |||
| Символ | Hpt | ||
| Пфам | PF01627 | ||
| ИнтерПро | ИПР008207 | ||
| УМНЫЙ | ВДТ | ||
| PROSITE | PS50894 | ||
| |||
| Гистидинфосфотрансфераза | |||
|---|---|---|---|
 Кристаллическая структура Caulobacter crescentus белка гистидинфосфотрансферазы ChpT в димерной форме. Четыре спирали, показанные желтым цветом, составляют консервативный пучок из четырех спиралей, при этом сайты фосфорилирования гистидина выделены зеленым. Домены, показанные красным и коричневым, представляют собой домены псевдо-СА, которые напоминают АТФ-связывающие домены гистидинкиназ, но не связывают и не гидролизуют АТФ. Из PDB : 4FMT . [ 2 ] | |||
| Идентификаторы | |||
| Символ | HPТрансфаза | ||
| Пфам | PF10090 | ||
| ИнтерПро | ИПР018762 | ||
| |||
Домены гистидинфосфотрансферазы и гистидинфосфотрансферазы (обе часто обозначаются сокращенно HPt ) представляют собой белковые домены, участвующие в «фосфоррелейной» форме двухкомпонентных регуляторных систем . Эти белки обладают фосфорилируемым остатком гистидина и ответственны за перенос фосфорильной группы с остатка аспартата на промежуточном «приемнике» домена , обычно являющегося частью гибридной гистидинкиназы , на аспартат на регуляторе конечного ответа .
Функция
[ редактировать ]При традиционной двухкомпонентной передаче сигналов гистидинкиназы белок аутофосфорилируется по остатку гистидина в ответ на внеклеточный сигнал, а фосфорильная группа впоследствии переносится на остаток аспартата в принимающем домене регулятора ответа . В фосфореле «гибридная» гистидинкиназа содержит внутренний аспартатсодержащий ресиверный домен, на который переносится фосфорильная группа, после чего белок HPt, содержащий фосфорилируемый гистидин, получает фосфорильную группу и, наконец, передает ее регулятору ответа. Таким образом, система реле развивается в порядке His-Asp-His-Asp, причем второй His вносится Hpt. [ 3 ] [ 4 ] [ 5 ] В некоторых случаях система фосфорелея построена из четырех отдельных белков, а не из гибридной гистидинкиназы с внутренним доменом-приемником, а в других примерах как приемник, так и домены HPt присутствуют в полипептидной цепи гистидинкиназы. [ 6 ] : 198 Перепись архитектуры доменов двухкомпонентной системы показала, что домены HPt у бактерий чаще встречаются как домены более крупных белков, чем как отдельные белки. [ 4 ]
Регулирование
[ редактировать ]Повышенная сложность фосфорелечной системы по сравнению с ортодоксальной двухкомпонентной сигнализацией обеспечивает дополнительные возможности регуляции и повышает специфичность ответа. [ 6 ] : 192 [ 7 ] Хотя между ортодоксальными двухкомпонентными системами очень мало перекрестных помех, фосфореле обеспечивают более сложные сигнальные пути; примеры включают раздвоенный путь с несколькими последующими выходами, как в случае Caulobacter crescentus ChpT HPt, участвующий в клеточного цикла , регуляции [ 2 ] или, альтернативно, пути, в которых более одной гистидинкиназы контролируют один регулятор ответа, такие как путь споруляции у Bacillus subtilis , что может вызывать сложные временные вариации. [ 8 ] В некоторых известных случаях существует дополнительная форма регуляции ферментов фосфогистидинфосфатазы , которые действуют на HPt, например, Escherichia coli белок SixA , который нацелен на ArcB . [ 6 ] : 206
Структура
[ редактировать ]
Функцию фосфопереноса гистидина могут выполнять белки, по крайней мере, с двумя различными архитектурами, оба из которых состоят из четырехспирального пучка , но различаются способом сборки этого пучка. Большинство структурно охарактеризованных белков HPt, таких как домен Hpt белка coli ArcB Escherichia и Saccharomyces cerevisiae белка Ypd1 , образуют пучок в виде мономеров. [ 5 ] [ 2 ] В менее распространенных типах, таких как Bacillus subtilis споруляции фактор Spo0B или Caulobacter crescentus белок ChpT , пучок собран в виде белкового димера , имеющего сходство со структурой гистидинкиназ. [ 7 ] [ 2 ] Мономерные домены HPt содержат только один фосфорилируемый остаток гистидина и взаимодействуют с одним регулятором ответа, тогда как димеры имеют два сайта фосфорилирования и могут взаимодействовать с двумя регуляторами ответа одновременно. Мономерные домены HPt не обладают ферментативной активностью и действуют исключительно как фосфатные челноки. собственной [ 10 ] [ 4 ] тогда как димерный Spo0B является каталитическим; скорость его фосфопереноса к регулятору ответа реципиента значительно выше по сравнению с гистидинфосфатом. [ 11 ] Несмотря на наличие второго домена, имеющего некоторое сходство с доменами АТФазы , не было показано, что димерные белки HPt связывают или гидролизуют АТФ и не имеют ключевых остатков, присутствующих в других АТФазах. [ 2 ]
Мономерная и димерная формы не имеют обнаруживаемого сходства последовательностей и, скорее всего, не связаны эволюционно; вместо этого они являются примерами конвергентной эволюции . [ 2 ] Хотя димерные HPts, вероятно, происходят от вырожденных гистидинкиназ, возможно, что мономерные HPts имеют несколько различных источников происхождения, поскольку в структуре существует мало эволюционных ограничений. [ 3 ]
Распределение
[ редактировать ]У бактерий , где двухкомпонентная передача сигналов чрезвычайно распространена, около 25% известных гистидинкиназ относятся к гибридному типу. Двухкомпонентные системы гораздо реже встречаются у архей и эукариот , встречаются у низших эукариот и у растений, но не у многоклеточных животных . Среди известных примеров большинство, если не все, эукариотические двухкомпонентные системы представляют собой гибридные киназные фосфорелезы. [ 3 ]
Биоинформационная , перепись бактериальных геномов выявила большие различия в количестве (мономерных) доменов HPt, идентифицированных в разных типах бактерий при этом некоторые геномы вообще не кодируют HPt. По сравнению с количеством гистидинкиназ и регуляторов ответа, присутствующих в геноме, эукариоты имеют больше идентифицируемых доменов HPt, чем бактерии. [ 12 ] У грибов геномный набор белков HPt варьируется: мицелиальные грибы обычно содержат больше белков HPt, чем дрожжи ; только один из них закодирован в хорошо изученном геноме Saccharomyces cerevisiae . Растения обычно имеют более одного HPt, но меньше HPt, чем регуляторы реакции. [ 4 ] [ 10 ]
Ссылки
[ редактировать ]- ^ Сон Х.К., Ли Дж.И., Ли М.Г., Мун Дж., Мин К., Ян Дж.К., Су С.В. (ноябрь 1999 г.). «Понимание эукариотической многоступенчатой передачи сигнала фосфореле, выявленное с помощью кристаллической структуры Ypd1p из Saccharomyces cerevisiae». Журнал молекулярной биологии . 293 (4): 753–61. дои : 10.1006/jmbi.1999.3215 . ПМИД 10543964 .
- ^ Jump up to: а б с д и ж Блэр Дж.А., Сюй Кью, Чайлдерс В.С., Мэтьюз II, Керн Дж.В., Эккарт М., Дикон А.М., Шапиро Л. (сентябрь 2013 г.). «Разветвленная сигнальная проводка важного белка-фосфопереносчика бактериального клеточного цикла» . Структура . 21 (9): 1590–601. дои : 10.1016/j.str.2013.06.024 . ПМЦ 3787845 . ПМИД 23932593 .
- ^ Jump up to: а б с Капра Э.Дж., Лауб М.Т. (2012). «Эволюция систем передачи двухкомпонентных сигналов» . Ежегодный обзор микробиологии . 66 : 325–47. doi : 10.1146/annurev-micro-092611-150039 . ПМК 4097194 . ПМИД 22746333 .
- ^ Jump up to: а б с д Суруджон Д., Ратнер Д.И. (2016). «Использование вероятностного поиска мотивов для идентификации белков, содержащих гистидинфосфотрансферный домен» . ПЛОС ОДИН . 11 (1): e0146577. Бибкод : 2016PLoSO..1146577S . дои : 10.1371/journal.pone.0146577 . ПМК 4709007 . ПМИД 26751210 .
- ^ Jump up to: а б Сюй К, Карлтон Д., Миллер М.Д., Элслигер М.А., Кришна С.С., Абдубек П., Астахова Т., Бурра П., Чиу Х.Дж., Клейтон Т., Деллер М.С., Дуан Л., Элиас Ю., Фейерхельм Дж., Грант Дж.К., Гжечник А., Гжечник С.К. , Хан Г.В., Ярошевски Л., Джин К.К., Клок Х.Э., Кнут М.В., Козбиал П., Кумар А., Марчиано Д., Макмаллан Д., Морс А.Т., Нигогосян Е., Окач Л., Ооммачен С., Полсен Дж., Рейес Р., Райф К.Л., Шефчович Н., Трэм С., Траут К.В., ван ден Бедем Х., Уикс Д., Ходжсон К.О., Вули Дж., Дикон А.М., Годзик А., Лесли С.А., Уилсон И.А. (июль 2009 г.). «Кристаллическая структура белка-переносчика гистидина ShpA, важного регулятора биогенеза стебля Caulobacter crescentus» . Журнал молекулярной биологии . 390 (4): 686–98. дои : 10.1016/j.jmb.2009.05.023 . ПМК 2726009 . ПМИД 19450606 .
- ^ Jump up to: а б с Уитворт, Дэвид Э. (2012). «Двухкомпонентные регуляторные системы у прокариот». В Филлу, Ален AM (ред.). Бактериальные регуляторные сети . Норфолк, Великобритания: Caister Academic Press. стр. 191–222. ISBN 9781908230034 .
- ^ Jump up to: а б Варугезе К.И. (апрель 2002 г.). «Молекулярное распознавание бактериальных белков-фосфорелей». Современное мнение в микробиологии . 5 (2): 142–8. дои : 10.1016/s1369-5274(02)00305-3 . ПМИД 11934609 .
- ^ Салазар М.Е., Лауб М.Т. (апрель 2015 г.). «Временная и эволюционная динамика двухкомпонентных сигнальных путей» (PDF) . Современное мнение в микробиологии . 24 :7–14. дои : 10.1016/j.mib.2014.12.003 . hdl : 1721.1/105366 . ПМК 4380680 . ПМИД 25589045 .
- ^ Чжао X, Коупленд DM, Соарес А.С., Вест АХ (январь 2008 г.). «Кристаллическая структура комплекса между фосфорилирующим белком YPD1 и доменом регулятора ответа SLN1, связанным с фосфорильным аналогом» . Журнал молекулярной биологии . 375 (4): 1141–51. дои : 10.1016/j.jmb.2007.11.045 . ПМК 2254212 . ПМИД 18076904 .
- ^ Jump up to: а б Фасслер Дж.С., Западная Ага (август 2013 г.). «Гистидиновые фосфопереносящие белки в путях двухкомпонентной передачи сигнала грибов» . Эукариотическая клетка . 12 (8): 1052–60. дои : 10.1128/ec.00083-13 . ПМЦ 3754533 . ПМИД 23771905 .
- ^ Цапф Дж., Сен У., Хох Дж.А., Варугезе К.И. (август 2000 г.). «Переходное взаимодействие между двумя белками-фосфорелями, запертыми в кристаллической решетке, раскрывает механизм молекулярного распознавания и фосфопереноса при передаче сигнала» . Структура . 8 (8): 851–62. дои : 10.1016/s0969-2126(00)00174-x . ПМИД 10997904 .
- ^ Сальвадо Б., Вилаприньо Э., Соррибас А., Алвес Р. (2015). «Обзор доменов HK, HPt и RR и их организации в двухкомпонентных системах и фосфорилирующих белках организмов с полностью секвенированными геномами» . ПерДж . 3 : е1183. дои : 10.7717/peerj.1183 . ПМЦ 4558063 . ПМИД 26339559 .