Синаптическое ворота

Синаптическая вентиляция — это способность нейронных цепей блокировать входные сигналы, подавляя или облегчая специфическую синаптическую активность . Избирательное ингибирование определенных синапсов было тщательно изучено (см. Теорию боли «Ворота» ), а недавние исследования подтвердили существование пермиссивно-контролируемой синаптической передачи. В общем, синаптическая вентиляция включает в себя механизм центрального контроля над выходом нейронов. Он включает в себя своего рода нейрон- привратник , обладающий способностью влиять на передачу информации к выбранным целям независимо от частей синапса, на которые он оказывает свое действие (см. также нейромодуляция ).
Бистабильные нейроны обладают способностью колебаться между гиперполяризованным (состояние понижения) и деполяризованным (активное состояние) мембранным потенциалом покоя без активации потенциала действия . Таким образом, эти нейроны можно назвать нейронами вверх/вниз. Согласно одной из моделей, эта способность связана с наличием глутаматных рецепторов NMDA и AMPA . [1] Внешняя стимуляция рецепторов NMDA отвечает за перевод нейрона из состояния «вниз» в состояние «вверх», тогда как стимуляция рецепторов AMPA позволяет нейрону достичь и превзойти пороговый потенциал . Нейроны, обладающие этой бистабильной способностью, могут быть закрытыми, поскольку внешние нейроны-привратники могут модулировать мембранный потенциал закрытого нейрона, выборочно переводя их из активного состояния в нижнее состояние. Такие механизмы наблюдались в прилежащем ядре , при этом «привратники» возникают в коре головного мозга , таламусе и базальных ганглиях . [1]
Модель закрытого синапса
[ редактировать ]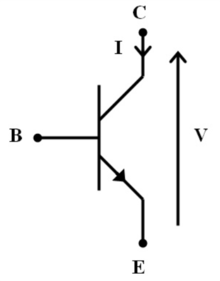
Модель закрытых синапсов изначально была получена из модели электронной схемы , в которой привратник служит транзистором в цепи. В цепи транзистор может действовать как переключатель, который включает или выключает электрический сигнал. Кроме того, транзистор может служить для усиления существующего тока в цепи. По сути, нейрон-привратник действует как транзистор закрытого синапса, модулируя передачу сигнала между пресинаптическим и постсинаптическим нейронами.
В модели закрытого синапса ворота по умолчанию либо открыты, либо закрыты. Таким образом, нейрон-привратник служит внешним переключателем ворот в синапсе двух других нейронов. Один из этих нейронов обеспечивает входной сигнал, а другой — выходной сигнал. Роль нейрона-привратника заключается в регулировании передачи входного сигнала на выход. При активации нейрон-привратник меняет полярность пресинаптического аксона, открывая или закрывая ворота. Если этот нейрон деполяризует пресинаптический аксон, он позволяет сигналу передаваться. Итак, ворота открыты. Гиперполяризация пресинаптического аксона закрывает ворота. Как и в транзисторе, нейрон-привратник включает или выключает систему; он влияет на выходной сигнал постсинаптического нейрона. Включится он или выключится, зависит от характера входного сигнала (возбуждающего или тормозного) от пресинаптического нейрона.
Торможение
[ редактировать ]Модуляция интернейронов
[ редактировать ]Гейтирование может происходить за счет шунтирующего торможения , при котором тормозные интернейроны изменяют проводимость мембраны возбуждающего целевого аксона, тем самым рассеивая его возбуждающий сигнал. [2] Стробирующий сигнал от привратника запускает эти тормозные интернейроны, чтобы предотвратить срабатывание одного набора нейронов даже при стимуляции другого набора. В этом состоянии ворота закрыты. [1] Примеры такого рода шлюзования были обнаружены в нейронах зрительной коры. [2] и области префронтальной коры (ПФК) у приматов, которые могут отвечать за подавление нерелевантных стимулов. [3] Исследования показывают, что этот вид торможения можно частично отнести на счет ГАМК . синапсов, опосредованных рецептором [2]
Чтобы эти тормозные интернейроны могли воздействовать на свои цели, они должны получать входной сигнал от сигнала привратника, который их стимулирует. Этот вход может быть внутренним, внешним или и тем, и другим. [4] Внешний входной сигнал поступает из области мозга, анатомически и функционально отличной от данной цепи, тогда как внутренний входной сигнал поступает из частей самой цепи. Как правило, этот вклад происходит в виде нейромодулирующих веществ, таких как гормоны, нейропептиды и другие нейротрансмиттеры, которые высвобождаются из входящих нейронов. [4] Эти сигналы затем сходятся на привратнике, где они интегрируются и направляются к цели. В зависимости от схемы сигналы ворота могут поступать из разных областей мозга. Например, исследования показали, что энторинальная кора может контролировать области медиальной префронтальной коры, тем самым препятствуя их проецированию в другие области мозга. [5]
Дополнительные исследования показали, что таламус также может выступать в качестве источника стробирующих сигналов. [6] На пути между ПФК и гиппокампом стимуляция медиодорсальных нейронов таламуса, а также стимуляция нейронов вентральной покрышки ингибировала активацию нейронов ПФК. [6] Было показано, что эти ингибирующие эффекты модулируются различными антагонистами дофаминовых рецепторов, что подразумевает некоторую роль дофамина в качестве нейромодулирующего агента в этом контуре.
Роль в пространственном внимании
[ редактировать ]Из-за ограниченной способности мозга обрабатывать информацию становится необходимым, чтобы мозг имел возможность фильтровать ненужную информацию и выбирать важную информацию. Входные данные, особенно в поле зрения, конкурируют за избирательное внимание . Модели механизмов пропускания в процессе внимания исследовались многими группами исследователей, однако единого мнения о роли синаптического пропускания во внимании достигнуто не было. [7] [8] [9]
Роль в рабочей памяти
[ редактировать ]Механизмы шлюзования в базальных ганглиях связаны с нашей способностью фильтровать ненужную информацию и получать доступ к важной информации из рабочей памяти. [10] В этом случае за функцию контроля отвечает таламус. Он открывает ворота между двумя областями коры головного мозга, позволяя стимулам влиять на рабочую память. Однако таламус тонически тормозится базальными ганглиями. Активация базальных ганглиев позволит растормозить таламус и, таким образом, открыть ворота. [1]
Разрешительные ворота
[ редактировать ]Запуск потенциала действия и, следовательно, высвобождение нейротрансмиттеров происходит с помощью этого вентильного механизма. При синаптическом стробировании для возникновения потенциала действия должно быть более одного входного сигнала, чтобы произвести один выходной сигнал в вентилируемом нейроне. Взаимодействие между этими наборами нейронов создает биологический вентиль И. [1] Закрываемый нейрон является бистабильным и должен быть переведен в активное состояние, прежде чем он сможет запустить потенциал действия. Когда этот бистабильный нейрон находится в активном состоянии, ворота открыты. Нейрон-привратник отвечает за стимуляцию бистабильного нейрона, переводя его из нижнего состояния в активное и, таким образом, открывая ворота. Как только ворота открыты, возбуждающий нейрон может вызвать дальнейшую деполяризацию бистабильного нейрона и достижение порога, вызывающего возникновение потенциала действия. Если привратник не сдвинет бистабильный нейрон снизу вверх, возбуждающий нейрон не сможет запустить потенциал действия в бистабильном нейроне. И привратный нейрон, и возбуждающий нейрон необходимы для запуска потенциала действия в бистабильном нейроне, но ни того, ни другого недостаточно для этого. [1]
Пример такого типа шлюзования может возникнуть в прилежащем ядре. Исследования показали, что нейроны гиппокампа могут контролировать передачу сигналов между префронтальной корой и прилежащим ядром. [11] Стимуляция нейронов префронтальной коры имеет очень малую вероятность вызвать потенциал действия в прилежащем ядре, пока эти нейроны находятся в выключенном состоянии. Аналогичным образом, стимуляция нейронов гиппокампа не приводит к созданию потенциалов действия в прилежащем ядре; однако было показано, что эти нейроны гиппокампа переключают свои цели в прилежащем ядре в активное состояние. Пока эти нейроны остаются в активном состоянии, стимуляция нейронов префронтальной коры имеет гораздо более высокую вероятность создания потенциалов действия в прилежащем ядре. [11] Таким образом, гиппокамп служит привратником для потока информации от префронтальной коры к прилежащему ядру, так что его действие разрешает ворота этих синапсов.
Синаптическая вентиляция включает в себя множество механизмов, с помощью которых модулируется эффективность активности нейронов. Дополнительные исследования демонстрируют разрешительные свойства синаптических ворот. [12] [13] [14] В некоторых случаях деполяризация мембраны вызывает открытие ворот, которые ранее оказывали тормозящее воздействие на нейрон, который они воротавали. Однако это разрешающее стробирование – это нечто большее, чем простое суммирование . Суммирование - это конвергенция многих ВПСП на аксонном холмике (либо от одного нейрона, активирующегося с высокой частотой, либо от многих нейронов, активирующихся одновременно), что деполяризует мембранный потенциал до пороговой точки. Деполяризация мембраны, вызванная открытием синаптических ворот, вызывает дополнительное увеличение внутриклеточного кальция, что способствует высвобождению нейромедиаторов; таким образом, он способен избирательно распространять информацию из пресинаптической клетки. [15]
Болезнь
[ редактировать ]Коморбидность СДВГ и тревоги
[ редактировать ]Исследования детей с диагнозом СДВГ показали значительно более высокие баллы по шкале тревожности/депрессии Контрольного списка поведения детей Ахенбаха . [16] что подразумевает коморбидность СДВГ и тревоги. Было высказано предположение, что основной причиной этого сопутствующего заболевания являются нарушения синаптических процессов в прилежащем ядре. [17] Этот дефект вызывает снижение синаптического пропускания дофамина из префронтальной коры и гиппокампа в прилежащее ядро. Одна теория предполагает, что этот дефект снижает способность человека избирательно подавлять реакцию страха со стороны миндалевидного тела, что приводит к тревоге. Однако существует несколько теорий о том, как это нарушение в конечном итоге влияет на людей с СДВГ. [17]
В исследованиях на грызунах префронтальная кора, в частности медиальная префронтальная кора (mPFC), участвовала в обработке информации продолжительностью от миллисекунд до нескольких секунд, тогда как гиппокамп участвовал в обработке информации в более длительных временных масштабах, например минут до часов. [18] Повреждение обеих этих областей у людей с СДВГ, по-видимому, иллюстрирует, почему они проявляют невнимательность и импульсивность. Нейроны прилежащего ядра бистабильны и, следовательно, могут избирательно переводиться либо в «верхнее» – деполяризованное состояние, либо в «нижнее» – гиперполяризованное состояние. Нейроны прилежащего ядра контролируются входными сигналами гиппокампа и миндалевидного тела, что создает деполяризованный нейрон прилежащего ядра, который более восприимчив к иннервации, поступающей из префронтальной коры. [19] Таким образом, у пациентов с СДВГ не только снижается входной сигнал от префронтальной коры к прилежащему ядру, но, кроме того, также снижается входной сигнал от гиппокампа к прилежащему ядру, что приводит к снижению активации нейронов прилежащего ядра. Люди, которые принимают лекарства, такие как метилфенидат (риталин), увеличивают выработку дофамина (ДА) во многих из этих синапсов, помогая компенсировать потерю синаптической активности, вызванную патофизиологией СДВГ. Прием метилфенидата может увеличить проекцию ДА на прилежащее ядро, что может не только увеличивать синаптическую активность между префронтальной корой и гиппокампом (улучшая память), но также действовать как система вознаграждения, поскольку прилежащее ядро является частью мезолимбического пути . [20] Более того, возможно, именно поэтому у людей, принимающих риталин, возникает «потребность» и «желание» учиться, поскольку он действует как положительное подкрепление в мозгу. Кроме того, активация этой схемы вознаграждения, скорее всего, является причиной того, что метилфенидат вызывает сильное привыкание и вызывает сильную зависимость. В заключение, синаптическая вентиляция иллюстрирует вероятный механизм, с помощью которого лекарства от СДВГ, такие как риталин, модулируют синаптическую активность и память.
Шизофрения
[ редактировать ]Люди, страдающие шизофренией, часто демонстрируют неспособность иллюстрировать контекстно-зависимую память , неспособность проявлять аффективную валентность – правильные эмоции, а также неспособность к концентрационным и временным процессам. [19] Синаптическая вентиляция, кажется, иллюстрирует, почему развиваются все эти неспособности. В частности, входные сигналы гиппокампа в прилежащее ядро, область базальных ганглиев, действуют как ворота, создавая более деполяризованное состояние внутри прилежащих нейронов, что позволяет им быть более восприимчивыми к иннервации из префронтальной коры (ПФК). Кроме того, вход миндалевидного тела во многом таким же образом действует как ворота, создавая более деполяризованное состояние внутри прилежащих нейронов, хотя это деполяризованное состояние гораздо более преходящее. В целом нейроны прилежащего ядра бистабильны. У людей, страдающих шизофренией, наблюдаются повреждения гиппокампа и миндалевидного тела, что свидетельствует о неправильном стробировании и приводит к тому, что нейроны прилежащего ядра оказываются в нижнем положении. Вот почему люди, страдающие шизофренией, демонстрируют неспособность к контекстно-зависимой памяти и неспособность проявлять надлежащую аффективную валентность. Кроме того, поскольку прилежащие нейроны находятся в нижнем положении, они не так восприимчивы к стимуляции ПФК, и поэтому у людей, страдающих шизофренией, наблюдаются проблемы с дефицитом внимания. Теория шлюзования шизофрении постулирует наличие бистабильного нейрона прилежащего ядра, неправильное открытие которого приводит к множеству нарушений поведения и памяти. [19]
Текущие и будущие исследования
[ редактировать ]Текущие исследования теперь пролили свет на тот факт, что бистабильность нейрона может быть частью более крупной бистабильной нейронной сети . [21] Доказательства существования бистабильной сети были продемонстрированы на интернейронах слуховой коры . Стабильные состояния этой сети слуховой коры либо синхронны, либо антисинхронны, что иллюстрирует ее бистабильную природу. Когда слуховые интернейроны были соединены с электрическими и химическими тормозными синапсами, наблюдалась бимодальная картина срабатывания. Этот бимодальный шаблон иллюстрирует бистабильность сети при срабатывании как в синхронном, так и в антисинхронном состоянии. Эти два состояния могут быть способами, с помощью которых человек воспринимает разные частоты звуковых волн. Будущие исследования направлены на то, чтобы выяснить, воплощает ли эта бистабильная сеть многие свойства бистабильного нейрона, и существует ли более крупный привратник, модулирующий сеть в целом.
Было показано, что нейроны прилежащего ядра способны быть закрытыми, поскольку они бистабильны. [19] Недавние данные показали, что нейроны коры также бистабильны и, следовательно, также могут быть закрытыми. По-видимому, существует три различных типа управляющих цепей: одна контролируется корой головного мозга, другая — ассоциативными ядрами таламуса и третья — цепями, охватывающими базальные ганглии, кору и таламус. Убедительные доказательства пришли к выводу, что выход из таламуса влияет на реакцию префронтальной коры со стороны гиппокампа. Это рассматривается либо как усиление, либо как подавление, иллюстрирующее бистабильность процесса. Доказано, что нейроны прилежащего ядра действуют как ворота, но действуют ли нейроны коры таким же образом? Будущие исследования будут направлены на изучение сходства между двумя наборами бистабильных нейронов. Кроме того, необходимо уточнить механизм перевода бистабильных нейронов в состояние «вниз». Это состояние приводит к торможению, и, следовательно, тормозные интернейроны модулируют этот сдвиг, и если да, то тормозные нейротрансмиттеры, такие как ГАМК задействована? Наконец, нейроны, способные модулировать ворота, такие как нейроны гиппокампа и таламуса, могут контактировать со многими различными областями мозга. Учитывая рост числа исследований, утверждающих, что нейроны в коре, прилежащем ядре и мозжечке могут быть закрытыми, может ли гиппокамп модулировать сигналы для всех этих нейронов, и если да, то может ли он соединить эти различные области мозга в гораздо более крупную нейронную сеть, способную модулируются все сразу? Именно эти вопросы лежат в основе синаптических шлюзов в будущем. [1]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г Букадум, Мунир; Гизигер, Томас (2011). «Механизмы, ограничивающие поток информации в коре головного мозга: как они могут выглядеть и каково их использование» . Границы вычислительной нейронауки . 5 : 1. дои : 10.3389/fncom.2011.00001 . ПМК 3025648 . ПМИД 21267396 .
- ^ Jump up to: а б с Борг-Грэм, LJ; Монье, К; Френьяк, Ю (1998). «Визуальный ввод вызывает кратковременное и сильное шунтирующее торможение в нейронах зрительной коры» . Природа . 393 (6683): 369–73. Бибкод : 1998Natur.393..369B . дои : 10.1038/30735 . ПМИД 9620800 . S2CID 1698876 .
- ^ Барбас, Х; Зикополус, Б (2007). «Префронтальная кора и гибкое поведение» . Нейробиолог . 13 (5): 532–45. дои : 10.1177/1073858407301369 . ПМЦ 2855184 . ПМИД 17901261 .
- ^ Jump up to: а б Кац, П.С.; Фрост, WN (1996). «Внутренняя нейрономодуляция: изменение нейронных цепей изнутри» . Тенденции в нейронауках . 19 (2): 54–61. дои : 10.1016/0166-2236(96)89621-4 . ПМИД 8820868 . S2CID 20753760 .
- ^ Валенти, О; Грейс, А.А. (2009). «Энторинальная кора подавляет медиальную префронтальную кору и модулирует состояния активности электрофизиологически охарактеризованных пирамидных нейронов in vivo» . Кора головного мозга . 19 (3): 658–74. дои : 10.1093/cercor/bhn114 . ПМК 2637308 . ПМИД 18632738 .
- ^ Jump up to: а б Флореско, СБ; Грейс, А.А. (2003). «Запуск вызванной гиппокампом активности в нейронах PFC с помощью входных сигналов из медиодорсального таламуса и вентральной области покрышки» . Журнал неврологии . 23 (9): 3930–43. doi : 10.1523/JNEUROSCI.23-09-03930.2003 . ПМК 6742171 . ПМИД 12736363 .
- ^ Моран, Дж; Дезимона, Р. (1985). «Избирательное внимание регулирует визуальную обработку в экстрастриарной коре». Наука . 229 (4715): 782–84. Бибкод : 1985Sci...229..782M . CiteSeerX 10.1.1.308.6038 . дои : 10.1126/science.4023713 . ПМИД 4023713 .
- ^ Андерсон, Швейцария; Ван Эссен, округ Колумбия (1987). «Схемы переключения: вычислительная стратегия для динамических аспектов визуальной обработки» . Труды Национальной академии наук . 84 (17): 6297–301. Бибкод : 1987PNAS...84.6297A . дои : 10.1073/pnas.84.17.6297 . JSTOR 29821 . ПМК 299058 . ПМИД 3114747 .
- ^ Крик, Ф; Кох, К. (1990). «Некоторые размышления о зрительном сознании» . Симпозиумы Колд-Спринг-Харбор по количественной биологии . 55 : 953–62. дои : 10.1101/SQB.1990.055.01.089 . ПМИД 2132872 .
- ^ Макнаб, Ф; Клингберг, Т. (2008). «Префронтальная кора и базальные ганглии контролируют доступ к рабочей памяти» . Природная неврология . 11 (1): 103–7. дои : 10.1038/nn2024 . ПМИД 18066057 . S2CID 709944 .
- ^ Jump up to: а б О'Доннелл, П; Грейс А.А. (1995). «Синаптические взаимодействия между возбуждающими афферентами с нейронами прилежащего ядра: гиппокампальное ворота префронтальной коры» . Журнал неврологии . 15 (5): 3622–39. doi : 10.1523/JNEUROSCI.15-05-03622.1995 . ПМК 6578219 . ПМИД 7751934 .
- ^ Иванов Андрей Игоревич; Калабрезе, Рональд Л. (2003). «Модуляция опосредованной спайками синаптической передачи пресинаптическим фоном Ca 2+ в интернейронах сердца пиявки» . Журнал Neuroscience . 23 (4): 1206–18. doi : /JNEUROSCI.23-04-01206.2003 . PMC 6742253. 10.1523 PMID 12598609 .
- ^ Эванс, Колин Г.; Цзин, Цзянь; Розен, Стивен С.; Кроппер, Элизабет К. (2003). «Регуляция возникновения и распространения спайков в сенсорном нейроне аплизии : вход через центральную деполяризацию» . Журнал неврологии . 23 (7): 2920–31. doi : 10.1523/JNEUROSCI.23-07-02920.2003 . ПМК 6742086 . ПМИД 12684479 .
- ^ Герберхольц, Йенс; Антонсен, Брайан Л.; Эдвардс, Дональд Х. (2002). «Боковая возбуждающая сеть в цепи спасения раков» . Журнал неврологии . 22 (20): 9078–85. doi : 10.1523/JNEUROSCI.22-20-09078.2002 . ПМК 6757705 . ПМИД 12388615 .
- ^ Кац, Пол С. (2003). «Синаптические шлюзы: возможность открыть закрытые двери» . Современная биология . 13 (14): R554–6. дои : 10.1016/S0960-9822(03)00471-8 . ПМИД 12867047 . S2CID 10202054 .
- ^ Грец, Брайан В.; Сойер, Майкл Г.; Хейзелл, Филип Л.; Арни, Фиона; Багхерст, Питер (2001). «Действительность подтипов СДВГ DSM-IV в национальной репрезентативной выборке австралийских детей и подростков». Журнал Американской академии детской и подростковой психиатрии . 40 (12): 1410–7. дои : 10.1097/00004583-200112000-00011 . ПМИД 11765286 .
- ^ Jump up to: а б Леви, Флоренция (2004). «Синаптические ворота и СДВГ: биологическая теория коморбидности СДВГ и тревоги» . Нейропсихофармакология . 29 (9): 1589–96. дои : 10.1038/sj.npp.1300469 . ПМИД 15114344 .
- ^ Юн, Тэджиб; Окада, Дж.; Юнг, М.В.; Ким, Джей-Джей (2008). «Префронтальная кора и гиппокамп служат различным компонентам рабочей памяти у крыс» . Обучение и память . 15 (3): 97–105. дои : 10.1101/lm.850808 . ПМК 2275661 . ПМИД 18285468 .
- ^ Jump up to: а б с д Грейс, Энтони А. (2000). «Закрытие информационного потока внутри лимбической системы и патофизиология шизофрении» . Обзоры исследований мозга . 31 (2–3): 330–41. дои : 10.1016/S0165-0173(99)00049-1 . ПМИД 10719160 . S2CID 41827055 .
- ^ Зульцер, Дэвид; Сондерс, М.С.; Поулсен, Северо-Запад; Галли, А (2005). «Механизмы высвобождения нейромедиаторов амфетаминами: обзор». Прогресс нейробиологии . 75 (6): 206–433. doi : 10.1016/j.pneurobio.2005.04.003 . ПМИД 15955613 . S2CID 2359509 .
- ^ Мерриам, Эллиот; Нетофф, ТИ; Бэнкс, Мичиган (2005). «Бистабильное сетевое поведение интернейронов I слоя в слуховой коре» . Журнал неврологии . 25 (26): 6175–6186. doi : 10.1523/JNEUROSCI.0512-05.2005 . ЧВК 1994149 . ПМИД 15987947 .