Flavin Group
статьи, Ведущий раздел возможно, потребуется переписать . Причина приведена: в соответствии с MOS: Intro , «Избегайте трудного для понимания терминологии» в лидере. ( Сентябрь 2022 г. ) |
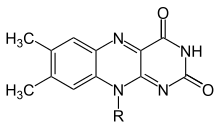

Flavins (от латинского флавуса , «желтый»), как правило, относится к классу органических соединений, содержащих трициклический гетероцикл изоаллоксазин или его изомер -аллоксазин, и их производные. Биохимический источник флавина - желтый рибофлавин витамин B. Флавиновая часть часто прикреплена аденозинофосфосфатом с образованием флавина аденинового динуклеотида ( FAD ), а в других обстоятельствах обнаруживается в виде мононуклеотида флавина (или FMN ), фосфорилированной формы рибофлавина . Именно в той или иной из этих форм Флавин присутствует в качестве протезной группы во флавопротеинах . Несмотря на подобные имена, Флавины (с «I») химически и биологически отличаются от флаваноидов (с «А») и флавонолами (с «О»).
Группа Flavin способна подвергать реакциям уменьшения окисления и может принять любой один электрон в двухэтапном процессе или два электрона одновременно. Восстановление производится с добавлением атомов водорода к специфическим азота атомам в систему изоаллоксазинового кольца :

В водном растворе флавины желтые цвета при окислении, принимая красный цвет в полу-восстановленном анионном состоянии или синем в нейтральном ( полухиноновом ) состоянии, и бесцветный, когда он полностью уменьшен. [ 1 ] Окисленные и пониженные формы находятся в быстром равновесии с формами полухинона ( радикала ), сдвинутой в образование радикала: [ 2 ]
- FL OX + FL RD H 2 ⇌ FLH •
где FL Ox - это окисленный флавин, Fl Red H 2 - снижение флавина (при добавлении двух атомов водорода) и FLH • Семихиноновая форма (добавление одного атома водорода).
В форме FADH 2 это один из кофакторов, которые могут переносить электроны в цепь переноса электрона .
Фотография
[ редактировать ]Как свободные, так и белковые флавины фотоэлектрины , то есть способны уменьшаться при свете , в механизме, опосредованном несколькими органическими соединениями, такими как некоторые аминокислоты , карбоновые кислоты и амины . [ 2 ] Это свойство Flavins используется различными светочувствительными белками. Например, домен LOV, обнаруженный у многих видов растений, грибов и бактерий, подвергается обратимому, светозависимому структурному изменению, которое включает в себя образование связи между остатком цистеина в его пептидной последовательности и связанным FMN. [ 3 ]
Увлечение
[ редактировать ]
Флавин аденин-динуклеотид представляет собой группу, связанную со многими ферментами, включая ферредоксин-NADP+ редуктаза , моноаминоксидазу , оксидазу D-аминокислоты , глюкозосидазу , ксантиноксидазу и ацил-коадегидрогеназу .
TOH / GHH 2
[ редактировать ]FADH и FADH 2 являются уменьшенными формами увлечения. FADH 2 производится в качестве протезной группы в сукцинате дегидрогеназы , фермента, участвующего в цикле лимонной кислоты . При окислительном фосфорилировании две молекулы FADH 2 обычно дают 1,5 АТФ каждый или три АТФ вместе взятые.
FMN
[ редактировать ]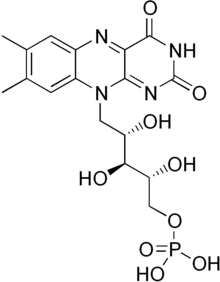
Мононуклеотид флавина является протезной группой , обнаруженной, среди других белков, NADH -дегидрогеназы , e.coli Нитроредуктазы и старого желтого фермента .
Смотрите также
[ редактировать ]- Птеридин
- Птерин
- Deazapinvin (5-Deazaplavin)
Ссылки
[ редактировать ]- ^ Михаэлис Л, Шуберт депутат, Смит CV (1936). «Потенциометрическое изучение флавинов» . Журнал биологической химии . 116 (2): 587–607. doi : 10.1016/s0021-9258 (18) 74634-6 . Архивировано с оригинала на 2009-08-08 . Получено 2008-04-25 .
- ^ Подпрыгнуть до: а беременный Massey V, Stankovich M, Hemmerich P (январь 1978 г.). «Светопосредованное восстановление флавопротеинов с флавинами в качестве катализаторов». Биохимия . 17 (1): 1–8. doi : 10.1021/bi00594a001 . PMID 618535 .
- ^ Александр М.Т., Домратчева Т., Бонетти С., Ван Вильдерен Л.Дж., Ван Грондель Р., Гроот М.Л., Хелнингверф К.Дж., Кеннис Дж. Т. (июль 2009 г.). «Первичные реакции домена LoV2 фототропина, изученного с помощью сверхбыстрой спектроскопии средней инфракрасной и квантовой химии» . Биофизический журнал . 97 (1): 227–37. Bibcode : 2009bpj .... 97..227a . doi : 10.1016/j.bpj.2009.01.066 . PMC 2711383 . PMID 19580760 .
Дальнейшее чтение
[ редактировать ]- Voet D, Voet JG (2004). Биохимия (3 -е и.). Джон Уайли и Звуки. ISBN 0-471-39223-5 .