CAPP-Seq
| Акроним | CAPP-Seq |
|---|---|
| Использование | Количественное определение низкого уровня ктДНК у онкологических больных |
| Известные эксперименты | CAPP-Seq применялся при немелкоклеточном раке легких (НМРЛ) для выявления рецидивирующих соматических изменений цтДНК. |
| Похожие товары | Бесклеточная опухолевая ДНК |
CAPP-Seq ( персонализированное профилирование рака путем глубокого секвенирования ) — это метод нового поколения, основанный на секвенировании, используемый для количественного определения циркулирующей ДНК при раке ( цтДНК ). Этот метод был представлен в 2014 году лабораториями Эша Ализаде и Максимилиана Дина в Стэнфорде как инструмент для измерения бесклеточной опухолевой ДНК , которая выделяется из мертвых опухолевых клеток в кровь и, таким образом, может отражать весь опухолевый геном. Этот метод можно обобщить для любого типа рака, который, как известно, имеет повторяющиеся мутации. [ 1 ] CAPP-Seq может обнаружить одну молекулу мутантной ДНК среди 10 000 молекул здоровой ДНК. Оригинальный метод [ 1 ] был дополнительно усовершенствован в 2016 году для сверхчувствительного обнаружения за счет интеграции нескольких стратегий подавления ошибок, получивших название интегрированного цифрового подавления ошибок (iDES). [ 2 ] Использование ктДНК в этом методе не следует путать с циркулирующими опухолевыми клетками (ЦОК); это две разные сущности. [ 3 ]
Первоначально описанный как метод обнаружения и мониторинга рака легких, [ 1 ] [ 2 ] CAPP-Seq был успешно адаптирован для широкого спектра видов рака несколькими независимыми группами. К ним относятся диффузная крупноклеточная В-клеточная лимфома (DLBCL), [ 4 ] фолликулярная лимфома (ФЛ), [ 4 ] посттрансплантационное лимфопролиферативное заболевание (ПТЛД), [ 5 ] метастатический колоректальный рак в яичник, [ 6 ] рак пищевода , [ 7 ] рак поджелудочной железы , [ 8 ] рак мочевого пузыря , [ 9 ] лейомиосаркома , [ 10 ] у взрослых и детей разнообразные саркомы , [ 11 ] среди других.
Метод
[ редактировать ]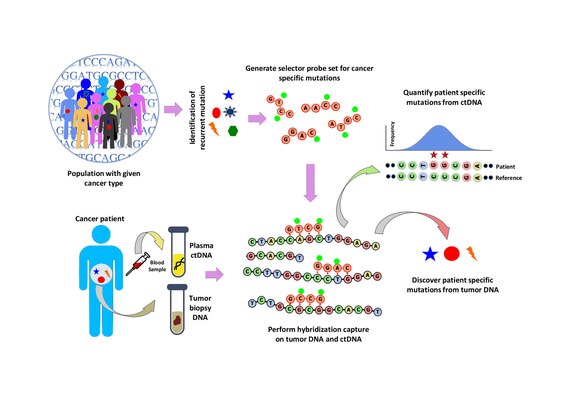
Популяционный анализ проводится для выявления повторяющихся мутаций при данном типе рака. Это делается путем анализа общедоступных наборов данных, таких как база данных рака COSMIC и TCGA . Разработан «селектор», состоящий из биотинилированных ДНК-олигонуклеотидных зондов, нацеленных на рекуррентно мутированные области, выбранные для конкретного типа рака. Селектор выбирается с использованием многофазного биоинформатического подхода. С помощью селектора выполняется гибридизационный захват опухоли и нормальной ДНК с помощью зонда для обнаружения мутаций, специфичных для пациента. Затем гибридизационный захват также применяется к ктДНК для количественной оценки ранее обнаруженных мутаций. [ 1 ]
Экстракция ктДНК и подготовка библиотеки
[ редактировать ]У пациентов берут периферическую кровь и выделяют ктДНК из ≥1 мл плазмы . Входная ДНК может составлять всего 4 нг. [ 1 ]
При адаптации этого протокола для работы с ctDNA было четыре основных цели:
- 1) оптимизировать эффективность лигирования адаптера
- 2) уменьшить количество циклов ПЦР, необходимых после лигирования
- 3) сохранить естественное распределение ктДНК по размерам (в среднем 170 пар оснований)
- 4) минимизировать вариабельность глубины охвата последовательностей во всех захваченных регионах.
Это было достигнуто за счет проведения лигирования адаптера при температуре 16°C в течение 16 часов для повышения эффективности лигирования адаптера и восстановления. Самая важная адаптация происходит на этапах ферментации и очистки; они выполняются с шариком, чтобы свести к минимуму этапы переноса пробирки, что увеличивает выход.
Конструкция селектора
[ редактировать ]В CAPP-Seq разработка селектора является решающим шагом, который идентифицирует повторяющиеся мутации при определенном типе рака с использованием общедоступных данных секвенирования следующего поколения. Для включения в селектор CAPP-seq рекуррентные мутации, которые обогащаются в популяции, описываются индексом- индексом повторения (RI). RI — это количество мутаций на тысячу оснований данного геномного локуса пациента, несущего определенные мутации. RI представляет собой частоту рецидивов на уровне пациента, оцененную для соматических мутаций и всех мутаций. Известные и вызывающие рекуррентные мутации в популяции можно ранжировать на основе RI, и поэтому RI используется для разработки селектора. Для разработки селектора используется шестиэтапная стратегия проектирования. [ 1 ]
- Фаза 1: Выявление часто мутирующих известных мутаций драйверов с использованием общедоступных данных.
- Фаза-2: Максимальный охват SNV среди пациентов был определен путем ранжирования их экзонных RI.
- Фаза-3 и 4: были выбраны экзоны с более высоким RI.
- Фаза-5: Добавление ранее предсказанных мутаций драйверов.
- Фаза-6: Добавление повторяющихся реаранжировок слияний генов, специфичных для конкретного рака.
Рак человека неоднороден, и рецидивирующие раковые мутации присутствуют лишь у меньшинства пациентов. Таким образом, тщательная и неизбыточная конструкция селектора является жизненно важной частью CAPP-Seq, а также размер селектора связан с его последующими затратами.
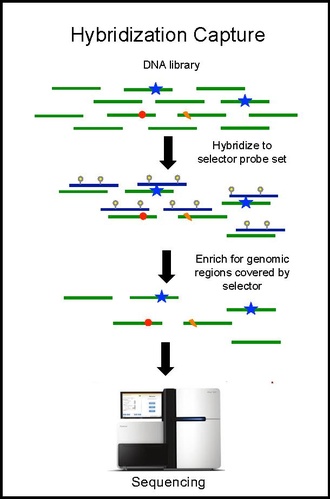
Гибридизационный захват и секвенирование
[ редактировать ]Захват гибридизации с помощью набора селекторных зондов выполняется на ДНК опухоли из биопсии и секвенируется на глубину покрытия ~10 000×. Биотинилированные селекторные зонды избирательно связываются с областями библиотеки ДНК, которые были выбраны в качестве места возникновения рекуррентных мутаций при данном типе рака. Таким образом, у вас останется небольшая библиотека, обогащенная только теми областями, которые вам нужны, которые затем можно будет секвенировать. Это позволяет определять специфические для пациента мутации. Затем гибридизационный захват с тем же селектором выполняется на ctDNA из крови для количественной оценки ранее выявленных мутаций у пациента. CAPP-Seq можно применять к ctDNA из нескольких образцов крови в разные моменты времени, чтобы следить за эволюцией опухоли.
Вычислительный конвейер для CAPP-seq
[ редактировать ]Анализ данных CAPP-Seq включает ряд шагов, от обнаружения мутаций до проверки, и большую часть анализа можно выполнить с помощью программного обеспечения с открытым исходным кодом. После первого этапа вызова вариантов мутации зародышевой линии и потери гетерозиготности (LOH) удаляются в CAPP-seq, чтобы уменьшить фоновые ошибки. Несколько тестов статистической значимости могут быть выполнены на фоне всех типов вариантов вызова. Например, статистическую значимость SNV, происходящих из опухоли, можно оценить путем случайной выборки фоновых аллелей с использованием метода Монте-Карло . Для вызовов indel статистическая значимость рассчитывается с использованием отдельного метода, в котором использовался анализ конкретной цепи с помощью Z-теста, показанный в предыдущей работе. [ 1 ] Наконец, этапы вычислительной проверки уменьшают количество ложноположительных вызовов. Однако надежная вычислительная система, специально предназначенная для анализа данных CAPP-seq, пользуется большим спросом в этой области.
Чувствительность
[ редактировать ]Чувствительность этой технологии зависит от эффективной конструкции селектора и сильно зависит от размера когорты и типа исследуемого рака. Отсутствие предпосылок для поиска статистически значимых повторяющихся вариантов ограничило его эффективность из-за стохастического шума и биологической изменчивости. Анализ рабочих характеристик приемника (ROC) у нескольких больных раком и пациентов, излечившихся от рака (образцы, собранные на разных стадиях опухоли, моменте времени циркулирующей ДНК, лечении и т. д.), показал, что CAPP-seq имеет более высокую чувствительность и специфичность по сравнению с предыдущими методами в не- мелкоклеточный рак легкого. [ 1 ]
Ограничения
[ редактировать ]На предел обнаружения CAPP-Seq влияют три основные области: введенное количество молекул ctDNA, перекрестное загрязнение образца, потенциальная аллельная ошибка в реагенте для захвата и ошибки ПЦР или секвенирования. ctDNA может быть обнаружена при нижнем пределе фракционного содержания 0,025% в крови. Было обнаружено, что перекрестное загрязнение образцов имеет очень небольшой вклад, и отчеты показали минимальную аллельную ошибку в сторону захвата эталонных аллелей в лимфоцитах периферической крови (ЛПК). Ошибки ПЦР и секвенирования также минимальны. [ 1 ] Этот метод становится сомнительным, когда ктДНК присутствует на низких уровнях 0,01%. Кроме того, когда высвобождение ктДНК меньше из-за стабильности роста опухоли в результате терапии, обнаружение оказывается под угрозой. [ 12 ] [ 13 ]
высвобождается ли ктДНК с одинаковой или неодинаковой скоростью из первичных опухолей и метастатических заболеваний Пока неизвестно, . Этот факт следует принимать во внимание при выполнении CAPP-Seq, поскольку это может вызвать проблемы при определении опухолевой нагрузки и клональной эволюции, если разные опухоли или клоны отмирают и высвобождают свою ДНК с разной скоростью. Также неизвестно, как гистология опухоли влияет на высвобождение цДНК. [ 1 ]
Еще одним серьезным ограничением использования только уровней ктДНК для выявления опухолевой нагрузки является то, что ктДНК может предсказать только остаточную опухоль и ничего не может сказать о местоположении опухоли. Это означает, что CAPP-Seq лучше всего использовать в дополнение к другим подходам секвенирования. [ 10 ] для визуализации бремени заболеваний в разное время. Таким образом, техническая чувствительность, воспроизводимость, специфичность и потребность в экспертных знаниях для анализа больших объемов данных являются одними из проблем, связанных с этим методом.
Преимущества
[ редактировать ]CAPP-Seq имеет множество преимуществ перед другими методами, такими как цифровая полимеразная цепная реакция (дПЦР) и секвенирование ампликонов . CAPP-Seq может исследовать множество локусов в одном эксперименте по сравнению с dPCR и секвенированием ампликонов, которые используют несколько разных экспериментов и, следовательно, используют гораздо больше образцов. Еще одним преимуществом является то, что CAPP-Seq может не только обнаруживать точковые мутации, но также обнаруживать вставки , структурные вариации и вариации числа копий. [ 14 ] а также помогает контролировать минимальную остаточную болезнь. [ 15 ]
Еще одним преимуществом CAPP-Seq является то, что, поскольку он нацелен только на определенные области генома, представляющие интерес, он более экономически эффективен, чем секвенирование всего экзома и секвенирование всего генома, которые в 171 раз и 44 раза дороже соответственно. [ 1 ] Кроме того, нет необходимости в дискретной оптимизации для отдельных пациентов.
Использование циркулирующей опухолевой ДНК в отличие от биопсии солидной опухоли позволяет проанализировать полный репертуар опухолевых клеток, рассеянных по всей опухоли и отдаленных метастазов. Следовательно, существует больше шансов обнаружить все мутации, связанные с этим раком. Полное представление о раке и его причинах позволит разработать более эффективные планы лечения и управления заболеванием.
Приложения
[ редактировать ]Мониторинг опухолевой нагрузки
[ редактировать ]При лечении рака полезно иметь точные измерения общего бремени болезней организма. Это помогает определить прогностическую значимость и реакцию на лечение. Обычно это делается с помощью компьютерной томографии (КТ), позитронно-эмиссионной томографии (ПЭТ) или магнитно-резонансной томографии (МРТ). [ 16 ] Эти процедуры медицинской визуализации дороги и не лишены своих проблем. Эти методы визуализации не позволяют точно выявить небольшие опухоли (диаметром менее 1 см). [ 14 ] На визуализацию также могут влиять радиационное воспаление и фиброзные изменения, что затрудняет определение наличия остаточной опухоли или просто последствий лечения. [ 1 ]
Было обнаружено, что уровни ктДНК в плазме значительно коррелируют с объемом опухоли по сравнению с медицинскими методами визуализации (КТ, ПЭТ и МРТ). [ 1 ] [ 14 ] [ 17 ] [ 18 ] Обнаружение ктДНК может предсказать остаточную опухоль или неизбежный рецидив, в некоторых случаях даже лучше, чем медицинская визуализация и современные методы.
Прогностический показатель
[ редактировать ]В ходе многочисленных исследований было обнаружено, что обнаружение ктДНК является предиктором рецидива. В исследовании [ 14 ] на поздней стадии при немелкоклеточном раке легких (НМРЛ) они обнаружили два случая, когда ctDNA правильно определила исход пациента, хотя медицинские изображения были неправильными. В одном случае визуализация предсказала рецидив на основании подозрения на остаточную опухоль, которая оказалась всего лишь радиационно-индуцированным воспалением, но ctDNA не была обнаружена, и у пациента не было рецидива. В другом случае визуализация не показала опухоли, но была обнаружена ктДНК, и вскоре после этого у пациента случился рецидив. В другом исследовании [ 18 ] При диффузной крупноклеточной В-клеточной лимфоме (DLBCL) ctDNA также оказалась предиктором рецидива.
Генотипирование опухоли без биопсии
[ редактировать ]Биопсия инвазивна и связана с риском для пациента. Поэтому множественные биопсии для мониторинга прогрессирования заболевания проводятся редко, и для получения генетической информации полагаются на диагностические биопсии. Это может быть проблематичным из-за гетерогенности опухоли и ее эволюции. Во-первых, при биопсии берутся образцы только одной части опухоли, а поскольку опухоли гетерогенны, это не охватывает весь генетический ландшафт опухоли. Во-вторых, после лечения опухоли развиваются и могут возникнуть новые мутации, не представленные в диагностической выборке. [ 1 ] [ 14 ]
Генотипирование опухоли без биопсии с помощью CAPP-Seq и ctDNA решает многие из этих проблем. Простой анализ крови является неинвазивным, гораздо безопаснее и проще проводить его несколько раз больным раком в течение курса лечения. Использование ктДНК дает лучший образец ДНК опухоли по сравнению с отдельным участком опухоли, собранным при биопсии, что позволяет лучше оценить гетерогенность опухоли. Взятие нескольких образцов ктДНК в разные моменты времени после курса лечения позволяет выявить эволюцию опухоли. Это может помочь обнаружить появление мутаций, которые придают устойчивость к таргетной терапии, и позволить соответствующим образом скорректировать курс лечения. CAPP-Seq позволяет проводить скрининг нескольких участков генома, что становится важным, поскольку список раковых мутаций, важных для лечения, продолжает расти. [ 14 ] В исследовании [ 1 ] для поздней стадии НМРЛ они выполнили версию CAPP-Seq, в которой биопсия опухоли не секвенировалась в первую очередь, и они смогли правильно классифицировать 100% образцов плазмы пациентов с 0% ложноположительных результатов. Это показывает, что даже без предварительных знаний об опухолевых мутациях их можно точно обнаружить только с помощью цтДНК.
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к л м н тот Ньюман А.М., Братман С.В., То Дж., Винн Дж.Ф., Эклов Н.К., Модлин Л.А. и др. (май 2014 г.). «Сверхчувствительный метод количественного определения циркулирующей опухолевой ДНК с широким охватом пациентов» . Природная медицина . 20 (5): 548–54. дои : 10.1038/нм.3519 . ПМК 4016134 . ПМИД 24705333 .
- ^ Jump up to: а б Ньюман А.М., Лавджой А.Ф., Класс Д.М., Курц Д.М., Чабон Дж.Дж., Шерер Ф. и др. (май 2016 г.). «Интегрированное цифровое подавление ошибок для улучшения обнаружения циркулирующей опухолевой ДНК» . Природная биотехнология . 34 (5): 547–555. дои : 10.1038/nbt.3520 . ПМЦ 4907374 . ПМИД 27018799 .
- ^ Беттегоуда С., Саусен М., Лири Р.Дж., Кинд И., Ван Ю., Агравал Н. и др. (февраль 2014 г.). «Обнаружение циркулирующей опухолевой ДНК на ранних и поздних стадиях злокачественных новообразований человека» . Наука трансляционной медицины . 6 (224): 224ра24. doi : 10.1126/scitranslmed.3007094 . ПМК 4017867 . ПМИД 24553385 .
- ^ Jump up to: а б Шерер Ф., Курц Д.М., Ньюман А.М., Штер Х., Крейг А.Ф., Исфахани М.С. и др. (ноябрь 2016 г.). «Отличные биологические подтипы и закономерности эволюции генома лимфомы, выявленные с помощью циркулирующей опухолевой ДНК» . Наука трансляционной медицины . 8 (364): 364ра155. doi : 10.1126/scitranslmed.aai8545 . ПМК 5490494 . ПМИД 27831904 .
- ^ Су Дж., Шроерс-Мартин Дж., Гарофало А., Курц Д., Д'Эмилио Н., Луикарт Х., Ализаде А., Кхуш К. (20 мая 2018 г.). «Раннее выявление посттрансплантационных лимфопролиферативных заболеваний с использованием циркулирующей опухолевой ДНК». Журнал клинической онкологии . 36 (15_дополнение): 7572. doi : 10.1200/JCO.2018.36.15_suppl.7572 .
- ^ Ивахаси Н., Сакаи К., Ногучи Т., Яхата Т., Тодзима С., Нисио К., Ино К. (ноябрь 2018 г.). «Комплексный анализ мутаций генов в образцах жидкой биопсии пациентов с метастатическим колоректальным раком в яичник: отчет о случае» . Письма об онкологии . 16 (5): 6431–6436. дои : 10.3892/ol.2018.9467 . ПМК 6202479 . ПМИД 30405780 .
- ^ Класс Д., Ньюман А., Лавджой А.Ф., Чжоу Л., Штер Х., Сюй Т., Хэ Дж., Комаки РУ, Ляо З., Мару Д., Ализаде А. (2015). «Анализ циркулирующей опухолевой ДНК у пациентов с карциномой пищевода, получавших химиолучевую терапию». Международный журнал радиационной онкологии, биологии, физики . 93 (3): С104–С105. дои : 10.1016/j.ijrobp.2015.07.251 .
- ^ Осмундсон Э., Ньюман А.М., Брэтман С.В., Класс Д.М., Чжоу Л., Пай Дж., Лонгакр Т.А., Ализаде А.А., Кунг А.С., Дин М. (2014). «Циркулирующая опухолевая ДНК как биомаркер аденокарциномы поджелудочной железы». Международный журнал радиационной онкологии, биологии, физики . 90 (1): С816–С817. дои : 10.1016/j.ijrobp.2014.05.2354 .
- ^ Дадли Дж.С., Шроерс-Мартин Дж., Лаззарески Д.В., Ши Вайоминг, Чен С.Б., Исфахани М.С., Триведи Д., Чабон Дж.Дж., Чаудхури А.А., Стехр Х., Лю CL, Лим Х., Коста Х.А., Набет БАЙ, Син М.Л., Ляо Дж.К., Ализаде А.А., Дин М. (апрель 2019 г.). «Обнаружение и наблюдение за раком мочевого пузыря с использованием ДНК опухоли мочи» . Открытие рака . 9 (4): 500–509. дои : 10.1158/2159-8290.CD-18-0825 . ПМК 6467650 . ПМИД 30578357 .
- ^ Jump up to: а б Пшибил Дж., Чабон Дж.Дж., Спанс Л., Ганджу К.Н., Веннам С., Ньюман А.М. и др. (июнь 2018 г.). «Комбинированный подход к обнаружению различных типов изменений в циркулирующей опухолевой ДНК при лейомиосаркоме» . Клинические исследования рака . 24 (11): 2688–2699. дои : 10.1158/1078-0432.CCR-17-3704 . ПМК 5984700 . ПМИД 29463554 .
- ^ Шах А.Т., Азад Т.Д., Чабон Дж.Дж., Бриз М., Танаса Б., Спиллинджер А., Люнг С.Г., Дин М., Ализаде А.А. (01.10.2018). «Реферат B49: Количественное определение циркулирующей опухолевой ДНК у пациентов с транслокационной саркомой с использованием CAPP-Seq». Стендовые презентации – Предлагаемые тезисы . 78 (19_Приложение). Американская ассоциация исследований рака: B49. дои : 10.1158/1538-7445.PEDCA17-B49 . S2CID 86680699 .
- ^ Диас Л.А., Барделли А. (февраль 2014 г.). «Жидкостная биопсия: генотипирование циркулирующей опухолевой ДНК» . Журнал клинической онкологии . 32 (6): 579–86. дои : 10.1200/JCO.2012.45.2011 . ПМЦ 4820760 . ПМИД 24449238 .
- ^ Хабер Д.А., Велкулеску В.Е. (июнь 2014 г.). «Анализ рака крови: циркулирующие опухолевые клетки и циркулирующая опухолевая ДНК» . Открытие рака . 4 (6): 650–61. дои : 10.1158/2159-8290.CD-13-1014 . ПМЦ 4433544 . ПМИД 24801577 .
- ^ Jump up to: а б с д и ж Братман С.В., Ньюман А.М., Ализаде А.А., Дин М. (июнь 2015 г.). «Потенциальная клиническая полезность сверхчувствительного обнаружения ДНК циркулирующих опухолей с помощью CAPP-Seq» . Экспертный обзор молекулярной диагностики . 15 (6): 715–9. дои : 10.1586/14737159.2015.1019476 . ПМК 5052032 . ПМИД 25773944 .
- ^ Гримвейд Д., Вьяс П., Фриман С. (ноябрь 2010 г.). «Оценка минимальной остаточной болезни при остром миелолейкозе». Современное мнение в онкологии . 22 (6): 656–63. дои : 10.1097/CCO.0b013e32833ed831 . ПМИД 20805746 . S2CID 205547633 .
- ^ Бар-Шалом Р., Ефремов Н., Гуральник Л., Гайтини Д., Френкель А., Кутен А. и др. (август 2003 г.). «Клиническая эффективность ПЭТ/КТ при оценке рака: дополнительная ценность для диагностической визуализации и ведения пациентов». Журнал ядерной медицины . 44 (8): 1200–9. ПМИД 12902408 .
- ^ Диль Ф., Шмидт К., Чоти М.А., Романс К., Гудман С., Ли М. и др. (сентябрь 2008 г.). «Циркулирующая мутантная ДНК для оценки динамики опухоли» . Природная медицина . 14 (9): 985–90. дои : 10.1038/нм.1789 . ПМК 2820391 . ПМИД 18670422 .
- ^ Jump up to: а б Спина В., Росси Д. (январь 2019 г.). «Жидкая биопсия при лимфомах тканевого происхождения» . Швейцарский медицинский еженедельник . 149 (23): w14709. дои : 10.4414/smw.2019.14709 . ПМИД 30673117 .