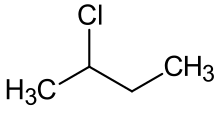
2-хлорбутан
| |
| Имена | |
|---|---|
| Предпочтительное имя IUPAC
2-хлорбутан | |
| Идентификаторы | |
| |
3D model ( JSmol )
|
|
| Чеби | |
| Химический | |
| Chemspider | |
| Echa Infocard | 100.001.047 |
| ЕС номер |
|
PubChem CID
|
|
| НЕКОТОРЫЙ |
|
Comptox Dashboard ( EPA )
|
|
| Характеристики | |
| C 4 H 9 Cl | |
| Молярная масса | 92.57 g·mol −1 |
| Плотность | 0,873 г · см −3 |
| Точка плавления | −140 ° C (-220 ° F; 133 K) |
| Точка кипения | 70 ° C (158 ° F; 343 K) |
| -67.40·10 −6 см 3 /мол | |
| Опасности | |
| GHS Маркировка : | |
 
| |
| Опасность | |
| H225 , H315 , H319 , H335 | |
| P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P271 , P280 , P302+P352 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P312 , P323232, P351+P358, P312, P3232332, P332, P332 , P332, P332, P332 , P332, стр. P313 , P362 , P370+P378 , P403+P233 , P403+P235 , P405 , P501 | |
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |
2-хлорбутан -это соединение с формулой C 4 H 9 кл . Это также называется SEC -Бутилхлорид . Это бесцветная, летучая жидкость при комнатной температуре, которая не является недоступной в воде.
Физические свойства
[ редактировать ]Это бесцветная, летучая жидкость при комнатной температуре, которая не является недоступной в воде. Будучи алкилхлоридом, его температура кипения варьируется в зависимости от того, какой галогенид прикреплен и где он прикреплен. Точки кипения хлоридов ниже бромидов или йодидов из -за небольшого размера хлора относительно других галогенов и его более слабых межмолекулярных сил.
Несмотря на свою полярность, 2-хлорбутана лишь немного растворим в воде из-за углеводородной цепи, к которой она прикреплена, это делает его растворимым в неорганических растворителях. Как и многие алкилгалогениды, он реактивен относительность, хотя и не такой реактивный, как йодиды и бромиды (i> br> cl> f), из -за этой реакционной способности алкилториды более стабильны, чем другие, и не легко реактивны. [ 1 ]
Синтез
[ редактировать ]2-хлорбутан может быть синтезирован с помощью добавления соляной кислоты к 2-бутену в следующей реакции:

Реакция составляет двухэтапную, а PI-электроны атакуют хлоридный водород, который образует хлоридный нуклеофил . На втором этапе нуклеофил атакует карбоказу, генерируемую на первом этапе.

Хотя добавление галогенида водорода к алкене является стереоселективным , симметричная структура 2-бутена предотвращает образование продукта против Маркникова из-за обеих сторон двойной связи, имеющей одинаковую стабильность.
Кроме того, 2-хлорбутан может быть синтезирован в реакции замещения путем реагирования 2-бутанола с соляной кислотой.

В этом случае реакция является SN1, потому что 2-бутанол генерирует карбокацию в двухэтапной реакции. Поскольку гидроксильная группа не является хорошей уходной группой, она сначала атакует хлоридный водород, создавая воду, которая является хорошей уходной группой, это генерирует карбокацию. На втором этапе хлоридный нуклеофил атакует карбокацию, чтобы сформировать продукт.

Использование
[ редактировать ]2-хлорбутан, наряду с другими алкилгалогенками, является полезным промежуточным звеном во многих различных органических реакциях. Группа галогена является эффективной уходной группой, что приводит к ее использованию как в реакциях элиминации, так и в реакциях замещения. Кроме того, соединение также является кандидатом на реакции связи через реагент Grignard .
Реакции замены
[ редактировать ]В реакции SN2 нуклеофил (йод) атакует частично положительный углерод, который устраняет хлор. Это происходит за один шаг.

Менее благоприятной, но все еще возможной реакцией является реакция SN1, когда после удаления уходной группы образуется вторичная карбокация. Затем нуклеофил атакует карбокацию, образуя продукт.

Элиминационные реакции
[ редактировать ]Кроме того, поскольку 2-хлорбутан является антиперипланаром, он может подвергаться реакциям элиминации E2 с сильными основаниями. В нем удаляется группа, оставляемая хлором, и двойная связь восстанавливается, чтобы дать различные конституционные изомеры. Это связано с тем, что 2-хлорбутан обладает двумя различными наборами β-гидрогенов на первом и третьем углеродах соответственно, что приводит к 1-бутеном или 2-бутенам. Важно отметить, что как вторичный алкилгалогенид, реакции E2 и SN2 одинаково вероятно, когда реагируют на вещество, которое может действовать как основание, так и нуклеофил. Какая реакция происходит, зависит от окружающих условий. [ 2 ] В механизме E2 сильный основание (например, гидроксид натрия) абстрагирует бета-водород, вызывая выборы из бывшей углерод-гидрогеновой связи для повторной формы двойной связи. Это действие удаляет уходную группу, преобразуя 2-хлорбутан в 2-бутен или 1-бутен, в зависимости от того, какой бета-водород удаляется, [ 3 ] Из-за правила Зейтева более стабильный 2-бутенский продукт предпочитается.
Механизм формирования 2-бутена (блюда):

Механизм формирования 1-бутена (не предпочитается):

Реакции Гринарда
[ редактировать ]В качестве алкилгалогенида 2-хлорбутана можно использовать для приготовления реагента Гриньярда для использования при формировании углеродного углеродного связи. [ 4 ] На первом этапе ион магния жертвует электрон альфа-углероду в 2-хлорбутане, удаляя хлор и образуя аллильный радикал, а также радикал Mg+1. На втором этапе радикальные пары Mg+1 с аллильным радикалом, в то время как ион хлорида взаимодействует с ионом магния.

Ссылки
[ редактировать ]- ^ Clark, J. (2015, 18 декабря). Физические свойства алкилгалогенидов. В химии либретлексам. Получено 2 декабря 2018 года.
- ^ Clark, J. (2018, 8 марта). Реакция алкилгалогенидов с ионами гидроксида. В химии либретлексам. Получено 1 декабря 2018 года.
- ^ Reusch, W. (2013, 5 мая). Элиминационные реакции алкилгалогенидов. В MSU.edu. Получено 28 ноября 2018 года.
- ^ Bauld, N. (ND). Формирование реагентов Гриньяр из органических галогенидов. В utexas.edu. Получено 2 декабря 2018 года.