Синтез углеводов
Эта статья может быть слишком технической для понимания большинства читателей . ( февраль 2016 г. ) |
Синтез углеводов — это раздел органической химии, занимающийся созданием сложных углеводных структур из простых единиц (моносахаридов) посредством естественных или искусственных процессов. Генерация углеводных структур включает соединение гликозильных групп, таких как моносахариды или олигосахариды, через гликозидные связи, что называется гликозилированием . Синтез углеводов направлен на получение полисахаридов с контролируемой структурой с помощью атомно-экономических методов. Поэтому важно построить гликозидные связи, которые имеют оптимальную молекулярную геометрию (стереоселективность) и стабильную связь (региоселективность) в месте реакции (аномерный центр). [1]

Фон
[ редактировать ]Вообще говоря, углеводы можно разделить на две группы: простые сахара и сложные углеводы. Простые сахара, также называемые моносахаридами, представляют собой углеводы, которые не поддаются дальнейшему расщеплению путем гидролиза . Когда гликозидные связи соединяют две или более моносахаридные единицы, образуются сложные углеводы. Сложные углеводы, в зависимости от различного количества моносахаридных единиц, можно разделить на три группы: дисахариды , олигосахариды и полисахариды . Дисахарид образуется из двух моносахаридов. Когда углевод содержит 3-10 моносахаридов, [2] его называют олигосахаридом. Высшие олигосахариды, содержащие более 10 моносахаридов, являются полисахаридами.
До сих пор не существует единой синтетической стратегии последовательного производства олигосахаридов из-за нюансов аномерных эффектов мономеров и сложности углеводных структур. [3] [4] Простые процедуры, такие как однореакторный и твердофазный синтез, обеспечивающие экономию атомов. [5] [3] используются. Однако необходимы дальнейшие разработки этих синтетических подходов, поскольку они еще не полностью контролируются и автоматизированы. [5]
Значение
[ редактировать ]Гликоконъюгат представляет собой продукт ковалентной связи олигосахаридов с биомолекулами, такими как белки и липиды. [6] Они играют незаменимую роль в биологической активности клеток млекопитающих, от выработки энергии до передачи сигналов клетками. [6] [7] [8] Эти гликоконъюгаты с короткими олигосахаридными структурами важны для характеристики и очистки в ходе разработки гликоконъюкатных вакцин. [9] Поэтому исследования в области разработки предшественников гликозилов, которые создают олигосахариды контролируемого размера, важны для синтеза углеводов. [ нужна ссылка ]
Синтез олигосахаридов
[ редактировать ]Олигосахариды имеют разнообразную структуру. Количество моносахаридов, размер кольца, различная аномерная стереохимия и наличие сахаров с разветвленной цепью — все это способствует удивительной сложности структур олигосахаридов. Суть синтеза редуцирующих олигосахаридов состоит в соединении аномерного гидроксила гликозильных доноров со спиртовыми гидроксильными группами гликозильных акцепторов . Защита гидроксильных групп акцептора с незащищенной целевой спиртовой гидроксильной группой может обеспечить региохимический контроль. такие факторы, как различные защитные группы, растворитель и методы гликозилирования Кроме того, на аномерные конфигурации могут влиять . Эта концепция иллюстрируется синтезом олигосахаридов на схеме 1. Синтез олигосахаридов обычно состоит из четырех частей: получение гликозильных доноров, получение гликозильных акцепторов с одной незащищенной гидроксильной группой, их связывание и процесс снятия защиты. . [ нужна ссылка ]

Строительные блоки
[ редактировать ]Обычными донорами в синтезе олигосахаридов являются гликозилгалогениды , гликозилацетаты, тиогликозиды , трихлорацетимидаты, пентенилгликозиды и гликали . Среди всех этих доноров классическими донорами являются гликозилгалогениды, сыгравшие историческую роль в развитии реакций гликозилирования. Доноры тиогликозидов и трихлорацетимидатов чаще других используются в современных методах гликозилирования. Одним из преимуществ трихлорацетимидатного метода является отсутствие необходимости введения в процесс активации реагентов тяжелых металлов. Более того, использование разных оснований может избирательно приводить к различным аномерным конфигурациям. (Схема 2) Что касается тиогликозидов, то их наибольшая сила заключается в том, что они могут обеспечить временную защиту аномерного центра, поскольку они могут выжить после большинства процессов активации. [10] Кроме того, можно использовать различные методы активации, такие как NIS/AgOTf, NIS/TfOH, IDCP ( йода диколлидина перхлорат ), йод и Ph 2 SO/Tf 2 O. Кроме того, при получении 1,2-транс гликозидная связь, использование тиогликозидов и имидатов может способствовать перегруппировке побочных продуктов ортоэфиров, поскольку реакционные смеси достаточно кислые.

Стереоселективность
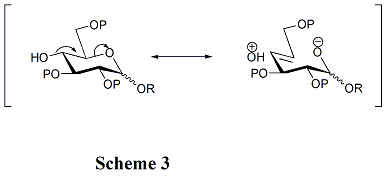
[ редактировать ]Структуры акцепторов играют решающую роль в скорости и стереоселективности гликозилирования. Обычно незащищенные гидроксильные группы менее реакционноспособны, когда они находятся между объемными защитными группами. Именно по этой причине гидроксильная группа при OH-4 в пиранозидах нереакционноспособна. Гиперконъюгация возникает, когда OH-4 антиперипланарно по отношению к кислороду кольца, что также может снизить его реакционную способность. (Схема 3) Кроме того, ацильные защитные группы могут снижать реакционную способность акцепторов по сравнению с алкильными защитными группами из-за их электроноакцепторной способности. Гидроксильная группа при OH-4 производных N-ацетилглюкозамина особенно нереакционноспособна. [11]
Гликозидная связь образуется из гликозильного донора и гликозильного акцептора. Существует четыре типа гликозидных связей: 1,2-транс-α, 1,2-транс-бета, 1,2-цис-α и 1,2-цис-бета связи. 1,2-трансгликозидные связи могут быть легко достигнуты с использованием доноров 2-O-ацилированных гликозилов (участие соседних групп). Чтобы предотвратить накопление промежуточных ортоэфиров , условия гликозилирования должны быть слегка кислыми.
Сложные связи
[ редактировать ]При соединении моносахаридов олигосахариды необходимо восстанавливать, чтобы последовательно соединить гликозильные звенья. Моносахариды в природе предпочитают ɑ-связи из-за аномерного эффекта . [1] но дисахариды с ɑ-связями являются невосстанавливающими, что дезактивирует последующее соединение моносахаридов. [12] Чтобы сделать процесс гликозилирования непрерывным и автоматизированным, гликозидные связи должны поддерживать бета-версию, чтобы структура оставалась открытой для связывания с большим количеством гликозильных групп.
Несколько сложнее стереоселективно получить 1,2-цис-β-гликозидные связи. Обычно, когда неучаствующие группы находятся в положении O-2, 1,2-цис-β-связь может быть достигнута либо с использованием исторически важных методов галоидных ионов, либо с использованием 2-O-алкилированных доноров гликозила, обычно тиогликозидов или трихлорацетимидатов. , в неполярных растворителях. [ нужна ссылка ]
В начале 1990-х годов связь бета-маннозида все еще была слишком сложной, чтобы ее могли попытаться предпринять любители. Однако метод, предложенный Кричем (схема 4), с предварительным условием защиты 4,6-бензилидена и аномерным альфа-трифлатом в качестве ключевого промежуточного продукта, оставляет эту проблему по существу решенной. Одновременно разработанный, но гораздо более длительный подход к внутримолекулярной доставке агликонов (IAD). [13] — малоиспользуемая, но, тем не менее, стереоспецифичная альтернатива.

См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Тивари, Винод Кумар (26 октября 2023 г.). Синтетические стратегии в химии углеводов (1-е изд.). Эльзевир. стр. 3–7. ISBN 9780323986496 .
- ^ Лорентен, А.; Эдвардс, Калифорния (01 января 2013 г.), «Клетчатка: резистентный крахмал и олигосахариды» , Кабальеро, Бенджамин (редактор), Энциклопедия питания человека (третье издание) , Уолтем: Academic Press, стр. 246–253, ISBN 978-0-12-384885-7 , получено 13 апреля 2024 г.
- ^ Jump up to: а б Сибергер, Питер Х.; Верц, Дэниел Б. (апрель 2007 г.). «Синтез и медицинское применение олигосахаридов» . Природа . 446 (7139): 1046–1051. Бибкод : 2007Natur.446.1046S . дои : 10.1038/nature05819 . ISSN 1476-4687 . ПМИД 17460666 .
- ^ Болтье, Томас Дж.; Бускас, Тереза; Бунс, Герт-Ян (1 ноября 2009 г.). «Возможности и проблемы в исследованиях синтетических олигосахаридов и гликоконъюгатов» . Природная химия . 1 (8): 611–622. Бибкод : 2009НатЧ...1..611Б . дои : 10.1038/nchem.399 . ISSN 1755-4330 . ПМК 2794050 . ПМИД 20161474 .
- ^ Jump up to: а б Сюй, Хань; Шен, Баосин; Цяо, Мэн; Линхардт, Роберт Дж.; Чжан, Син (15 апреля 2021 г.). «Последние достижения в области синтеза в одном горшке для сборки гликанов, гликоконъюгатов и полисахаридов контролируемого размера» . Углеводные полимеры . 258 : 117672. doi : 10.1016/j.carbpol.2021.117672 . ISSN 1879-1344 . ПМИД 33593549 .
- ^ Jump up to: а б Шиватаре, Сачин С.; Шиватаре, Видья С.; Вонг, Чи-Хьюи (26 октября 2022 г.). «Гликоконъюгаты: синтез, функциональные исследования и терапевтические разработки» . Химические обзоры . 122 (20): 15603–15671. doi : 10.1021/acs.chemrev.1c01032 . ISSN 0009-2665 . ПМЦ 9674437 . ПМИД 36174107 .
- ^ Чандел, Навдип С. (январь 2021 г.). «Углеводный обмен» . Перспективы Колд-Спринг-Харбор в биологии . 13 (1): а040568. doi : 10.1101/cshperspect.a040568 . ISSN 1943-0264 . ПМЦ 7778149 . ПМИД 33397651 .
- ^ Дэниел Э. Леви и Питер Фюгеди.; Органическая химия сахаров ; Тейлор и Фрэнсис: 2006 , стр. 181–197.
- ^ Стефанетти, Джузеппе; МакЛеннан, Кальман Александр; Миколи, Франческа (29 сентября 2022 г.). «Воздействие и контроль размера сахара в гликоконъюгатных вакцинах» . Молекулы . 27 (19): 6432. doi : 10,3390/molecules27196432 . ISSN 1420-3049 . ПМК 9572008 . ПМИД 36234967 .
- ^ Роберт В. Стик.; Углеводы: сладкие молекулы жизни .; Академическая пресса.; 2001 , стр. 113-177.
- ^ Crich, D.; Dudkin V. J. Am. Chem. Soc. 2001 , 123 , 6819-6825
- ^ «Влияние гликозидной связи на характер связывания углеводов в лектинах I складки β-призмы: рентгеновское и молекулярно-динамическое исследование комплексов банановый лектин-углевод». Гликобиология . 21 (1): 23–33. Январь 2011 г. doi : 10.1093/glyob/cwq128 .
- ^ Garegg, P. J. Chemtracts-Org. Chem ., 1992 , 5 , 389
Внешние ссылки
[ редактировать ] СМИ, связанные с синтезом углеводов, на Викискладе?
СМИ, связанные с синтезом углеводов, на Викискладе?