Карта контактов белков

Карта контактов белка представляет собой расстояние между всеми возможными парами аминокислотных остатков трехмерной структуры белка с использованием бинарной двумерной матрицы . Для двух остатков и , элемент матрицы равен 1, если два остатка находятся ближе, чем заданный порог, и 0 в противном случае. Были предложены различные определения контакта: расстояние между атомами Cα - Cα с порогом 6–12 Å ; расстояние между атомами Cβ - Cβ с порогом 6-12 Å (Cα используется для глицина ); боковой цепи и расстояние между центрами масс .
Обзор
[ редактировать ]Карты контактов обеспечивают более уменьшенное представление структуры белка, чем его полные трехмерные координаты атомов. Преимущество состоит в том, что карты контактов инвариантны к вращениям и перемещениям. Их легче предсказать с помощью методов машинного обучения . Также было показано, что при определенных обстоятельствах (например, при низком содержании ошибочно предсказанных контактов) можно восстановить трехмерные координаты белка, используя его карту контактов. [1] [2]
Карты контактов также используются для наложения белков и для описания сходства между белковыми структурами. [3] Они либо предсказываются на основе последовательности белка , либо рассчитываются на основе заданной структуры.
Прогноз карты контактов
[ редактировать ]При наличии большого количества геномных последовательностей становится возможным анализировать такие последовательности на предмет коэволюционирующих остатков . Эффективность этого подхода обусловлена тем фактом, что мутация в позиции i белка с большей вероятностью будет связана с мутацией в позиции j, чем с обратной мутацией в i, если обе позиции функционально связаны (например, принимая участие в ферментативного домена, или примыкания к свернутому белку, или даже примыкания к олигомеру этого белка). [4]
Существует несколько статистических методов для извлечения из множественного выравнивания последовательностей таких связанных пар остатков: наблюдаемые и ожидаемые частоты пар остатков (OMES); [5] корреляция замещения на основе Маклахлана (McBASC); [6] статистический анализ связей ; взаимной информации (MI); Методы на основе [7] и недавно анализ прямой связи (DCA). [8] [9]
Алгоритмы машинного обучения позволили усовершенствовать методы анализа MSA, особенно для негомологичных белков (т. е. неглубоких MSA). [10]
Предсказанные карты контактов использовались для предсказания мембранных белков , в которых нацелены взаимодействия спираль-спираль. [11]
Участок HB
[ редактировать ]Знание взаимосвязи между структурой белка и его динамическим поведением имеет важное значение для понимания функции белка. Описание трехмерной структуры белка как сети взаимодействий водородных связей ( график HB ) [12] был представлен как инструмент для изучения структуры и функции белка. Анализируя сеть третичных взаимодействий, можно исследовать возможное распространение информации внутри белка.
График HB предлагает простой способ анализа вторичной и третичной структуры белка . Водородные связи, стабилизирующие вторичные структурные элементы ( вторичные водородные связи ), и связи, образующиеся между отдаленными аминокислотными остатками, определяемые как третичные водородные связи аминокислотные остатки, участвующие в стабилизации структуры и функции белка , можно легко различить на графике HB, таким образом, можно идентифицировать .
Функции
[ редактировать ]На графике различают взаимодействия главной цепи с основной цепью, главной цепи с боковой боковой цепи с боковой цепью цепью и взаимодействия водородных связей . Раздвоенные водородные связи и множественные водородные связи между аминокислотными остатками; внутри- и межцепные водородные связи на графиках также указаны . Цветовой кодировкой различают три класса водородных связей; короткие (расстояние между донором и акцептором менее 2,5 Å ), промежуточные (между 2,5 и 3,2 Å) и длинные водородные связи (более 3,2 Å).
Элементы вторичной структуры на графике HB
[ редактировать ]
В представлениях графика HB вторичной структуры можно легко распознать характерные закономерности элементов , а именно:
- Спирали можно определить как полосы, непосредственно примыкающие к диагонали.
- Антипараллельные бета-листы отображаются на графике HB как перекрестные.
- Параллельные бета-листы отображаются на графике HB как параллельные диагонали.
- Петли появляются как разрывы диагонали между поперечно-диагональными мотивами бета-листа .
Примеры использования
[ редактировать ]Цитохром P450s
[ редактировать ]Цитохромы P450 (P450s) представляют собой ксенобиотики метаболизирующие мембраносвязанные ферменты , гемсодержащие , которые используют молекулярный кислород и электроны НАДФН-редуктазы цитохрома P450 для окисления своих субстратов . CYP2B4 , член семейства цитохромов P450, является единственным белком в этом семействе, чья рентгеновская структура как в открытой 11, так и в закрытой форме 12 опубликована. Сравнение открытой и закрытой структур структур CYP2B4 выявляет крупномасштабную конформационную перестройку между двумя состояниями с наибольшим конформационным изменением вокруг остатков 215-225, которые широко открыты в безлигандном состоянии и закрыты после связывания лиганда; и область вокруг петли C рядом с гемом.

Изучение графика HB закрытого и открытого состояний CYP2B4 показало, что перестройка третичных водородных связей прекрасно согласуется с современными знаниями о каталитическом цикле цитохрома P450 .
Первый этап каталитического цикла P450 идентифицируется как связывание субстрата. Предварительное связывание лиганда вблизи входа разрывает водородные связи S212-E474, S207-H172 в открытой форме CYP2B4 и образуются водородные связи E218-A102, Q215-L51, фиксирующие вход в закрытой форме, как показывает график HB. .
Второй этап — перенос первого электрона от НАДФН через цепь переноса электрона. При переносе электрона происходит конформационное изменение, которое запускает взаимодействие P450 с НАДФН-редуктазой цитохрома P450. Разрыв водородных связей между S128-N287, S128-T291, L124-N287 и образование S96-R434, A116-R434, R125-I435, D82-R400 в сайте связывания НАДФН-цитохром-редуктазы - как видно на графике HB - трансформирует CYP2B4. до конформационного состояния, при котором происходит связывание НАДФН-цитохром-редуктазы Р450.
На третьем этапе кислород поступает в CYP2B4 в закрытом состоянии — состоянии, в котором вновь образовавшиеся водородные связи S176-T300, H172-S304, N167-R308 открывают туннель, размер и форма которого точно соответствует молекуле кислорода .
Семья Липокалин
[ редактировать ]
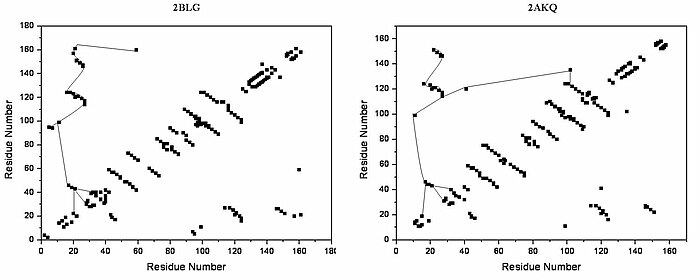
Семейство липокалинов представляет собой большое и разнообразное семейство белков, выполняющих функции переносчиков малых гидрофобных молекул. Бета-лактоглобулин является типичным представителем семейства липокалинов. Было обнаружено, что бета-лактоглобулин играет роль в транспорте гидрофобных лигандов, таких как ретинол или жирные кислоты . [13] Его кристаллическая структура была определена [например, Qin, 1998] с различными лигандами, а также в безлигандной форме. Определенные к настоящему времени кристаллические структуры показывают, что типичный липокалин содержит восьмицепочечный антипараллельный ствол, образующий коническую центральную полость, в которой связан гидрофобный лиганд. Структура бета-лактоглобулина показывает, что бочкообразная структура с центральной полостью белка имеет «вход», окруженный пятью бета-петлями с центрами около 26, 35, 63, 87 и 111, которые претерпевают конформационные изменения. во время связывания лиганда и закрытия полости.
Общая форма бета-лактоглобулина характерна для семейства липокалинов. [ нужна ссылка ] В отсутствие альфа-спиралей поперечные диагонали, представляющие бета-листы главная диагональ почти исчезает, а на графике доминируют . На графике можно обнаружить относительно небольшое количество третичных водородных связей с тремя областями высокой плотности, одна из которых соединена с петлей около 63 остатков, вторая связана с петлей около 87 и третья область, которая соединен с областями 26 и 35. Пятая петля около 111 представлена только одной третичной водородной связью на графике HB.
В трехмерной структуре образуются третичные водородные связи: (1) вблизи входа, непосредственно участвующие в конформационной перестройке при связывании лиганда; и (2) внизу «бочки». Графики HB открытой и закрытой форм бета-лактоглобулина очень похожи, все уникальные мотивы можно распознать в обеих формах. Разница в графиках HB открытой и связанной с лигандом форм показывает несколько важных индивидуальных изменений в структуре третичных водородных связей. В частности, образование водородных связей между Y20-E157 и S21-H161 в закрытой форме может иметь решающее значение для конформационной перестройки. Эти водородные связи лежат на дне полости, что позволяет предположить, что закрытие входа липокалина начинается тогда, когда лиганд достигает дна полости и разрывает водородные связи R123-Y99, R123-T18 и V41-Q120. Известно, что липокалины обладают очень низким сходством последовательностей при высоком структурном сходстве. [ нужна ссылка ] Единственными сохранившимися областями являются именно области около 20 и 160 с неизвестной ролью.
См. также
[ редактировать ]- Сюжет Рамачандрана
- Топология схемы
- Структурная классификация белков
- КАТ
- Участок HB
- Точечный график (биоинформатика)
- Матрица самоподобия
Ссылки
[ редактировать ]- ^ Пиетал, МЮ; Буйницкий, Ю.М.; Козловский, ЛП. (июнь 2015 г.). «GDFuzz3D: метод реконструкции трехмерной структуры белка по картам контактов, основанный на неевклидовой функции расстояния» . Биоинформатика . 31 (21): 3499–505. doi : 10.1093/биоинформатика/btv390 . ПМИД 26130575 .
- ^ Вассура М., Маргара Л., Ди Лена П., Медри Ф., Фариселли П., Касадио Р. (2008). «Реконструкция трехмерных структур по картам контактов белков». Транзакции IEEE/ACM по вычислительной биологии и биоинформатике . 5 (3): 357–367. дои : 10.1109/TCBB.2008.27 . ПМИД 18670040 . S2CID 6080543 .
- ^ Холм Л., Сандер С. (август 1996 г.). «Картирование белковой вселенной». Наука . 273 (5275): 595–603. Бибкод : 1996Sci...273..595H . дои : 10.1126/science.273.5275.595 . ПМИД 8662544 . S2CID 7509134 .
- ^ Фитч, WM; Марковиц, Э. (1970). «Улучшенный метод определения изменчивости кодонов в гене и его применение к скорости фиксации мутаций в эволюции». Биохим. Жене . 4 (5): 579–593. дои : 10.1007/bf00486096 . ПМИД 5489762 . S2CID 26638948 .
- ^ Касс, И.; Горовиц, А. (2002). «Картирование путей аллостерической коммуникации в GroEL путем анализа коррелирующих мутаций». Белки . 48 (4): 611–617. дои : 10.1002/прот.10180 . ПМИД 12211028 . S2CID 40289209 .
- ^ Гобель, У.; и др. (1994). «Коррелированные мутации и контакты остатков в белках». Белки . 18 (4): 309–317. дои : 10.1002/прот.340180402 . ПМИД 8208723 . S2CID 14978727 .
- ^ Волленберг, КР; Эчли, WR (2000). «Разделение филогенетических и функциональных ассоциаций в биологических последовательностях с помощью параметрического бутстрепа» . Учеб. Натл. акад. наук. США . 97 (7): 3288–3291. Бибкод : 2000PNAS...97.3288W . дои : 10.1073/pnas.97.7.3288 . ПМК 16231 . ПМИД 10725404 .
- ^ Вейгт, М; Уайт, РА; Сзурмант, Х; Хох, Дж. А.; Хва, Т (2009). «Идентификация прямых контактов остатков при межбелковом взаимодействии путем передачи сообщений» . Proc Natl Acad Sci США . 106 (1): 67–72. arXiv : 0901.1248 . Бибкод : 2009PNAS..106...67W . дои : 10.1073/pnas.0805923106 . ПМК 2629192 . ПМИД 19116270 .
- ^ Моркос, Ф; и др. (2011). «Анализ коэволюции остатков методом прямого связывания фиксирует нативные контакты во многих семействах белков» . Proc Natl Acad Sci США . 108 (49): Е1293–Е1301. дои : 10.1073/pnas.1111471108 . ПМК 3241805 . ПМИД 22106262 .
- ^ Хэнсон, Джек; Паливал, Кулдип К; Литфин, Томас; Ян, Юэдун; Чжоу, Яоци (2018). «Точное предсказание карт контактов белков путем объединения остаточной двумерной двунаправленной долговременной кратковременной памяти со сверточными нейронными сетями». Биоинформатика . 34 (23): 4039–4045. doi : 10.1093/биоинформатика/bty481 . ПМИД 29931279 . S2CID 49335891 .
- ^ Ло А., Чиу Ю.Й., Родланд Э.А., Лю ПК, Сун Т.Ю., Сюй В.Л. (2009). «Прогнозирование взаимодействий спираль-спираль на основе контактов остатков в мембранных белках» . Биоинформатика . 25 (8): 996–1003. doi : 10.1093/биоинформатика/btp114 . ПМК 2666818 . ПМИД 19244388 .
- ^ Бикади З., Демко Л., Хазай Э. (2007). «Функциональная и структурная характеристика белка на основе анализа его сети водородных связей с помощью графика водородных связей». Арх Биохим Биофиз . 461 (2): 225–234. дои : 10.1016/j.abb.2007.02.020 . ПМИД 17391641 .
- ^ Перес, доктор медицины; Кальво, М (1995). «Взаимодействие бета-лактоглобулина с ретинолом и жирными кислотами и его роль как возможная биологическая функция этого белка: обзор» . Журнал молочной науки . 78 (5): 978–88. doi : 10.3168/jds.S0022-0302(95)76713-3 . ПМИД 7622732 .
Внешние ссылки
[ редактировать ]- ПЕРЕГОНКА — прогнозирование структурных особенностей белка (включая карты контактов белковых остатков)
- Инструменты структурной протеомики - включают карты контактов аминокислот.
- ПрофКон — прогнозирование контактов между остатками
- TMHcon — предсказание контактов спираль-спираль конкретно внутри трансмембранных частей мембранных белков.
- TMhit — новый метод прогнозирования трансмембранного взаимодействия спираль-спираль, основанный на контактах остатков [ мертвая ссылка ]
- CMAPpro — сервер прогнозирования карты контактов белков.
- [1] — Инструмент для визуализации карты контактов белков в jerseysforcheapshop.


