Рамановский микроскоп


Рамановский микроскоп представляет собой лазерное микроскопическое устройство, используемое для выполнения спектроскопии комбинационного рассеяния . [ 1 ] Термин моль (молекулярная оптическая лазерная эксперт) используется для обозначения микрозонса на основе комбинации. [ 1 ] Используемая техника названа в честь CV Raman , который обнаружил рассеяющие свойства в жидкостях. [ 2 ]
Конфигурация
[ редактировать ]Рамановский микроскоп начинается со стандартного оптического микроскопа и добавляет для возбуждения лазер , лазерные фильтры , спектрометр или монохроматор и оптический чувствительный детектор , такой как устройство, связанное с зарядом (CCD), или Photomultiplier Tube , (PMT). Традиционно комбинационная микроскопия использовалась для измерения спектра комбинационного рассеяния точки на образце, в последнее время метод была расширена для реализации спектроскопии комбинационного рассеяния для прямой химической визуализации по всему поле зрения на трехмерном образце.
Режимы визуализации
[ редактировать ]При прямой визуализации вся область зрения рассматривается на наличие рассеяния на небольшом диапазоне волновых средств (смены комбинационного рассеяния). Например, для регистрации распределения холестерина в клеточной культуре можно использовать характеристику волнового числа для холестерина. Другим подходом является гиперспектральная визуализация или химическая визуализация , при которой тысячи комбинационных спектров приобретаются со всей области зрения. Затем данные можно использовать для генерации изображений, показывающих местоположение и объем различных компонентов. Взяв пример культуры клеточной культуры, гиперспектральное изображение может показать распределение холестерина, [ 3 ] а также белки, нуклеиновые кислоты и жирные кислоты. [ 4 ] [ 5 ] [ 6 ] Сложные методы обработки сигналов и обработки могут быть использованы для игнорирования присутствия воды, культурных сред, буферов и других помех.
Разрешение
[ редактировать ]Рамановская микроскопия, и, в частности, конфокальную микроскопию , могут достигать субмикрометрового бокового пространственного разрешения. [ 7 ] Поскольку комбинационный микроскоп является системой с ограниченной дифракцией , его пространственное разрешение зависит от длины волны света и численной апертуры фокусирующего элемента. В конфокальной рамановской микроскопии диаметр конфокальной апертуры является дополнительным фактором. Как правило, боковое пространственное разрешение может достигать приблизительно лазерной длины волны при использовании объектива воздушных объектива, в то время как цели погружения нефти или воды могут обеспечить боковые разрешения около половины длины волны лазера. Это означает, что при эксплуатации в диапазоне видимого в ближнем инфракрасном диапазоне рамановский микроскоп может достичь боковых разрешений прибл. От 1 мкм до 250 нм, в то время как разрешение глубины (если не ограничено глубиной оптического проникновения образца) может варьироваться от 1-6 мкм с наименьшей конфокальной апертурой обмотки до десятков микрометров при работе без конфокальной шестерни. [ 8 ] [ 9 ] [ 10 ] Поскольку объективные линзы микроскопов фокусируют лазерный луча вниз до диапазона микрометра, полученный поток фотонов намного выше, чем достигается в обычных комбинационных установках. Это имеет дополнительный эффект увеличения фотообесцвечивания молекул, излучающих мешающую флуоресценции. Тем не менее, высокий поток фотонов также может вызывать деградацию образца, и, следовательно, для каждого типа образца лазерная длина волны и мощность лазера должны быть тщательно отобраны.
Рамановская визуализация
[ редактировать ]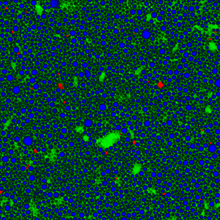
Another tool that is becoming more popular is global Raman imaging. This technique is being used for the characterization of large scale devices, mapping of different compounds and dynamics study. It has already been used for the characterization of graphene layers,[11] J-aggregated dyes inside carbon nanotubes and multiple other 2D materials such as MoS2[12] и WSE 2 . Поскольку луч возбуждения рассеивается по всему полю взгляда, эти измерения могут быть выполнены без повреждения образца. Используя рамановскую микростроскопию, можно измерить спектры рамановских раманов in vivo, разрешенные с разрешением времени и пространственно-реле, можно измерить рамановские спектры. В результате флуоресценция воды, среды и буферов может быть удалена. Следовательно, он подходит для изучения белков, клеток и органеллов.
Raman microscopy for biological and medical specimens generally uses near-infrared (NIR) lasers (785 nm diodes and 1064 nm Nd:YAG are especially common). This reduces the risk of damaging the specimen by applying higher energy wavelengths. However, the intensity of NIR Raman scattering is low (owing to the ω4 dependence of Raman scattering intensity), and most detectors require very long collection times. Recently, more sensitive detectors have become available, making the technique better suited to general use. Raman microscopy of inorganic specimens, such as rocks, ceramics and polymers,[13] can use a broader range of excitation wavelengths.
A related technique, tip-enhanced Raman spectroscopy, can produce high-resolution hyperspectral images of single molecules[14] and DNA.[15]
Correlative Raman imaging
[edit]
Confocal Raman microscopy can be combined with numerous other microscopy techniques. By using different methods and correlating the data, the user attains a more comprehensive understanding of the sample. Common examples of correlative microscopy techniques are Raman-AFM,[16][13] Raman-SNOM,[17] and Raman-SEM.[18]
Correlative SEM-Raman imaging is the integration of a confocal Raman microscope into an SEM chamber which allows correlative imaging of several techniques, such as SE, BSE, EDX, EBSD, EBIC, CL, AFM.[19] The sample is placed in the vacuum chamber of the electron microscope. Both analysis methods are then performed automatically at the same sample location. The obtained SEM and Raman images can then be superimposed.[20][21] Moreover, adding a focused ion beam (FIB) on the chamber allows removal of the material and therefore 3D imaging of the sample. Low-vacuum mode allows analysis on biological and non-conductive samples.
Biological Applications
[edit]By using Raman microspectroscopy, in vivo time- and space-resolved Raman spectra of microscopic regions of samples can be measured. Sampling is non-destructive and water, media, and buffers typically do not interfere with the analysis. Consequently, in vivo time- and space-resolved Raman spectroscopy is suitable to examine proteins, cells and organs. In the field of microbiology, confocal Raman microspectroscopy has been used to map intracellular distributions of macromolecules, such as proteins, polysaccharides, and nucleic acids and polymeric inclusions, such as poly-β-hydroxybutyric acid and polyphosphates in bacteria and sterols in microalgae. Combining stable isotopic probing (SIP) experiments with confocal Raman microspectroscopy has permitted determination of assimilation rates of 13C and 15N-substrates as well as D2O by individual bacterial cells.[22]
See also
[edit]- Raman scattering
- Coherent Raman Scattering Microscopy
- Scanning electron microscope
- Tip-enhanced Raman spectroscopy
References
[edit]- ^ Jump up to: a b Microscopical techniques in the use of the molecular optics laser examiner Raman microprobe, by M. E. Andersen, R. Z. Muggli, Analytical Chemistry, 1981, 53 (12), pp 1772–1777 [1]
- ^ Krishnan, K. S.; Raman, C. V. (1928). "A New Type of Secondary Radiation". Nature. 121 (3048): 501–502. Bibcode:1928Natur.121..501R. doi:10.1038/121501c0. ISSN 1476-4687. S2CID 4128161.
- ^ Matthäus, Christian; Krafft, Christoph; Dietzek, Benjamin; Brehm, Bernhard R.; Lorkowski, Stefan; Popp, Jürgen (2012-10-16). "Noninvasive Imaging of Intracellular Lipid Metabolism in Macrophages by Raman Microscopy in Combination with Stable Isotopic Labeling". Analytical Chemistry. 84 (20): 8549–8556. doi:10.1021/ac3012347. ISSN 0003-2700. PMID 22954250.
- ^ Baranska, Malgorzata; Chlopicki, Stefan; Fedorowicz, Andrzej; Kachamakova-Trojanowska, Neli; Kaczor, Agnieszka; Majzner, Katarzyna (2012-12-10). "3D confocal Raman imaging of endothelial cells and vascular wall: perspectives in analytical spectroscopy of biomedical research". Analyst. 138 (2): 603–610. doi:10.1039/C2AN36222H. ISSN 1364-5528. PMID 23172339.
- ^ Rygula, A.; Majzner, K.; Marzec, K. M.; Kaczor, A.; Pilarczyk, M.; Baranska, M. (2013-08-01). "Raman spectroscopy of proteins: a review". Journal of Raman Spectroscopy. 44 (8): 1061–1076. Bibcode:2013JRSp...44.1061R. doi:10.1002/jrs.4335. ISSN 1097-4555.
- ^ Czamara, K.; Majzner, K.; Pacia, M. Z.; Kochan, K.; Kaczor, A.; Baranska, M. (2015-01-01). "Raman spectroscopy of lipids: a review". Journal of Raman Spectroscopy. 46 (1): 4–20. Bibcode:2015JRSp...46....4C. doi:10.1002/jrs.4607. ISSN 1097-4555.
- ^ Toporski, Jan; Dieing, Thomas; Hollricher, Olaf, eds. (2018). Confocal Raman Microscopy. Springer Series in Surface Sciences. Vol. 66. doi:10.1007/978-3-319-75380-5. ISBN 978-3-319-75378-2. ISSN 0931-5195.
- ^ Neil J. Everall (2009). "Confocal Raman Microscopy: Performance, Pitfalls, and Best Practice". Applied Spectroscopy. 63 (9): 245A–262A. Bibcode:2009ApSpe..63..245E. doi:10.1366/000370209789379196. ISSN 1943-3530. PMID 19796478.
- ^ Supporting Information of T. Schmid; N. Schäfer; S. Levcenko; T. Rissom; D. Abou-Ras (2015). "Orientation-distribution mapping of polycrystalline materials by Raman microspectroscopy". Scientific Reports. 5: 18410. Bibcode:2015NatSR...518410S. doi:10.1038/srep18410. ISSN 2045-2322. PMC 4682063. PMID 26673970.
- ^ Лотар Опилик; Томас Шмид; Ренато Зеноби (2013). «Современная рамановская визуализация: вибрационная спектроскопия на микрометрах и нанометровых масштабах». Ежегодный обзор аналитической химии . 6 : 379–398. Bibcode : 2013Arac .... 6..379o . doi : 10.1146/annurev-anchem-062012-092646 . ISSN 1936-1335 . PMID 23772660 .
- ^ Shen, Zexiang; Ю, Тинг; Ван, Йингинг; Ni, Zhenhua (2008-10-01). «Рамановская спектроскопия и визуализация графена». Нано исследования . 1 (4): 273–291. Arxiv : 0810.2836 . doi : 10.1007/s12274-008-8036-1 . ISSN 1998-0000 . S2CID 33529560 .
- ^ Li, Hai ; .. 8 682–686 ( ) : . 5
- ^ Jump up to: а беременный Schmidt, U.; Hild, S.; Ibach, W.; Холрихер, О. (2005-12-01). «Характеристика тонких полимерных пленок на нанометровом масштабе с конфокальным комбинационным АСМ». Макромолекулярные симпозии . 230 (1): 133–143. doi : 10.1002/masy.200551152 . ISSN 1521-3900 .
- ^ Apkarian, V. Ara; Николас Талларида; Крэмптон, Кевин Т.; Ли, Джунхи (апрель 2019 г.). «Визуализация вибрационных нормальных режимов одной молекулы с атомно ограниченным светом». Природа . 568 (7750): 78–82. Bibcode : 2019natur.568 ... 78L . doi : 10.1038/s41586-019-1059-9 . ISSN 1476-4687 . PMID 30944493 . S2CID 92998248 .
- ^ Он, Чжэ; Хан, Зехуа; Кизер, Меган; Линхардт, Роберт Дж.; Ван, Син; Синьюков, Александр М.; Ван, Джижоу; Deckert, Volker; Соколов, Алексей В. (2019-01-16). «Увеличенная кончиком комбинационная визуализация одноцепочечной ДНК с одним основополагающим разрешением». Журнал Американского химического общества . 141 (2): 753–757. doi : 10.1021/jacs.8b11506 . ISSN 0002-7863 . PMID 30586988 . S2CID 58552541 .
- ^ Пиларчик, Марта; Ригула, Анна; Kaczor, Agnieszka; Матеусзук, Лукаш; Маклак, Эдита; Мальчики, Стефан; Baranska, Malgorzata (2014-11-01). «Новым подходом является исследование стенки сосудов в 3D: комбинированная спектроскопия комбинационного рассеяния и атомная силовая микроскопия для визуализации аорты и лица». Вибрационная спектроскопия . 75 : 39–44. Doi : 10.1016/j.vibspec 2014.09.004 . ISSN 0924-2031 .
- ^ Старк, Роберт В.; Хилленбранд, Рейнер; Циглер, Александр; Бауэр, Майкл; Huber, Andreas J.; Гиглер, Александр М. (2009-12-07). «Наноразмерное остаточное картование стресса вокруг наноиндентов в SIC с помощью IR S-S-S-Snom и конфокальной рамановской микроскопии» . Optics Express . 17 (25): 22351–22357. BIBCODE : 2009OEXPR..1722351G . doi : 10.1364/OE.17.022351 . ISSN 1094-4087 . PMID 20052158 .
- ^ Карделл, Каролина; Герра, Изабель (2016-03-01). «Обзор новых систем SEM-EDX и комбинационной спектроскопии SEM-EDX и комбинационных раманов: применения в жизни, экологических и материалах». Тенденции TRAC в аналитической химии . 77 : 156–166. doi : 10.1016/j.trac.2015.12.001 . ISSN 0165-9936 .
- ^ Джируше, Ярослав; Ханичинек, Мартин; Хавелька, Милослав; Холрихер, Олаф; Ибах, Вольфрам; Spizig, Peter (2014). «Интеграция электронного микроскопа сфокусированного ионного луча с конфокальным комбинационным микроскопом в один прибор». Журнал вакуумной науки и техники B, Нанотехнология и микроэлектроника: материалы, обработка, измерение и явления . 32 (6): 06FC03. doi : 10.1116/1.4897502 .
- ^ Холрихер, Олаф; Schmidt, Ute; Брейнингер, Соня (ноябрь 2014 г.). «Повышение микроскопии: корреляционная визуализация комбинационного рассеяния» . Микроскопия сегодня . 22 (6): 36–39. doi : 10.1017/s1551929514001175 . ISSN 1551-9295 . S2CID 138153106 .
- ^ Вилле, Г.; Lerouge, C.; Schmidt, U. (2018-06-01). «Мультимодальная микрохарактеризация зонирования и кристаллографической ориентации в естественном касситерите путем сочетания катодолюминесценции, EBSD, EPMA и вклада конфокальной визуализации комбинационного рассеяния в SEM». Журнал микроскопии . 270 (3): 309–317. doi : 10.1111/jmi.12684 . ISSN 1365-2818 . PMID 29336485 . S2CID 338884400 .
- ^ Madigan, MT, Bender, KS, Buckley, DH, Sattley, WM and Stahl, DA (2018) Brock Biology of Microorganisms, Pearson Publ., NY, NY, 1022 pp.
