Энтропия (классическая термодинамика)
| Сопряженные переменные термодинамики | ||||||||
|
В классической термодинамике энтропия ( от греческого τρoπή (tropḗ) «преобразование») — свойство термодинамической системы , которое выражает направление или результат спонтанных изменений в системе. Термин был введен Рудольфом Клаузиусом в середине 19 века для объяснения взаимосвязи внутренней энергии , доступной или недоступной для превращений в форму тепла , и работы . Энтропия предсказывает, что определенные процессы необратимы или невозможны, несмотря на то, что они не нарушают закон сохранения энергии . [1] Определение энтропии имеет центральное значение для установления второго закона термодинамики , который гласит, что энтропия изолированных систем не может уменьшаться со временем, поскольку они всегда стремятся достичь состояния термодинамического равновесия , где энтропия самая высокая. Поэтому энтропию также считают мерой беспорядка в системе.
Людвиг Больцман объяснил энтропию как меру числа возможных микроскопических конфигураций Ω отдельных атомов и молекул системы (микросостояний), которые соответствуют макроскопическому состоянию (макросостоянию) системы. Он показал, что термодинамическая энтропия равна k ln Ω , где коэффициент k с тех пор известен как константа Больцмана .
Концепция
[ редактировать ]
Различия в давлении, плотности и температуре термодинамической системы имеют тенденцию со временем выравниваться. Например, в комнате, где находится стакан с тающим льдом, разница температур между теплой комнатой и холодным стаканом со льдом и водой выравнивается за счет энергии, переходящей в виде тепла из комнаты в более холодную смесь льда и воды. Со временем температура стакана и его содержимого и температура помещения достигают баланса. Энтропия помещения уменьшилась. Однако энтропия стакана со льдом и водой увеличилась больше, чем уменьшилась энтропия комнаты. В изолированной системе , такой как комната и ледяная вода, распространение энергии из более теплых областей в более холодные всегда приводит к чистому увеличению энтропии. Таким образом, когда система помещения и системы ледяной воды достигла теплового равновесия, изменение энтропии по сравнению с исходным состоянием максимально. Энтропия термодинамической системы является мерой прогресса уравнения.
Многие необратимые процессы приводят к увеличению энтропии. Один из них — это смешивание двух или более различных веществ, происходящее путем объединения их путем удаления разделяющей их стенки при сохранении постоянной температуры и давления. Смешение сопровождается энтропией смешения . В важном случае смешивания идеальных газов объединенная система не меняет свою внутреннюю энергию за счет работы или теплопередачи; тогда увеличение энтропии полностью происходит за счет распространения различных веществ в их новый общий объем. [2]
С макроскопической точки зрения в классической термодинамике энтропия — это функция состояния : термодинамической системы то есть свойство, зависящее только от текущего состояния системы, независимо от того, как это состояние было достигнуто. Энтропия является ключевым компонентом Второго закона термодинамики , который имеет важные последствия, например, для работы тепловых двигателей, холодильников и тепловых насосов.
Определение
[ редактировать ]Согласно равенству Клаузиуса , для замкнутой однородной системы, в которой протекают только обратимые процессы,
С является однородной температурой закрытой системы и постепенная обратимая передача тепловой энергии в эту систему.
Это означает, что линейный интеграл не зависит от пути.
Государственная функция , называемая энтропией, может быть определена так, что удовлетворяет условию
Измерение энтропии
[ редактировать ]замкнутой системы определяется ее температурой Т и давлением Р. Термодинамическое состояние однородной Изменение энтропии можно записать как
Первый вклад зависит от теплоемкости при постоянном давлении C P через
Это результат определения теплоемкости по формулам δQ = C P d T и T d S = δQ . Второй член можно переписать с помощью одного из соотношений Максвелла.
и определение объемного коэффициента теплового расширения
так что
С помощью этого выражения энтропия S при произвольных P и T может быть связана с энтропией S 0 в некотором эталонном состоянии при P 0 и T 0 согласно
В классической термодинамике энтропию исходного состояния можно положить равной нулю при любых удобных температуре и давлении. Например, для чистых веществ можно принять энтропию твердого тела при температуре плавления в 1 бар равной нулю. С более фундаментальной точки зрения третий закон термодинамики предпочтительно принимать S = 0 при T = 0 ( абсолютный ноль предполагает, что для идеально упорядоченных материалов, таких как кристаллы, ).
S ( P , T ) определяется по определенному пути на диаграмме PT : интегрирование по T при постоянном давлении P 0 , так что d P = 0 , а во втором интеграле происходит интегрирование по P при постоянной температуре T , так что d Т знак равно 0 . Поскольку энтропия является функцией состояния, результат не зависит от пути.
Приведенное выше соотношение показывает, что определение энтропии требует знания теплоемкости и уравнения состояния (которое представляет собой соотношение между P , V и T участвующего вещества). Обычно это сложные функции, и требуется численное интегрирование. В простых случаях можно получить аналитические выражения для энтропии. В случае идеального газа теплоемкость постоянна, и закон идеального газа PV = nRT дает α V V = V / T = nR / p , где n - количество молей, а R - молярная постоянная идеального газа. Итак, молярная энтропия идеального газа определяется выражением
В этом выражении C P теперь является молярной теплоемкостью.
Энтропия неоднородных систем представляет собой сумму энтропий различных подсистем. Законы термодинамики строго соблюдаются для неоднородных систем, даже если они могут быть далеки от внутреннего равновесия. Единственное условие состоит в том, что термодинамические параметры составляющих подсистем (достаточно) четко определены.
Диаграммы температуры-энтропии
[ редактировать ]
Значения энтропии важных веществ можно получить из справочных материалов или с помощью коммерческого программного обеспечения в табличной форме или в виде диаграмм. Одной из наиболее распространенных диаграмм является диаграмма температура-энтропия (TS-диаграмма). Например, на рис.2 представлена ТС-диаграмма азота, [3] изображение кривой плавления и значений насыщенной жидкости и пара с помощью изобар и изентальп.
Изменение энтропии при необратимых превращениях
[ редактировать ]Рассмотрим теперь неоднородные системы, в которых могут иметь место внутренние преобразования (процессы). Если мы вычислим энтропию S 1 до и S 2 после такого внутреннего процесса, Второй закон термодинамики требует, чтобы S 2 ≥ S 1 , где знак равенства сохраняется, если процесс обратим. Разность S i = S 2 − S 1 представляет собой производство энтропии за счет необратимого процесса. Второй закон требует, чтобы энтропия изолированной системы не могла уменьшаться.
Предположим, что система термически и механически изолирована от окружающей среды (изолированная система). Например, рассмотрим изоляционный жесткий ящик, разделенный подвижной перегородкой на два объема, каждый из которых заполнен газом. Если давление одного газа выше, он расширится за счет перемещения перегородки, совершая таким образом работу над другим газом. Кроме того, если газы имеют разные температуры, тепло может передаваться от одного газа к другому при условии, что перегородка обеспечивает теплопроводность. Наш приведенный выше результат показывает, что энтропия системы в целом будет увеличиваться во время этих процессов. Существует максимальная величина энтропии, которой может обладать система в данных обстоятельствах. Эта энтропия соответствует состоянию устойчивого равновесия , поскольку переход в любое другое состояние равновесия приведет к уменьшению энтропии, что запрещено. Как только система достигает состояния максимальной энтропии, ни одна часть системы не может выполнять работу над какой-либо другой частью. Именно в этом смысле энтропия — это мера энергии в системе, которую нельзя использовать для совершения работы.
ухудшает Необратимый процесс характеристики термодинамической системы, предназначенной для выполнения работы или охлаждения, и приводит к производству энтропии . Генерация энтропии в ходе обратимого процесса равна нулю. Таким образом, производство энтропии является мерой необратимости и может использоваться для сравнения инженерных процессов и машин.
Тепловые машины
[ редактировать ]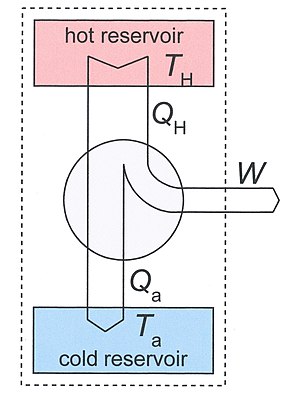
Идентификация Клаузиусом S как значительной величины была мотивирована изучением обратимых и необратимых термодинамических превращений. Тепловой двигатель — это термодинамическая система, которая может претерпевать последовательность преобразований, которые в конечном итоге возвращают ее в исходное состояние. Такая последовательность называется циклическим процессом или просто циклом . Во время некоторых преобразований двигатель может обмениваться энергией с окружающей средой. Конечный результат цикла
- механическая работа, совершаемая системой (которая может быть положительной или отрицательной , последнее означает, что работа совершается двигателем ),
- тепло передается от одной части окружающей среды к другой. В устойчивом состоянии, благодаря сохранению энергии , чистая энергия, теряемая окружающей средой, равна работе, совершаемой двигателем.
Если каждое преобразование в цикле обратимо, то и цикл обратим, и его можно проделать в обратном направлении, так что теплопередача происходит в противоположных направлениях, и объем проделанной работы меняет знак.
Тепловые двигатели
[ редактировать ]Рассмотрим тепловую машину, работающую при двух температурах T H и T a . Под T a мы имеем в виду температуру окружающей среды, но в принципе это может быть и другая низкая температура. Тепловая машина находится в тепловом контакте с двумя тепловыми резервуарами, которые должны иметь очень большую теплоемкость, поэтому их температуры существенно не изменяются, если тепло Q H отводится из горячего резервуара и Q a добавляется в нижний резервуар. При нормальной работе T H > T a и Q H , Q a и W все положительны.
В качестве термодинамической системы мы возьмем большую систему, включающую двигатель и два резервуара. На рис.3 он обозначен пунктирным прямоугольником. Оно неоднородно, закрыто (нет обмена веществом с окружающей средой) и адиабатично (нет обмена тепла с окружающей средой ). определенное количество работы W Он не изолирован, поскольку за цикл система производит , заданное первым законом термодинамики.
Мы использовали тот факт, что сам двигатель является периодическим, поэтому его внутренняя энергия не изменилась после одного цикла. То же самое справедливо и для ее энтропии, поэтому прирост энтропии S 2 − S 1 нашей системы после одного цикла определяется уменьшением энтропии горячего источника и увеличением холодного стока. Увеличение энтропии всей системы S 2 - S 1 равно производству энтропии S i за счет необратимых процессов в двигателе, поэтому
Второй закон требует, чтобы ≥ Si 0. Исключение Q a из двух соотношений дает
Первый член — это максимально возможная работа тепловой машины, совершаемая обратимым двигателем, работающим по циклу Карно . Окончательно
Это уравнение говорит нам, что производство работы уменьшается из-за образования энтропии. Член T a S i дает потерянную работу или энергию, рассеиваемую машиной.
Соответственно, количество тепла, отдаваемого холодному стоку, увеличивается за счет генерации энтропии.
Эти важные соотношения можно получить и без учета резервуаров тепла. См. статью о производстве энтропии .
Холодильники
[ редактировать ]Тот же принцип можно применить к холодильнику, работающему при низкой температуре T L и температуре окружающей среды. Схематический рисунок точно такой же, как на рис.3 на , TL W. TH QH на QL и с заменой знаком , обратным В этом случае производство энтропии равно
а работа, необходимая для отбора тепла Q L от источника холода, равна
Первое слагаемое — это минимально необходимая работа, которая соответствует реверсивному холодильнику, поэтому имеем
т. е. компрессор холодильника должен выполнить дополнительную работу, чтобы компенсировать рассеиваемую энергию из-за необратимых процессов, которые приводят к производству энтропии .
См. также
[ редактировать ]- Энтропия
- Энтальпия
- Производство энтропии
- Фундаментальное термодинамическое соотношение
- Термодинамическая свободная энергия
- История энтропии
- Энтропия (статистические представления)
Ссылки
[ редактировать ]- ^ Либ, Э.Х.; Ингвасон, Дж. (1999). «Физика и математика второго закона термодинамики». Отчеты по физике . 310 (1): 1–96. arXiv : cond-mat/9708200 . Бибкод : 1999PhR...310....1L . дои : 10.1016/S0370-1573(98)00082-9 . S2CID 119620408 .
- ^ «Заметки к «Разговору об энтропии» » . Архивировано из оригинала 17 сентября 2021 г. Проверено 9 июня 2013 г.
- ^ Рисунок составлен на основе данных, полученных с помощью RefProp, стандартной справочной базы данных NIST 23.
Дальнейшее чтение
[ редактировать ]- Э. А. Гуггенхайм «Термодинамика», передовое исследование для химиков и физиков. Издательство North-Holland Publishing Company, Амстердам, 1959.
- К. Киттель и Х. Кремер Теплофизика WH Freeman and Company, Нью-Йорк, 1980.
- Гольдштейн, Мартин и Инге Ф., 1993. Холодильник и Вселенная . Гарвардский университет. Нажимать. Нежное введение на более низком уровне, чем эта запись.




















