2-имидазолин

| |

| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
4,5-Дигидро-1Н - имидазол | |
| Систематическое название ИЮПАК
1,3-Диазациклопент-2-ен | |
| Другие имена
2-имидазолин
4,5-Дигидро-1,3-диазол | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.007.273 |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| C3H6NC3H6N2 | |
| Молярная масса | 70.095 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Имидазолин ( предпочтительное название IUPAC : 4,5-дигидро-1H - ) представляет собой один из трех изомеров азотсодержащего гетероциклимидазолина 2 - с имидазол формулой C 3 H 6 N 2 . 2-имидазолины являются наиболее распространенными имидазолинами на рынке, поскольку кольцо присутствует в некоторых натуральных продуктах и некоторых фармацевтических препаратах. Они также изучались в контексте органического синтеза, координационной химии и гомогенного катализа. [ 1 ]
Синтез
[ редактировать ]
Существует множество путей синтеза имидазолинов. [ 1 ] [ 2 ] Наиболее распространенные методы включают конденсацию 1,2-диаминов (например, этилендиамина ) с нитрилами или сложными эфирами . Путь на основе нитрила по существу представляет собой циклическую реакцию Пиннера ; он требует высоких температур и кислотного катализа и эффективен как для алкил-, так и для арилнитрилов.
Как натуральные продукты
[ редактировать ]Имидазолин был обнаружен в различных натуральных продуктах. Природные молекулы топсентин D и спонготин B были обнаружены у нескольких морских губок. Эти метаболиты привлекли значительное внимание из-за их мощных свойств, таких как противоопухолевая, противовирусная и противовоспалительная активность. [ 3 ]
Биологическая роль
[ редактировать ]Многие имидазолины биологически активны. [ 4 ] Большинство биологически активных производных несут заместитель ( арильную или алкильную группу) на углероде между азотистыми центрами. Некоторые непатентованные названия включают оксиметазолин , ксилометазолин , тетрагидрозолин и нафазолин .
Приложения
[ редактировать ]Фармацевтический
[ редактировать ]2-имидазолины исследовались как антигипергликемические, противовоспалительные, антигипертензивные, антигиперхолестеринемические и антидепрессивные средства. [ 1 ] [ 5 ] Содержащий имидазолин препарат клонидин используется отдельно или в сочетании с другими лекарствами для лечения высокого кровяного давления. Он также используется при лечении дисменореи, гипертонического криза, синдрома Туретта и синдрома дефицита внимания с гиперактивностью (СДВГ). [ 6 ]
- 2-имидазолины
-
Клонидин
-
Биимидазолиновые лиганды и комплекс.
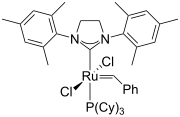
-
второго поколения Катализатор Граббса
-
Губка Боб Б
В качестве активаторов р53
[ редактировать ]Цис -имидазолины действуют как низкомолекулярные антагонисты MDM2 . Эти соединения связывают MDM2/X в р53-связывающем кармане и активируют путь р53 в раковых клетках, что приводит к остановке клеточного цикла, апоптозу и ингибированию роста ксенотрансплантатов опухолей человека у голых мышей. Наиболее активными соединениями являются нутлин-3а. [ 7 ] и РГ-7112, [ 8 ] но некоторые другие аналоги также активируют р53. [ 9 ] [ 10 ] [ 11 ]
ПАВ
[ редактировать ]Поверхностно-активные вещества на основе 2-имидазолина, такие как лауроамфоацетат натрия , используются в средствах личной гигиены, где особенно важны мягкость и отсутствие раздражения (например, детские товары, шампуни «без слез» и т. д.). [ 12 ]
В качестве предшественников имидазолов
[ редактировать ]Имидазолы можно получить дегидрированием имидазолинов. [ 13 ]
Гомогенный катализ
[ редактировать ]2-имидазолины, структурный аналог 2-оксазолинов, были разработаны в качестве лигандов в координационной химии. Замещения атома азота в имидазолиновом кольце открывают возможности для тонкой настройки электронных и стерических свойств. Некоторые из комплексов действуют как катализаторы реакций Сузуки–Мияуры, реакций Мизороки–Хека, реакций Дильса–Альдера, асимметричного аллильного замещения, [3,3] сигматропной перегруппировки, реакций Генри и т. д. [ 1 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Лю Х, Ду ДМ (март 2009 г.). «Последние достижения в синтезе 2-имидазолинов и их применение в гомогенном катализе». Расширенный синтез и катализ . 351 (4): 489–519. дои : 10.1002/adsc.200800797 .
- ^ Крауч Р.Д. (март 2009 г.). «Синтетические пути получения 2-замещенных 2-имидазолинов». Тетраэдр . 65 (12): 2387–2397. дои : 10.1016/j.tet.2008.12.022 .
- ^ Гинчард X, Валле Y, Дени Ж.Н. (май 2007 г.). «Тотальный синтез бис(индол)алкалоидов морских губок класса топсентина». Журнал органической химии . 72 (10): 3972–3975. дои : 10.1021/jo070286r . ПМИД 17444688 .
- ^ Макиннес Н., Дьюти С (декабрь 2004 г.). «Локомоторные эффекты имидазолиновых I2-сайт-специфичных лигандов и ингибиторов моноаминоксидазы у крыс с односторонним 6-гидроксидофаминовым поражением нигростриарного пути» . Британский журнал фармакологии . 143 (8): 952–959. дои : 10.1038/sj.bjp.0706019 . ПМК 1575965 . ПМИД 15545290 .
- ^ Дардонвиль С., Розас I (сентябрь 2004 г.). «Сайты связывания имидазолина и их лиганды: обзор различных химических структур». Обзоры медицинских исследований . 24 (5): 639–661. дои : 10.1002/мед.20007 . ПМИД 15224384 . S2CID 31258438 .
- ^ «Клонидин» . Опубликовано Здоровье . Октябрь 2008 г. Архивировано из оригинала 28 июня 2010 г.
- ^ Василев Л.Т., Ву Б.Т., Грейвс Б., Карвахал Д., Подласки Ф., Филипович З. и др. (февраль 2004 г.). «In vivo активация пути p53 низкомолекулярными антагонистами MDM2». Наука . 303 (5659): 844–848. Бибкод : 2004Sci...303..844V . дои : 10.1126/science.1092472 . ПМИД 14704432 . S2CID 16132757 .
- ^ Ву Б, Вовкулич П., Пиццолато Дж., Лави А., Дин К., Цзян Н. и др. (май 2013 г.). «Открытие RG7112: низкомолекулярного ингибитора MDM2 в клинической разработке» . Письма ACS по медицинской химии . 4 (5): 466–469. дои : 10.1021/ml4000657 . ПМК 4027145 . ПМИД 24900694 .
- ^ Базанов Д.Р., Первушин Н.В., Савин Е.В., Цымляков М.Д., Максутова А.И., Сосонюк С.Е. и др. (декабрь 2021 г.). «Сульфонамидные производные цис-имидазолинов как мощные ингибиторы белок-белкового взаимодействия p53-MDM2/MDMX» . Медицинские химические исследования . 30 (12): 2216–2227. дои : 10.1007/s00044-021-02802-w . ISSN 1054-2523 . S2CID 241788123 .
- ^ Базанов Д.Р., Первушин Н.В., Савицкая В.Ю., Аникина Л.В., Проскурнина М.В., Лозинская Н.А., Копейна Г.С. (август 2019). «Производные 2,4,5-трис (алкоксиарил) имидазолина как мощный каркас для новых ингибиторов взаимодействия p53-MDM2: разработка, синтез и биологическая оценка». Письма по биоорганической и медицинской химии . 29 (16): 2364–2368. дои : 10.1016/j.bmcl.2019.06.007 . ПМИД 31196710 . S2CID 189815065 .
- ^ Базанов Д.Р., Первушин Н.В., Савин Е.В., Цымляков М.Д., Максутова А.И., Савицкая В.Ю. и др. (апрель 2022 г.). «Синтетический дизайн и биологическая оценка новых ингибиторов взаимодействия p53-MDM2 на основе имидазолинового ядра» . Фармацевтика . 15 (4): 444. doi : 10.3390/ph15040444 . ПМЦ 9027661 . ПМИД 35455441 .
- ^ Тьяги Р., Тяги В.К., Пандей С.К. (2007). «Имидазолин и его производные: обзор» . Журнал Oleo Science . 56 (5): 211–222. дои : 10.5650/jos.56.211 . ПМИД 17898484 .
- ^ Исихара М., Того Х. (2006 г.). «Эффективное получение 2-имидазолинов и имидазолов из альдегидов с молекулярным йодом и (диацетоксийод)бензолом». Синлетт (2): 227–230. дои : 10.1055/s-2005-923604 .