4-нитрохлорбензол
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное имя IUPAC
1-хлор-4-нитробензол | |||
| Другие имена
4-хлор-1-нитробензол
4-хлорнитробензол P -Nitrochlorobenzene Pncbo | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| Chemspider | |||
| Echa Infocard | 100.002.554 | ||
| Кегг | |||
PubChem CID
|
|||
| НЕКОТОРЫЙ | |||
Comptox Dashboard ( EPA )
|
|||
| Характеристики | |||
| C 6 H 4 Cl N O 2 | |||
| Молярная масса | 157.55 g·mol −1 | ||
| Появление | Светло -желтый твердый | ||
| Запах | сладкий [ 1 ] | ||
| Плотность | 1,52 г/см 3 (20 ° C) | ||
| Точка плавления | 83,6 ° C (182,5 ° F; 356,8 K) | ||
| Точка кипения | 242,0 ° C (467,6 ° F; 515,1 K) | ||
| Нерастворимый | |||
| Растворимость в других растворителях | Растворимый в толуоле, эфире, ацетон, горячий этанол | ||
| Давление паров | 0,2 мм рт. Ст. (30 ° C) [ 1 ] | ||
| Опасности | |||
| точка возгорания | 12 ° C (54 ° F; 285 K) | ||
| Смертельная доза или концентрация (LD, LC): | |||
Ld 50 ( средняя доза )
|
812 мг/кг (крыса, устное) 1414 мг/кг (мышь, оральный) 440 мг/кг (мышь, оральный) 420 мг/кг (крыса, устное) [ 1 ] | ||
LC 50 ( медианная концентрация )
|
164 мг/м 3 (кошка, 7 часов) [ 1 ] | ||
| Niosh (пределы воздействия на здоровье США): | |||
Пел (допустимый)
|
TWA 1 мг/м 3 [кожа] [ 1 ] | ||
Rel (рекомендуется)
|
Что [ 1 ] | ||
IDLH (немедленная опасность)
|
CA [100 мг/м 3 ] [ 1 ] | ||
| Лист данных безопасности (SDS) | Внешние MSDS | ||
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |||
4-нитрохлорбензол -это органическое соединение с формулой CLC 6 H 4 no 2 . Это бледно -желтое твердое вещество. 4-нитрохлорбензол является распространенным промежуточным соединением в производстве ряда промышленно полезных соединений, включая антиоксиданты, обычно встречающиеся в резине . Другие изомеры с формулой CLC 6 H 4 № 2 включают 2-нитрохлорбензол и 3-нитрохлорбензол.
Подготовка
[ редактировать ]4-нитрохлорбензол готовится промышленно нитрацией хлорбензола :
- CLC 6 H 5 + HNO 3 → CLC 6 H 4 NO 2 + H 2 O
Эта реакция дает как 2-, так и 4-нитро-производные, примерно в соотношении 1: 2. Эти изомеры разделены комбинацией кристаллизации и дистилляции. [ 2 ] 4-нитрохлорбензол был первоначально подготовлен путем нитрации 4-бромхлорбензола Холлеменом и коллегами. [ 3 ]
Приложения
[ редактировать ]4-нитрохлорбензол является посредником в подготовке различных производных. Нитрация дает 2,4-динитрохлорбензол и 3,4-дихлорнитробензол . Сокращение железным металлом дает 4-хлораанилин . Электроно-гибкий характер добавленной нитро-группы делает бензоловое кольцо особенно восприимчивым к нуклеофильной ароматической замещении , в отличие от связанного хлорбензола. Таким образом, сильный гидроксид нуклеофилов , метоксид , фторид и хлорид амида вытеснения с получением соответственно 4-нитрофенол , 4-нитроанизол, 4-фторнитробензол и 4-нитроанилин . [ 2 ] [ 4 ]
Другим использованием 4-нитрохлорбензола является его конденсация анилином для получения 4-нитродифениламина. Редактивное алкилирование нитро -группы дает вторичные ариламина, которые являются полезными антиоксидантами для резины.
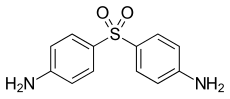
Безопасность
[ редактировать ]США Национальный институт безопасности и гигиены труда рассматривает 4-нитрохлорбензол как потенциальный профессиональный канцероген. [ 5 ] Управление по безопасности и гигиене труда установило допустимый предел воздействия 1 мг/м. 3 Американская конференция государственных промышленных гигиенистов рекомендует лимит воздействия в воздухе 0,64 мг/м 3 В течение какое-то время в среднем восемь часов. [ 6 ] [ 7 ]
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый и фон глин Niosh Pocket Guide к химическим опасностям. "#0452" . Национальный институт безопасности и гигиены труда (NIOSH).
- ^ Jump up to: а беременный в Джеральд Бут (2007). «Нитро -соединения, ароматные». Энциклопедия промышленной химии Уллмана . Вейнхайм: Wiley-VCH. doi : 10.1002/14356007.a17_411 . ISBN 978-3527306732 .
- ^ «Нитрация смешанных дихалогеновых бензолов» сборы химических работ в Нидерландах и Бельгии. Амстердам, 1915; стр. 204-235.
- ^ Брюстер, Рэй Q.; Гронинг, Теодор (1934). «П-нитродифенил эфир». Органические синтезы . 14 : 66. doi : 10.15227/orgsyn.014.0066 .
- ^ CDC - сразу же опасно для жизни или концентрации в области здоровья (IDLH): P -Nitrochlorobenzene
- ^ CDC - Pocket Guide niosh к химическим опасностям
- ^ Департамент здравоохранения и старших услуг Нью -Джерси - Информационный бюллетень опасного вещества