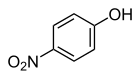
4-нитрофенол
| |||

| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
4-нитрофенол | |||
| Другие имена | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Лекарственный Банк | |||
| Информационная карта ECHA | 100.002.556 | ||
| КЕГГ | |||
ПабХим CID
|
|||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 6 Н 5 Н О 3 | |||
| Молярная масса | 139.110 g·mol −1 | ||
| Появление | Кристаллы от бесцветного до бледно-желтого цвета | ||
| Температура плавления | От 113 до 114 ° C (от 235 до 237 ° F; от 386 до 387 К) | ||
| Точка кипения | 279 ° С (534 ° F; 552 К) | ||
| 10 г/л (15 °С) 11,6 г/л (20 °С) 16 г/л (25 °С) | |||
| Кислотность ( pKa ) | 7,15 (в воде), | ||
| -69.5·10 −6 см 3 /моль | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
4-Нитрофенол (также называемый п -нитрофенолом или 4-гидроксинитробензолом ) представляет собой фенольное соединение, имеющее нитрогруппу в положении, противоположном гидроксильной группе бензольного кольца.
Характеристики
[ редактировать ]4-нитрофенол — слегка желтое кристаллическое вещество, умеренно токсичное.
На нем показаны две полиморфные модификации в кристаллическом состоянии. Альфа-форма представляет собой бесцветные столбики, нестабильные при комнатной температуре и устойчивые к солнечному свету. Бета-форма представляет собой желтые столбики, стабильна при комнатной температуре и постепенно краснеет при облучении солнечным светом. Обычно 4-нитрофенол существует в виде смеси этих двух форм.
В растворе 4-нитрофенол имеет константу диссоциации (pKa ) 7,15 при 25 °C. [ 2 ]
Подготовка
[ редактировать ]Из фенола
[ редактировать ]4-Нитрофенол можно получить нитрованием фенола разбавленной кислотой азотной при комнатной температуре. В результате реакции образуется смесь 2-нитрофенола и 4-нитрофенола.
Использование
[ редактировать ]индикатор рН
[ редактировать ]| 4-нитрофенол ( индикатор pH ) | ||
| ниже pH 5,4 | выше pH 7,5 | |
| 5.4 | ⇌ | 7.5 |
4-Нитрофенол можно использовать в качестве индикатора pH . Раствор 4-нитрофенола кажется бесцветным при pH ниже 5,4 и желтым при pH выше 7,5. [ 3 ] Это свойство изменения цвета делает это соединение полезным в качестве индикатора pH . Желтый цвет формы 4-нитрофенолята (или 4-нитрофеноксида ) обусловлен максимумом поглощения при 405 нм (ε = от 18,3 до 18,4 мМ). −1 см −1 в сильной щелочи). [ 4 ] Напротив, 4-нитрофенол имеет слабое поглощение при 405 нм (ε = 0,2 мМ −1 см −1 ). [ 4 ] Изобестическая точка для 4-нитрофенола/4-нитрофеноксида находится при 348 нм с ε = 5,4 мМ. −1 см −1 . [ 5 ]
Другое использование
[ редактировать ]- 4-Нитрофенол является промежуточным продуктом синтеза парацетамола . Восстанавливается до 4-аминофенола , затем ацетилируется уксусным ангидридом . [ 6 ]
- 4-Нитрофенол используется в качестве предшественника для приготовления фенетидина и ацетофенетидина , индикаторов и сырья для фунгицидов. Биоаккумуляция этого соединения происходит редко.
- В пептидном синтезе производные карбоксилатных эфиров 4-нитрофенола могут служить активированными компонентами для построения амидных фрагментов.
Использование деривативов
[ редактировать ]В лаборатории его используют для выявления наличия активности щелочной фосфатазы путем гидролиза PNPP . В основных условиях присутствие гидролитических ферментов окрашивает реакционный сосуд в желтый цвет. [ 7 ]
4-Нитрофенол является продуктом ферментативного расщепления нескольких синтетических субстратов, таких как 4-нитрофенилфосфат (используется в качестве субстрата для щелочной фосфатазы ), 4-нитрофенилацетат (для карбоангидразы ), 4-нитрофенил-β- D -глюкопиранозид и другие производные сахара, которые используются для анализа различных гликозидаз ферментов . Количества 4-нитрофенола, продуцируемого конкретным ферментом в присутствии соответствующего субстрата, можно измерить с помощью спектрофотометра при длине волны 405 нм или около нее и использовать в качестве косвенного измерения уровня активности фермента в образце.
Точное измерение активности фермента требует, чтобы продукт 4-нитрофенола был полностью депротонирован и существовал в виде 4-нитрофенолята, учитывая слабое поглощение 4-нитрофенола при 405 нм. Полная ионизация спиртовой функциональной группы влияет на сопряжение пи-связей соединения. Неподеленная пара кислорода может быть делокализована путем сопряжения с бензольным кольцом и нитрогруппой. Поскольку длина сопряженных систем влияет на цвет органических соединений, это изменение ионизации приводит к тому, что 4-нитрофенол желтеет, когда он полностью депротонирован и существует в виде 4-нитрофенолята. [ 8 ]
Распространенной ошибкой при измерении активности ферментов с использованием этих субстратов является проведение анализов при нейтральном или кислом pH без учета того, что ионизируется только часть хромофорного продукта. Проблему можно решить, остановив реакцию гидроксидом натрия (NaOH) или другим сильным основанием, которое превращает весь продукт в 4-нитрофеноксид; конечный pH должен быть > ок. 9.2, чтобы обеспечить ионизацию более 99% продукта. Альтернативно активность фермента можно измерить при длине волны 348 нм, изобестической точке для 4-нитрофенола/4-нитрофеноксида.
Токсичность
[ редактировать ]4-Нитрофенол раздражает глаза, кожу и дыхательные пути. [ 9 ] Это также может вызвать воспаление этих частей. Он имеет замедленное взаимодействие с кровью и образует метгемоглобин , который отвечает за метгемоглобинемию , потенциально вызывающую цианоз, спутанность сознания и потерю сознания. [ 9 ] При попадании в организм вызывает боль в животе и рвоту. Длительный контакт с кожей может вызвать аллергическую реакцию. Генотоксичность и канцерогенность 4-нитрофенола неизвестны. ЛД у мышей 50 составляет 282 мг/кг, а у крыс — 202 мг/кг (перорально).
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Это имя больше не рекомендуется IUPAC: Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 690. дои : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 .
сохранено только одно название, фенол, Для C 6 H 5 -OH как в качестве предпочтительного названия, так и для общей номенклатуры. Конструкция заменяема в любом положении. Рекомендуются локанты 2, 3 и 4, а не o , m и p .
- ^ «ТОКСНЕТ» . toxnet.nlm.nih.gov . Проверено 28 октября 2016 г.
- ^ «4-Нитрофенол CAS 100-02-7 | 106798» . www.merckmillipore.com . Проверено 28 октября 2016 г.
- ^ Перейти обратно: а б Бауэрс, Дж. Н.; МакКомб, РБ; Кристенсен, Р.К.; Шаффер, Р. (1980). «4-нитрофенол высокой чистоты: очистка, характеристика и технические характеристики для использования в качестве спектрофотометрического эталонного материала» . Клиническая химия . 26 (6): 724–729. дои : 10.1093/клинчем/26.6.724 . ПМИД 7371150 .
- ^ Биггс, А.И. (1954). «Спектрофотометрическое определение констант диссоциации п-нитрофенола и папаверина». Труды Фарадеевского общества . 50 (50): 800–802. дои : 10.1039/tf9545000800 .
- ^ Эллис, Фрэнк (2002). Парацетамол: учебный материал . Кембридж: Королевское химическое общество. ISBN 0-85404-375-6 .
- ^ Нинфа, Александр (2010). Фундаментальная лаборатория биохимии и биотехнологии . Уайли. стр. 153, 243. ISBN. 978-0470087664 .
- ^ «Взаимосвязь между поглощением УФ-ВИД и структурой органических соединений» . Шимадзу . Проверено 14 мая 2017 г.
- ^ Перейти обратно: а б Токсикологический профиль нитрофенолов (PDF) (отчет). Агентство по регистрации токсичных веществ и заболеваний, Служба общественного здравоохранения США. Июль 1992 года.