2-кумаранон

| |
| Имена | |
|---|---|
| Название ИЮПАК
3 H -1-benzofuran-2-one
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.008.230 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| C8H6OC8H6O2 | |
| Температура плавления | 49–51 °С [ 1 ] |
| Опасности | |
| СГС Маркировка : [ 2 ] | |

| |
| Предупреждение | |
| Х315 , Х317 , Х319 | |
| P261 , P264 , P264+P265 , P272 , P280 , P302+P352 , P305+P351+P338 , P321 , P332+P317 , P333+P317 , P337+P317 , P362+P364 , P501 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
2-Кумаранон представляет собой бициклическое гетероароматическое соединение , в котором шестичленное бензольное кольцо аннелировано пятичленным γ-бутиролактоновым кольцом. 2(3H ) -бензофуранон также можно рассматривать как лактон кислоты (2-гидроксифенил)уксусной . Базовая структура бензофуранона лежит в основе некоторых натуральных продуктов, таких как розмадиал, [ 3 ] который выделяют из масла розмарина и некоторых веществ с высокой фармакологической активностью, таких как гризеофульвин и рифампицин . Кроме того, 2-кумаранон используется в качестве исходного материала для получения хемилюминесцентных и флуоресцентных красителей, для синтетических фармацевтических агентов, таких как антиаритмический препарат дронедарон , и особенно для фунгицида азоксистробина .
Возникновение и синтез
[ редактировать ]В 1884 году Адольф фон Байер и Пауль Фрич открыли синтез 2-кумаранона, который они описали как лактон о- оксифенилуксусной кислоты, путем перегонки «на свободном огне» (2-гидроксифенил)уксусной кислоты. [ 4 ]

Лактон 3 H -бензофуран-2-он образуется в этом процессе при внутримолекулярном расщеплении воды при высокой температуре и в нечистом состоянии.
Подобная фрагментация путем окислительного замыкания внутримолекулярного кольца фенилуксусной кислоты также дает лишь умеренную отдачу (<20%) из-за чувствительности к окислению метиленовой группы и образования нескольких побочных продуктов 2-кумаранона. [ 5 ]

Озонолиз 2-аллилфенола , полученного алкилированием фенола с 3-бромпропеном образованием фенилаллилового эфира и последующей его перегруппировкой Кляйзена , дает 2-гидроксифенилуксусную кислоту, которая путем расщепления воды дает 2-кумаранон. Несмотря на то, что этот метод дает хорошие выходы, его экономические соображения и соображения безопасности делают его непригодным для промышленного процесса. [ 6 ]

В промышленном масштабе хорошо отфильтрованные исходные материалы циклогексанон и глиоксиловая кислота сначала преобразуются в результате кислотно-катализируемой альдольной конденсации с образованием (преимущественно) цис -2-оксоциклогексилиденуксусной кислоты ( А ). Затем, на втором этапе, он превращается в так называемый эноллактон ( В ) путем удаления воды (выход 90%). Эноллактон непрерывно дегидрируют при 250 °C в паровой фазе на палладиевом катализаторе с образованием 2-кумаранона ( C ) дегидрирования (выход примерно 67%). [ 7 ] [ 8 ] [ 9 ]
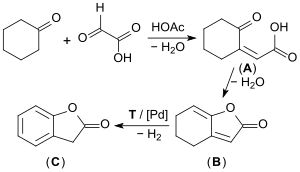
Альтернативный процесс, в котором в качестве исходного материала используются метиловые эфиры метиловых эфиров глиоксиловой кислоты , а не глиоксиловая кислота, не получил широкого признания. [ 10 ]
Характеристики
[ редактировать ]Чистый 2-кумаранон представляет собой твердое вещество от белого до бледно-желтого цвета с ароматным запахом. [ 1 ] При очистке дистилляцией «выходит бесцветное масло, которое затвердевает в приемнике в великолепные, прозрачные, хорошо сформированные кристаллы». [ 11 ] 3 H -бензофуран-2-он растворим в горячей воде, диэтиловом эфире. [ 4 ] и ацетонитрил . [ 10 ] Лактон медленно гидролизуется в горячей воде и быстро в водных щелочах с образованием 2-гидроксифенилуксусной кислоты или ее щелочной соли. [ 4 ]
Приложения
[ редактировать ]5-Нитро-3Н - бензофуран-2-он образуется при нитровании 2-кумаранона нитрующей кислотой . [ 12 ] [ 13 ]

5-Амино-3Н - бензофуран-2-он можно получить из нитросоединения каталитическим гидрированием на палладиевом катализаторе. [ 12 ]
Лактоны, такие как 2-кумаранон ( I ), легко расщепляются нуклеофилами , что приводит к раскрытию кольца. Так, 5-нитро-3Н - бензофуран-2-он реагирует со вторичными аминами с образованием амидов 2-гидроксифенилуксусной кислоты. Путем гидрирования они превращаются в соответствующие 3-амино-6-гидроксифенилэтиламины, которые являются полезными предшественниками при окрашивании волос . [ 13 ]

Конденсация 5-нитро-3Н - бензофуран-2-она ( II ) со смесью валериановой кислоты ( III ) и валерианового ангидрида ( IV ) приводит к эноллактону ( V ), который при нагревании перегруппировывается в замещенную бензофуранкарбоновую кислоту (V). VI ), ключевой предшественник антиаритмического препарата дронедарон . [ 14 ]

Базовая структура 2-кумаранона также лежит в основе класса антиоксидантов и поглотителей радикалов , особенно для стабилизации полипропиленов . При синтезе модельного соединения глиоксиловая кислота реагирует с 2 молями 4-трет-бутилфенола в присутствии метансульфоновой кислоты CH 3 SO 3 H с образованием фенольного промежуточного продукта, а затем этерифицируется бензойной кислотой . [ 15 ]

Реакция в одном котле , проводимая как реакция Черняка-Эйнхорна с участием фторфенолов ( X ), глиоксиловой кислоты ( Y ) и карбаматов , таких как метиловый эфир карбаминовой кислоты . [ 16 ] или мезитиловый эфир карбаминовой кислоты ( Z ) дает 2-кумараноны с карбамидными боковыми цепями. Эти соединения реагируют с сильными основаниями, такими как диазабициклоундецен или трет-бутанолат калия , и проявляют выраженную хемилюминесценцию в присутствии кислорода. [ 17 ] [ 18 ] [ 19 ]

Наиболее заметное применение 2-кумаранона по объему - в качестве исходного материала для синтеза фунгицида азоксистробина . [ 20 ] (известный как Амистар от Syngenta ) из класса стробилуринов .
Ссылки
[ редактировать ]- ^ Jump up to: а б Sigma-Aldrich Co. , номер продукта. {{{идентификатор}}} .
- ^ «2-Кумаранон» . pubchem.ncbi.nlm.nih.gov .
- ^ Н. Накатани; Р. Инатани (1983), «Новый дитерпеновый лактон, Росмадиал, из розмарина (Rosmarinus officinalis L.)», Biosci. Биотехнология. Биохим. , том. 47, нет. 2, стр. 353–358, номер документа : 10.1080/00021369.1983.10865620.
- ^ Jump up to: а б с А. Байер; П. Фрич (1884), «Об о-оксифенилуксусной кислоте и ее производных», Chem. , том. 17, № 1, стр. 973–975, номер документа : 10.1002/cber.188401701258.
- ^ Т. Фукагава; Ю. Фудзивара; Х. Танигучи (1982), «Катализируемое палладием внутримолекулярное ароматическое ядерное ацилоксилирование: получение 2-кумаранона», J. Org. хим. , том. 47, нет. 12, стр. 2491–2493, doi : 10.1021/jo00133a055.
- ^ EP 1481959 , W. Jary, «Способ получения лактонов и ароматических гидроксикарбоновых кислот», опубликован 1 декабря 2004 г., передан DSM Fine Chemicals Austria Nfg GmbH & CO., KG.
- ^ Н. Кармона; П. Галлезо; А. Перрард; Л. Кармона; Г. Маттиода; Ж.-К. Вальехос (1998), Синтез 2-кумаранона путем каталитического дегидрирования α-карбоксиметилиденциклогексанона, в книге «Катализ органических реакций», Фрэнк Э. Херкес, редактор , Нью-Йорк, штат Нью-Йорк, США: Marcel Dekker, Inc., стр. 381–390. , ISBN 0-8247-1929-8
- ^ США 5616733 , Ж.-К. Вальехос; А. Перрард и Ю. Кристидис и др., «Метод получения 2-кумаранона», опубликовано 1 апреля 1997 г., передано Société Française Hoechst.
- ^ ЕР 0818451 , Н. Кармона; Л. Кармона и А. Перрард и др., «Методика получения енолактона из 2-оксоциклогексилиденуксусной кислоты и применение для получения 2-кумаранона», опубликовано 14 января 1998 г., передано Clariant Chemistry SA.
- ^ Jump up to: а б ЕР 149838 , М. Станек; П. Хильдебранд и К. Циммерманн и др., «Процесс получения 2-кумарона и замещенных 2-кумаронов», опубликовано 25 августа 2004 г., передано DSM Fine Chemicals Austria Nfg GmbH & CO., KG.
- ^ С. Чаплицкий; Станислав Костанецкий ; В. Лампа (1909), «Попытки синтеза хроменола и его производных» , Chem. , том. 42, № 1, стр. 827–838, номер документа : 10.1002/cber.190904201133.
- ^ Jump up to: а б Кристофер Э. Мальмберг (2015). «Полный синтез аналогов клаватадина А для получения жизнеспособного обратимого ингибитора фактора XIa» (PDF) . Магистерская диссертация . Университет Центрального Вашингтона Университет Центрального Вашингтона. п. 14 . Проверено 20 июня 2022 г.
- ^ Jump up to: а б США 7070630 , М.-И. Лим, Ю.-Г. Пан, «Первичные промежуточные продукты окислительного окрашивания волос», опубликовано 7 апреля 2006 г., передано The Procter & Gamble Co.
- ^ EP 2508517 , А. Шуттетен, Ф. Блегер, Ф. Мордак, Дж. Пирон, «Способ получения N-алкил-2(гидрокси-4-бензоил)-3-бензофуранов и его промежуточных продуктов», опубликовано в 2012 г. 10-10, присвоено Clariant Specialty Fine Chemicals (Франция)
- ^ ЕР 2500341 , С.-Ф. Чиу, К.-Ю. Су, С. Ли, «Производные бензофуранона и их применение», опубликовано 26 июня 2013 г., передано Chitec Technology Co., Ltd., Double Bond Chemical Ind., Co., Ltd., FDC, Lees Chemical Industry Компания ООО
- ^ Р. Криг; Б. Хоффманн; Д. Вайс; К. Бискап (2019), «Первый синтез высокохемилюминесцентных бензо[b]фуран-2(3H)-онов, несущих субструктуру мочевины», Helv. Хим. Acta , 102 (6): e1800243, doi : 10.1002/hlca.201800243 , S2CID 107893512
- ^ С. Шрамм; и др. (2013), «Исследования по синтезу и хемилюминесценции новых 2-кумаранонов» , Arkivoc , vol. 3, стр. 174–188.
- ^ С. Шрамм; и др. (2015), «Исследования по синтезу и хемилюминесценции новых 2-кумаранонов – II» , Аркивок , том. 5, стр. 44–59.
- ^ «2-Кумаранон-1-Л» (PDF; 170 КБ) . caymanchem.com . Кайман Кемикал Ко . Проверено 20 июня 2022 г.
- ^ WO 199208703 , Дж. Д. Джонс, Г. А. ДеБос, П. Уилкинсон, Б. Г. Кокс, Дж. М. Филден, «Способ получения пиримидиновых соединений», опубликовано 29 мая 1992 г., передано Imperial Chemical Industries PLC.