Потенциальная теория Поланьи
Потенциальная теория Поланьи , также называемая теорией адсорбционного потенциала Поланьи, представляет собой модель адсорбции, предложенную Майклом Поланьи, где адсорбцию можно измерить через равновесие между химическим потенциалом газа вблизи поверхности и химическим потенциалом газа из большого объема. расстояние далеко. В этой модели он предположил, что притяжение газа к поверхности в основном силами Ван-дер-Ваальса определяется положением частицы газа от поверхности и что газ ведет себя как идеальный газ до тех пор, пока не произойдет конденсация, при которой газ превышает его равновесное давление пара . В то время как теория адсорбции Генри более применима при низком давлении, а уравнение изотермы адсорбции БЭТ более полезно при диапазоне от 0,05 до 0,35 P/Po, теория потенциала Поланьи имеет гораздо большее применение при более высоких P/Po (~ 0,1–0,8).
Обзор
[ редактировать ]Майкл Поланьи
[ редактировать ]Майкл Поланьи, FRS (11 марта 1891 — 22 февраля 1976) — венгерский эрудит , внесший теоретический вклад в физическую химию, экономику и философию. Поланьи был известным химиком-теоретиком, который внес вклад в область химии посредством трех основных областей исследований: адсорбции газов на твердых телах, рентгеноструктурного анализа свойств твердых тел и скорости химических реакций. Однако Поланьи активно участвовал как в теоретических, так и в экспериментальных исследованиях в области химии. Поланьи получил степень доктора медицины в 1913 году, а также степень доктора философии. Степень бакалавра физической химии в 1917 году в Будапештском университете . Позже он преподавал в качестве профессора химии в Институте кайзера Вильгельма в Берлине, а также в Манчестерском университете в Манчестере, Англия .
История
[ редактировать ]Предлагаемая теория
[ редактировать ]В 1914 году Поланьи написал свою первую статью по адсорбции, в которой предложил модель адсорбции газа на твердой поверхности. [1] Впоследствии в 1916 году он опубликовал полностью разработанную статью, которая включала экспериментальную проверку его учениками и другими авторами.Во время его исследований в Будапештском университете его наставник, профессор Георг Бредиг, отправил результаты своих исследований Альберту Эйнштейну . Эйнштейн ответил Бредигу, заявив:
Меня очень радуют статьи вашего г-на Поланьи. Я проверил в них самое существенное и нашел их в корне правильными.
Позже Поланьи описал это событие, сказав:
Хлопнуть! Я был учёным.
Поланьи и Эйнштейн продолжали переписываться время от времени в течение следующих 20 лет.
Критика
[ редактировать ]Модель адсорбции Поланьи подверглась большой критике в течение нескольких десятилетий после публикации. Его упрощенная модель определения адсорбции была сформирована во время открытия фиксированных диполей Дебая , атомной модели Бора , а также развивающейся теории межмолекулярных сил и электростатических сил ключевыми фигурами в мире химии, включая У. Х. Брэгга , У. Л. Брэгга и Виллем Хендрик Кисом .Противники его модели утверждали, что теория Поланьи не учитывает эти новые теории. Критика заключалась в том, что модель не учитывала электрические взаимодействия газа и поверхности и что присутствие других молекул будет экранировать притяжение газа к поверхности. Кроме того, модель Поланьи подверглась тщательному изучению после экспериментальных заявлений Ирвинга Ленгмюра с 1916 по 1918 год, благодаря исследованиям которого в конечном итоге была присуждена Нобелевская премия в 1932 году.Однако Поланьи не смог участвовать во многих из этих дискуссий, поскольку он работал медицинским работником в Австро-Венгерская армия на сербском фронте во время Первой мировой войны . Поланьи написал об этом опыте:
Я сам на какое-то время был защищен от каких-либо сведений об этих событиях благодаря службе в качестве офицера-медика в австро-венгерской армии с августа 1914 года по октябрь 1918 года, а также последующим революциям и контрреволюциям, продолжавшимся до конца 1919 года. Члены менее информированные круги в других местах продолжали некоторое время впечатляться простотой моей теории и ее широкими экспериментальными проверками. [1]
Оборона
[ редактировать ]Поланьи описал, что «поворотный момент» в принятии его модели адсорбции произошел, когда Фриц Габер попросил его полностью защитить свою теорию в Институте физической химии кайзера Вильгельма в Берлине, Германия . На этой встрече присутствовали многие ключевые игроки научного мира, включая Альберта Эйнштейна. Выслушав полное объяснение Поланьи своей модели, Хабер и Эйнштейн заявили, что Поланьи «проявил полное игнорирование научно установленной структуры материи». Спустя годы Поланьи описал свое испытание, заключив:
В профессиональном плане я пережил это событие лишь с трудом.
Поланьи продолжал предоставлять подтверждающие доказательства, доказывая обоснованность своей модели спустя годы после этой встречи. [1]
Опровержение
[ редактировать ]«Освобождение» Поланьи (по его описанию) от этих отклонений и критики его модели произошло в 1930 году, когда Фриц Лондон предложил новую теорию сил сцепления, основанную на теориях квантовой механики о поляризации электронных систем. Поланьи написал в Лондон, спрашивая:
«Подлежат ли эти силы экранированию промежуточными молекулами? Будет ли твердое тело, действующее под действием этих сил, обладать пространственно фиксированным адсорбционным потенциалом?»
После вычислительного анализа Поланьи и Лондон сделали совместную публикацию, в которой утверждалось, что силы адсорбции ведут себя аналогично модели, предложенной Поланьи. [1]
Дальнейшие исследования
[ редактировать ]Теория Поланьи имеет историческое значение, ее работы легли в основу других моделей, таких как теория объемного заполнения микропор (TVFM) и теория Дубинина-Радушкевича .Другие исследования были проведены с использованием потенциальной теории Поланьи, такой как явление капиллярной конденсации, открытое Жигмонди. В отличие от теории Пойлани, которая предполагает плоскую поверхность, исследование Жигмонди предполагает пористую структуру, подобную кремнеземным материалам. Его исследования доказали, что конденсация паров может происходить в узких порах ниже стандартного давления насыщенного пара . [2]
Теория
[ редактировать ]Теория потенциальной адсорбции Поланьи
[ редактировать ]
Теория потенциальной адсорбции Поланьи основана на предположении, что молекулы вблизи поверхности движутся согласно потенциалу, подобному потенциалу силы тяжести или электрического поля. [3] Эта модель применима в случае газов на поверхности при постоянной температуре. Молекулы газа движутся ближе к этой поверхности, когда давление выше равновесного давления пара. Изменение потенциала относительно расстояния от поверхности можно рассчитать по формуле разности химического потенциала:
где химический потенциал , молярная энтропия , - молярный объем , а – молярная внутренняя энергия .
В состоянии равновесия химический потенциал газа на расстоянии с поверхности, , равен химическому потенциалу газа на бесконечно большом расстоянии от поверхности, . В результате интегрирование от бесконечно дальнего расстояния до расстояния r от поверхности приводит к
где - парциальное давление на расстоянии r и — парциальное давление на бесконечном расстоянии от поверхности.
Поскольку температура остается постоянной, разницу в формуле химического потенциала можно проинтегрировать по давлению. и
Установив , уравнение можно упростить до
Используя закон идеального газа , , получается следующая формула
Поскольку газ конденсируется в жидкость на поверхности, когда давление газа превышает равновесное давление пара, , можно предположить, что на поверхности толщиной . Энергия в является
Учитывая, что парциальное давление газов зависит от концентрации, потенциал адсорбции можно рассчитать как
где – насыщенная концентрация адсорбата и – равновесная концентрация адсорбата.
Теории, основанные на теории адсорбции Поланьи
[ редактировать ]Потенциальная теория претерпела множество усовершенствований и изменений за годы, прошедшие с момента ее первого отчета. Одной из основных примечательных теорий, разработанных с использованием теории Поланьи, были теории Дубинина, уравнения Дубинина-Радушкивеча и Дубинина-Астахова.
Используя потенциал адсорбции, степень заполнения адсорбционного пространства, , можно рассчитать как
где – величина адсорбции при температуре T и равновесном давлении p , – максимальное значение адсорбции, а – характеристическая энергия адсорбции, кДж/моль, – потеря свободной энергии Гиббса при адсорбции, равная и – коэффициент подгонки. [4] The Dubinin–Radushkivech equation where равно 2 и оптимизированное уравнение Дубинина-Астахова где соответствует экспериментальным данным, можно упростить до
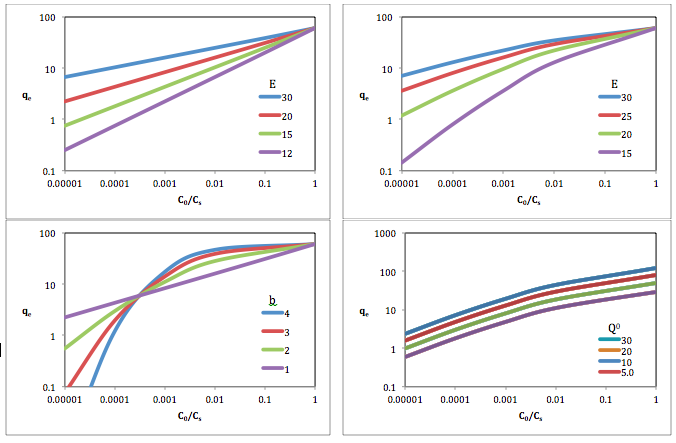
Вверху слева: Q 0 = 60; б = 1
Вверху справа: Q 0 = 60; б = 1,5
Внизу слева: Q 0 = 60; Е = 20
Внизу справа: Е = 20; б = 1,5
В других исследованиях метод Дубинина-Астахова использовался в аналогичной форме. ,
где – равновесная адсорбированная концентрация адсорбента, мг/г, – максимальная адсорбированная концентрация адсорбента, мг/г, – эффективный адсорбционный потенциал, где равен , – равновесная концентрация адсорбента в фазе раствора, мг/л, – растворимость адсорбента в воде, мг/л. [5]
Характеристическую энергию адсорбции можно соотнести с характеристической энергией адсорбции стандартного пара на той же поверхности: , за счет использования коэффициента сродства,
Коэффициент сродства представляет собой соотношение свойств образца и паров стандарта.
где и – поляризуемость паров образца и стандарта соответственно. Было проведено множество исследований для определения оптимальных коэффициентов подгонки, и коэффициенты аффинности, , чтобы лучше всего описать адсорбцию газов и паров на твердых телах. В результате уравнение Дубинина-Астахова по-прежнему используется в исследованиях адсорбции из-за точности, которую оно может получить при сопоставлении с экспериментальными результатами.
Параметры Дубинина–Астахова для паров и газов.
[ редактировать ]| Сложный | Активированный уголь | , кДж/моль | Источник | ||
|---|---|---|---|---|---|
| Бензол | Углеродное молекулярное сито | 1.78 | 11.52 | 1.00 | [6] |
| Ацетон | Углеродное молекулярное сито | 2.00 | 9.774 | 0.85 | [6] |
| Бензол | Калибровка переменного тока | 2 | 18.23 | 1.00 | [7] |
| Ацетон | Калибровка переменного тока | 2 | 13.21 | 0.72 | [7] |
| Ацетон | Углеродное молекулярное сито | 2.8 | 20.29 | 0.72 | [8] |
| Бензол | Углеродное молекулярное сито | 3.1 | 28.87 | 1.00 | [8] |
| Азот | Углеродное молекулярное сито | 2.6 | 11.72 | 0.41 | [8] |
| Кислород | Углеродное молекулярное сито | 2.3 | 9.21 | 0.32 | [8] |
| Водород | Углеродное молекулярное сито | 2.5 | 5.44 | 0.19 | [8] |
Приложение
[ редактировать ]Во многих современных исследованиях теория Поланьи широко используется при изучении активированных углей, или технического углерода. Теория успешно использовалась для моделирования различных сценариев, таких как адсорбция газа на активированном угле и процесс адсорбции неионных полициклических ароматических углеводородов . [9] Позже эксперименты также показали, что он может моделировать ионные полициклические ароматические углеводороды, такие как фенолы и анилины . Совсем недавно изотерма адсорбции Поляни была использована для моделирования адсорбции углеродных наночастиц .
Характеристика углеродных наночастиц
[ редактировать ]Исторически эта теория использовалась для моделирования неоднородных адсорбатов и многокомпонентных растворенных веществ. Для определенных пар адсорбатов и адсорбентов математические параметры теории Поляни могут быть связаны с физико-химическими свойствами как адсорбентов, так и адсорбатов. Теория была использована для моделирования адсорбции углеродных нанотрубок и углеродных наночастиц. В исследовании Янга и Сина [5] Было показано, что эта теория лучше соответствует изотерме адсорбции, чем теория Ленгмюра , Фрейндлиха и распределения. В эксперименте изучалась адсорбция органических молекул на углеродных наночастицах и углеродных нанотрубках. Согласно теории Поляни, кривизна поверхностных дефектов углеродных наночастиц может влиять на их адсорбцию. Плоские поверхности частиц позволят большему количеству поверхностных атомов приближаться к адсорбирующим органическим молекулам, что увеличит потенциал и приведет к более сильным взаимодействиям. Теория оказалась полезной для понимания механизмов адсорбции органических соединений на углеродных наночастицах и оценки адсорбционной способности и сродства. Используя эту теорию, исследователи надеются, что смогут разработать углеродные наночастицы для конкретных нужд, например, использовать их в качестве сорбентов в экологических исследованиях.
Адсорбция из разных систем
[ редактировать ]В одном из более ранних исследований, проведенных Манесом М. и Хофером LJE, [10] Теория Поляни была использована для характеристики изотерм жидкофазной адсорбции на активированном угле различных концентраций с использованием широкого спектра органических растворителей. Было показано, что теория полиани хорошо подходит для этих различных систем. Благодаря результатам исследование представило возможность прогнозирования изотерм для подобных систем с использованием минимальных данных. Однако ограничением является то, что изотермы адсорбции для большого количества растворителей могут соответствовать только ограниченному диапазону. Кривая не смогла соответствовать данным в диапазоне высокой пропускной способности. Исследование также пришло к выводу, что в результатах было несколько аномалий. Адсорбция четыреххлористого углерода , циклогексана и сероуглерода на активированном угле не могла хорошо соответствовать кривой и еще требует объяснения. Исследователи, проводившие эксперимент, предполагают, что стерические эффекты свою роль могли сыграть четыреххлористого углерода и циклогексана. Исследование было проведено с использованием различных систем, таких как органические жидкости из водных растворов и органические твердые вещества из водных растворов.
Конкурентная адсорбция
[ редактировать ]Поскольку были исследованы различные системы, было проведено исследование по изучению индивидуальной адсорбции смешанного раствора. Это явление также называют конкурентной адсорбцией , поскольку растворенные вещества имеют тенденцию конкурировать за одни и те же места адсорбции. В эксперименте, проведенном Розене и Манесом, [11] конкурентная адсорбция глюкозы , мочевины , бензойной кислоты , фталида и п-нитрофенола . Используя модель адсорбции Поланьи, они смогли рассчитать относительную адсорбцию каждого соединения на поверхности активированного угля.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Поланьи, М (1963). «Потенциальная теория адсорбции». Наука . 141 (3585): 1010–013. Бибкод : 1963Sci...141.1010P . дои : 10.1126/science.141.3585.1010 . ПМИД 17739484 .
- ^ Домбровский, А. (2001). «Адсорбция от теории к практике» (PDF) . Достижения в области коллоидной и интерфейсной науки . 93 : 135–224.
- ^ Батт, Ханс-Юрген; Граф, Карлхайнц; Каппль, Майкл (2003). Физика и химия интерфейсов . стр. 193–195. дои : 10.1002/3527602313 . ISBN 978-3-527-40413-1 .
- ^ Дубинин М.М.; Астахов, В.А. (1971). «Развитие представлений об объемном заполнении микропор при адсорбции газов и паров микропористыми адсорбентами». Вестник Академии наук СССР, Отделение химических наук . 20 (1): 3–7. дои : 10.1007/bf00849307 .
- ^ Перейти обратно: а б Ян, К.; Син, Б. (2010). «Адсорбция органических соединений углеродными наноматериалами в водной фазе: теория Поланьи и ее применение». Химические обзоры . 110 (10): 5989–6008. дои : 10.1021/cr100059s . ПМИД 20518459 .
- ^ Перейти обратно: а б Дунг, С.Дж.; Ян, RT (1988). «Простая модель теории потенциала для прогнозирования адсорбции смешанных газов». Исследования в области промышленной и инженерной химии . 27 (4): 630–635. дои : 10.1021/ie00076a017 .
- ^ Перейти обратно: а б Тамон, Х.; Окадзаки, М. (1996). «Влияние кислотных поверхностных оксидов активированного угля на характеристики адсорбции газа». Карбон . 34 (6): 741–746. дои : 10.1016/0008-6223(96)00029-2 .
- ^ Перейти обратно: а б с д и Кавазоэ, К.; Каваи, Т.; Эгучи, Ю.; Итога, К. (1974). «Соотношение данных адсорбционного равновесия различных газов и паров на молекулярно-ситовом углероде» . Журнал химической инженерии Японии . 7 (3): 158–162. дои : 10.1252/jcej.7.158 .
- ^ Ян, К.; Ву, В.; Цзин, Q и Чжу, Л. (2008). «Водная адсорбция анилина, фенола и их заменителей многостенными углеродными нанотрубками». Экологические науки и технологии . 42 (21): 7931–6. Бибкод : 2008EnST...42.7931Y . дои : 10.1021/es801463v . ПМИД 19031883 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Манес, М.; Хофер, BJE (1969). «Применение теории адсорбционного потенциала Поланьи к адсорбции из раствора на активированном угле». Журнал физической химии . 73 (3): 584–590. дои : 10.1021/j100723a018 .
- ^ Манес, MR; Манес, М. (1976). «Применение теории адсорбционного потенциала Поланьи к адсорбции из раствора на активированном угле. VII. Конкурентная адсорбция твердых веществ из водного раствора». Журнал физической химии . 80 (9): 953–959. дои : 10.1021/j100550a007 .