Клеточная кора
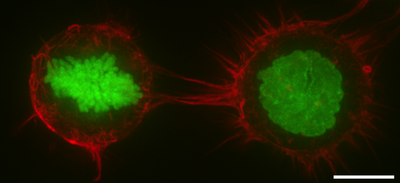
Клеточная кора , также известная как актин -кора, цитоскелет кортикального цитоскелета или коры актиномизина , представляет собой специализированный слой цитоплазматических белков на внутренней поверхности клеточной мембраны . Он функционирует как модулятор мембранного поведения и свойств клеточной поверхности. [ 1 ] [ 2 ] [ 3 ] В большинстве эукариотических клеток, в которых отсутствует клеточная стенка , кора представляет собой актиновую сеть, состоящую из F-актиновых нитей, двигателей миозина и актин-связывающих белков. [ 4 ] [ 5 ] Кора актомиозина прикреплена к клеточной мембране посредством мембранных белков, называемых белками ERM , которые играют центральную роль в контроле формы клеток. [ 1 ] [ 6 ] Составляющие белка коры проходят быстрый оборот, что делает кору механически жесткой и высоко пластиковой, два свойства необходимы для ее функции. В большинстве случаев кора находится в диапазоне от 100 до 1000 нанометров толщиной.
В некоторых клетках животных белковый спектр может присутствовать в коре. Спектрин помогает создать сеть с помощью сшитых актиновых филаментов. [ 3 ] Пропорции спектрина и актина варьируются в зависимости от типа ячейки. [ 7 ] Спектриновые белки и актиновые микрофиламенты прикрепляются к трансмембранным белкам с помощью белков прикрепления между ними и трансмембранными белками. Клеточная кора прикреплена к внутренней цитозольной поверхности плазматической мембраны в клетках, где белки спектрина и актин-микрофиламенты образуют сетчатую структуру, которая непрерывно восстанавливается полимеризацией , деполимеризацией и разветвлением.
Многие белки участвуют в регуляции и динамике коры, в том числе формами , с ролями в актиновой полимеризации, комплексах ARP2/3 , которые приводят к разветвлению актина и заворачиванию белков . Из -за процесса ветвления и плотности актиновой коры, цитоскелет коры может содержать очень сложную сетку, такую как фрактальная структура. [ 8 ] Специализированные клетки обычно характеризуются очень специфическим цитоскелетом кортикального актина. Например, в эритроцитах клеточная кора состоит из двухмерной сшитой упругих сети с пентагональной или гексагональной симметрией, привязанной к плазматической мембране и образуется главным образом спектрином , актином и анкирином . [ 9 ] У нейрональных аксонов актин или спектрический цитоскелет образует множество периодических колец [ 10 ] и в спермы жгутике он образует спиральную структуру. [ 11 ]
В растительных клетках клеточная кора усиливается корковыми микротрубочками, лежащими в основе плазматической мембраны. Направление этих корковых микротрубочек определяет, каким образом ячейка удлиняется при выращивании.
Функции
[ редактировать ]Кора в основном функционирует для получения натяжения под клеточной мембраной, позволяя ячейке изменить форму. [ 12 ] Это в первую очередь достигается через двигатели Myosin II , которые натягивают нити для создания напряжения. [ 12 ] Эти изменения в растяжении необходимы для того, чтобы ячейка изменила свою форму, когда она подвергается миграции клеток и делению клеток . [ 12 ]
При митозе и F-актин миозин II образуют высоко сократительную и равномерную кору для управления митотическими клетками . Поверхностное натяжение, вырабатываемое активностью коры актомиозина, генерирует внутриклеточное гидростатическое давление, способное вытеснять окружающие объекты, чтобы облегчить округление. [ 13 ] [ 14 ] Таким образом, клеточная кора служит для защиты микротрубочка от внешнего механического нарушения во время митоза. [ 15 ] Когда внешние силы применяются с достаточно большой скоростью и величиной к митотической клетке, возникает потеря коры F-актиновой гомогенности, что приводит к грыже пупок и временной потере способности защитить митотический веретено. [ 16 ] [ 17 ] Генетические исследования показали, что клеточная кора при митозе регулируется различными генами, такими как Rhoa, [ 18 ] WDR1, [ 19 ] ERM -белки, [ 20 ] ECT2, [ 21 ] PBL, CDC42, APKC, PAR6, [ 22 ] DJ-1 и FAM134A. [ 23 ]
У цитокинеза клеточная кора играет центральную роль, производя богатое миозином сократительное кольцо, чтобы сократить делящуюся клетку в две дочерние клетки. [ 24 ]
Сократимость клеточной коры является ключевым для амеодального типа клеточной миграции для многих событий метастазирования раковых клеток . [ 1 ] [ 25 ]
В дополнение к клеточной коре также играет важную роль в формировании тканей, органов и организмов. Натягивая комплексы адгезии, кора способствует расширению контактов с другими клетками или с помощью внеклеточного матрикса . Примечательно, что во время раннего развития млекопитающих кора соединяет клетки для управления уплотнением и образованием моралы . [ 26 ] [ 27 ] Кроме того, различия в растяжении коры приводит к сортировке внутренней клеточной массы и трогенторов трофэктодермы во время образования Морулы , [ 28 ] сортировка зародышевого слоя предшественников рыбок данио во время гаструляции , [ 29 ] [ 30 ] Инвагинация мезодермы и удлинение удлинения зародышевой полосы во время гаструляции дрозофилы. [ 31 ] [ 32 ]
Исследовать
[ редактировать ]Основное исследование клеточной коры проводится с помощью иммортализованных клеточных линий , обычно клеток HeLa , клеток S2 , нормальных клеток почек крысы и клеток M2 . [ 12 ] В частности, в клетках M2 клеточные пузырьки , которые образуются без коры, затем образуют один по мере того, как они втягиваются, часто используются для моделирования образования и состава коры. [ 12 ]
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в Salbreux G, Charras G, Paluch E (October 2012). "Actin cortex mechanics and cellular morphogenesis". Trends in Cell Biology. 22 (10): 536–45. doi:10.1016/j.tcb.2012.07.001. PMID 22871642.
- ^ Pesen D, Hoh JH (January 2005). "Micromechanical architecture of the endothelial cell cortex". Biophysical Journal. 88 (1): 670–9. Bibcode:2005BpJ....88..670P. doi:10.1529/biophysj.104.049965. PMC 1305044. PMID 15489304.
- ^ Jump up to: a b Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). "Cross-linking Proteins with Distinct Properties Organize Different Assemblies of Actin Filaments". Molecular Biology of the Cell (4th ed.). New York: Garland Science. ISBN 0-8153-3218-1.
- ^ Gunning PW, Ghoshdastider U, Whitaker S, Popp D, Robinson RC (June 2015). "The evolution of compositionally and functionally distinct actin filaments". Journal of Cell Science. 128 (11): 2009–19. doi:10.1242/jcs.165563. PMID 25788699.
- ^ Clark AG, Wartlick O, Salbreux G, Paluch EK (May 2014). "Stresses at the cell surface during animal cell morphogenesis". Current Biology. 24 (10): R484-94. Bibcode:2014CBio...24.R484C. doi:10.1016/j.cub.2014.03.059. PMID 24845681.
- ^ Fehon RG, McClatchey AI, Bretscher A (April 2010). "Organizing the cell cortex: the role of ERM proteins". Nature Reviews. Molecular Cell Biology. 11 (4): 276–87. doi:10.1038/nrm2866. PMC 2871950. PMID 20308985.
- ^ Machnicka B, Grochowalska R, Bogusławska DM, Sikorski AF, Lecomte MC (January 2012). "Spectrin-based skeleton as an actor in cell signaling". Cellular and Molecular Life Sciences. 69 (2): 191–201. doi:10.1007/s00018-011-0804-5. PMC 3249148. PMID 21877118.
- ^ Sadegh S, Higgins JL, Mannion PC, Tamkun MM, Krapf D (2017). "Plasma Membrane is Compartmentalized by a Self-Similar Cortical Actin Meshwork". Physical Review X. 7 (1): 011031. arXiv:1702.03997. Bibcode:2017PhRvX...7a1031S. doi:10.1103/PhysRevX.7.011031. PMC 5500227. PMID 28690919.
- ^ Gov NS (January 2007). "Active elastic network: cytoskeleton of the red blood cell". Physical Review E. 75 (1 Pt 1): 011921. Bibcode:2007PhRvE..75a1921G. doi:10.1103/PhysRevE.75.011921. PMID 17358198.
- ^ Xu K, Zhong G, Zhuang X (January 2013). "Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons". Science. 339 (6118): 452–6. Bibcode:2013Sci...339..452X. doi:10.1126/science.1232251. PMC 3815867. PMID 23239625.
- ^ Gervasi MG, Xu X, Carbajal-Gonzalez B, Buffone MG, Visconti PE, Krapf D (June 2018). "The actin cytoskeleton of the mouse sperm flagellum is organized in a helical structure". Journal of Cell Science. 131 (11): jcs215897. doi:10.1242/jcs.215897. PMC 6031324. PMID 29739876.
- ^ Jump up to: a b c d e Chugh P, Paluch EK (July 2018). "The actin cortex at a glance". J Cell Sci. 131 (14). doi:10.1242/jcs.186254. PMC 6080608. PMID 30026344.
- ^ Stewart MP, Helenius J, Toyoda Y, Ramanathan SP, Muller DJ, Hyman AA (January 2011). "Hydrostatic pressure and the actomyosin cortex drive mitotic cell rounding". Nature. 469 (7329): 226–30. Bibcode:2011Natur.469..226S. doi:10.1038/nature09642. PMID 21196934. S2CID 4425308.
- ^ Ramanathan SP, Helenius J, Stewart MP, Cattin CJ, Hyman AA, Muller DJ (February 2015). "Cdk1-dependent mitotic enrichment of cortical myosin II promotes cell rounding against confinement". Nature Cell Biology. 17 (2): 148–59. doi:10.1038/ncb3098. PMID 25621953. S2CID 5208968.
- ^ Lancaster, O (2013). "Mitotic Rounding Alters Cell Geometry to Ensure Efficient Bipolar Spindle Formation". Developmental Cell. 25 (3): 270–283. doi:10.1016/j.devcel.2013.03.014. PMID 23623611.
- ^ Charras, Guillaume; Paluch, Ewa (September 2008). "Blebs lead the way: how to migrate without lamellipodia". Nature Reviews Molecular Cell Biology. 9 (9): 730–736. doi:10.1038/nrm2453. PMID 18628785.
- ^ Cattin, Cedric (2015). "Mechanical control of mitotic progression in single animal cells". PNAS. 112 (36): 11258–11263. Bibcode:2015PNAS..11211258C. doi:10.1073/pnas.1502029112. PMC 4568679. PMID 26305930.
- ^ Maddox, A (2003). "RhoA is required for cortical retraction and rigidity during mitotic cell rounding". J. Cell Biol. 160 (2): 255–265. doi:10.1083/jcb.200207130. PMC 2172639. PMID 12538643. S2CID 1491406.
- ^ Fujibuchi, T (2005). "AIP1/WDR1 supports mitotic cell rounding". Biochem. Biophys. Res. Commun. 327 (1): 268–275. doi:10.1016/j.bbrc.2004.11.156. PMID 15629458.
- ^ Kunda, P (2008). "Moesin Controls Cortical Rigidity, Cell Rounding, and Spindle Morphogenesis during Mitosis". Current Biology. 18 (2): 91–101. Bibcode:2008CBio...18...91K. doi:10.1016/j.cub.2007.12.051. PMID 18207738. S2CID 831851.
- ^ Matthews, H (2013). "Changes in Ect2 Localization Couple Actomyosin-Dependent Cell Shape Changes to Mitotic Progression". Developmental Cell. 23 (2): 371–383. doi:10.1016/j.devcel.2012.06.003. PMC 3763371. PMID 22898780. S2CID 1295956.
- ^ Rosa, A (2015). "Ect2/Pbl acts via Rho and polarity proteins to direct the assembly of an isotropic actomyosin cortex upon mitotic entry". Developmental Cell. 32 (5): 604–616. doi:10.1016/j.devcel.2015.01.012. PMC 4359025. PMID 25703349. S2CID 17482918.
- ^ Toyoda, Y (2017). "Genome-scale single-cell mechanical phenotyping reveals disease-related genes involved in mitotic rounding". Nature Communications. 8 (1): 1266. Bibcode:2017NatCo...8.1266T. doi:10.1038/s41467-017-01147-6. PMC 5668354. PMID 29097687. S2CID 19567646.
- ^ Green RA, Paluch E, Oegema K (November 2012). "Cytokinesis in animal cells". Annual Review of Cell and Developmental Biology. 28: 29–58. doi:10.1146/annurev-cellbio-101011-155718. PMID 22804577.
- ^ Olson MF, Sahai E (April 2009). "The actin cytoskeleton in cancer cell motility". Clinical & Experimental Metastasis. 26 (4): 273–87. doi:10.1007/s10585-008-9174-2. PMID 18498004.
- ^ Maître, Jean-Léon; Niwayama, Ritsuya; Turlier, Hervé; Nédélec, François; Hiiragi, Takashi (July 2015). "Pulsatile cell-autonomous contractility drives compaction in the mouse embryo". Nature Cell Biology. 17 (7): 849–855. doi:10.1038/ncb3185. PMID 26075357.
- ^ Firmin, Julie; Ecker, Nicolas; Rivet Danon, Diane; Özgüç, Özge; Barraud Lange, Virginie; Turlier, Hervé; Patrat, Catherine; Maître, Jean-Léon (16 May 2024). "Mechanics of human embryo compaction". Nature. 629 (8012): 646–651. Bibcode:2024Natur.629..646F. doi:10.1038/s41586-024-07351-x. PMID 38693259.
- ^ Maître, Jean-Léon; Turlier, Hervé; Illukkumbura, Rukshala; Eismann, Björn; Niwayama, Ritsuya; Nédélec, François; Hiiragi, Takashi (August 2016). "Asymmetric division of contractile domains couples cell positioning and fate specification". Nature. 536 (7616): 344–348. Bibcode:2016Natur.536..344M. doi:10.1038/nature18958. PMC 4998956. PMID 27487217.
- ^ Krieg, M.; Arboleda-Estudillo, Y.; Puech, P.-H.; Käfer, J.; Graner, F.; Müller, D. J.; Heisenberg, C.-P. (April 2008). "Tensile forces govern germ-layer organization in zebrafish". Nature Cell Biology. 10 (4): 429–436. doi:10.1038/ncb1705. PMID 18364700.
- ^ Maître, Jean-Léon; Berthoumieux, Hélène; Krens, Simon Frederik Gabriel; Salbreux, Guillaume; Jülicher, Frank; Paluch, Ewa; Heisenberg, Carl-Philipp (12 October 2012). "Adhesion Functions in Cell Sorting by Mechanically Coupling the Cortices of Adhering Cells". Science. 338 (6104): 253–256. Bibcode:2012Sci...338..253M. doi:10.1126/science.1225399. PMID 22923438.
- ^ Bertet, Claire; Sulak, Lawrence; Lecuit, Thomas (June 2004). "Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation". Nature. 429 (6992): 667–671. Bibcode:2004Natur.429..667B. doi:10.1038/nature02590. PMID 15190355.
- ^ Martin, Adam C.; Kaschube, Matthias; Wieschaus, Eric F. (January 2009). "Pulsed contractions of an actin–myosin network drive apical constriction". Nature. 457 (7228): 495–499. Bibcode:2009Natur.457..495M. doi:10.1038/nature07522. PMC 2822715. PMID 19029882.
Further reading
[edit]- Bray, Dennis (2000). "Actin and Membranes". Cell Movements. pp. 81–101. doi:10.4324/9780203833582-7. ISBN 978-0-203-83358-2.