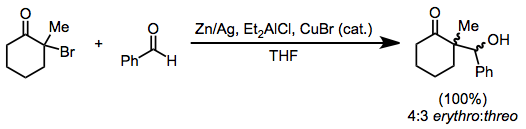Восстановительное дегалогенирование галогенкетонов
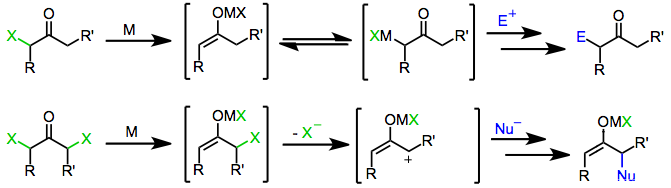
В органической химии α -галогенкетоны могут быть восстановлены с потерей атома галогена с образованием енолятов . α-галогенкетоны легко получают из кетонов с помощью различных реакций галогенирования кетонов , а продукты представляют собой реакционноспособные промежуточные продукты , которые можно использовать для множества других химических реакций .
Введение
[ редактировать ]Восстановление α-галогенкетонов приводит к образованию разнообразных структур продуктов, которые могут демонстрировать уникальные закономерности замещения и реакционную способность. Так, восстановление α,α'-дигалогенкетонов приводит к образованию 2-оксиаллильных металлокомплексов, которые участвуют в реакциях [4+3] и [3+2] циклоприсоединения в качестве 2π-компонента. [ 1 ] Промежуточные соединения 2-оксиаллильных металлов также могут перехватывать нуклеофилы в процессе, который включает умполунг по α-углероду. [ 2 ] Кроме того, поскольку восстановление моногалогенкетонов приводит к образованию енолятов сайт-специфичным образом, реакции, связанные с енолятами ( алкилирование , альдоль , Михаэль ), можно проводить с использованием галогенкетонных субстратов в восстановительных условиях.
(1)
Механизм
[ редактировать ]Многие восстановители, используемые в реакциях этого типа, коммерчески доступны. Некоторые из них требуют подготовки и немедленного использования, включая пары цинк-медь и пары цинк-серебро. [ 3 ] [ 4 ] и органокупраты [ 5 ]
Моногалогенкетоны
[ редактировать ]Моногалогенкетоны восстанавливаются как одноэлектронными, так и двухэлектронными восстановителями с образованием исходных кетонов, производных, функционализированных электрофилами, или продуктов димеризации . Сам механизм восстановления зависит от природы восстановителя.
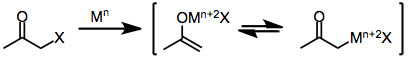
Одноэлектронные восстановители, такие как d 6 или д 1 Комплексы переходных металлов первоначально отдают один электрон галогенкетону. Фрагментация образующегося анион-радикала приводит к образованию органического радикала и галогенид-аниона. Отдача второго электрона от второго эквивалента восстановителя приводит к образованию енолята металла, в котором степень окисления восстановителя увеличивается на единицу. [ 6 ]
(2)
Двухэлектронные восстановители , наиболее известным из которых является металлический цинк , подвергаются прямому окислительному присоединению к моногалогенкетонам с образованием енолятов металлов, в которых степень окисления металла увеличивается в два раза. Последующее диспропорционирование непрореагировавшим галогенкетоном иногда приводит к образованию двух эквивалентов енольного радикала, которые впоследствии могут димеризоваться. [ 7 ]
(3)
Обработка енолятов, полученных из одно- или двухэлектронных восстановителей, электрофилом, дает в качестве конечного продукта α-функционализированные кетоны.
α,α-дигалогенкетоны
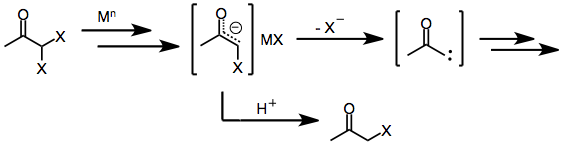
[ редактировать ]Подобно моногалогенкетонам, геминальные дигалогенкетоны первоначально образуют еноляты металлов при воздействии одно- или двухэлектронных восстановителей. В присутствии протонного растворителя восстановление прекращается на этой стадии с образованием моногалогенкетона (который может быть дополнительно восстановлен до исходного кетона). [ 8 ] Однако в отсутствие улавливающего электрофила или протонного растворителя потеря оставшегося галогенида из енолятного промежуточного соединения приводит к образованию α-кетокарбенов или карбеноидов, которые подвергаются реакциям внедрения CH. [ 9 ]
(4)
α,α'-дигалогенкетоны
[ редактировать ]Первоначальное восстановление α,α’-дигалогенкетонов приводит к образованию промежуточных енолятов металлов. Потеря оставшегося галогенида приводит к образованию 2-оксиаллильных комплексов металлов, которые вступают в реакции циклоприсоединения [4+3] и [3+2] в присутствии диенов или олефинов. [ 1 ] Изомеризация 2-оксиаллильных комплексов металлов в формы циклопропанона и алленоксида происходит быстро и обратимо; увеличение ковалентного характера связи кислород-металл благоприятствует 2-оксиаллильному изомеру. [ 10 ]
(5)
Область применения и ограничения
[ редактировать ]Восстановление α-галогенкетонов может привести к образованию исходных кетонов, частично восстановленных галогенкетонов или продуктов, возникающих в результате перехвата промежуточных продуктов на пути восстановления нуклеофилами или электрофилами. Полученные продукты зависят как от восстановителя, так и от характера замещения галогенкетона.
Моногалогенкетоны
[ редактировать ]Моногалогенкетоны могут быть восстановлены до соответствующего исходного кетона металлическим литием с последующим протонированием енолята. [ 11 ] Другие полезные восстановители для этого превращения включают диалкилкупраты лития. [ 12 ] и гексакарбонилоксид молибдена. [ 13 ]
(6)
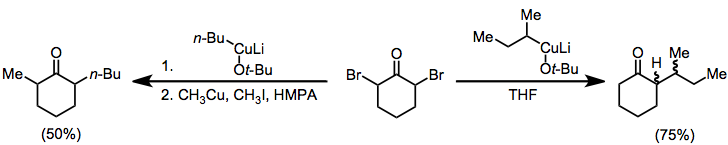
Алкилирование енолятов, образующихся за счет восстановления моногалогенкетонов, ограничивается наиболее реакционноспособными алкилгалогенидами . [ 14 ] Однако восстановление в присутствии альдегида приводит к образованию восстановительных альдольных продуктов, аналогично реакции Реформатского галогенэфиров. Цинковую пыль можно использовать отдельно; или в виде амальгамы в сочетании с хлоридом диэтилалюминия или с каталитическими количествами бромида меди (I) . [ 15 ]
(7)
Восстановительная димеризация может быть результатом сочетания двух промежуточных α-ацильных радикалов или нуклеофильной атаки енолята металла на непрореагировавший галогенкетон. Хотя часто в результате образуются сложные реакционные смеси, [ 6 ] в некоторых случаях возможна селективная димеризация. В приведенном ниже примере распределение продукта зависит от растворителя. [ 16 ]
(8)
α,α-дигалогенкетоны
[ редактировать ]В зависимости от используемых условий геминальные дигалогенкетоны могут быть восстановлены до исходного кетона, моногалогенкетона или функционализированного моногалогенкетона с помощью органокупратов . [ 17 ] Нагревание функционализированных α-галогенкетонов, полученных в этих условиях, от −40 °C до комнатной температуры приводит к образованию соответствующего α,β-ненасыщенного кетона.
(9)
α,α'-дигалогенкетоны
[ редактировать ]Органокупраты также можно использовать для восстановления α,α'-дигалогенкетонов до алкилированных кетонов. В отсутствие электрофила моноалкилкетон выделяется с хорошим выходом; [ 18 ] при добавлении алкилйодида диалкилкетон выделяется (геминальное алкилирование является проблематичной побочной реакцией). [ 19 ]
(10)
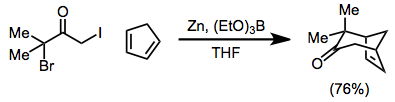
2-оксиаллильные интермедиаты металлов, образующиеся при восстановлении α,α'-дигалогенкетонов комплексами железа(0), участвуют в реакциях [4+3] и [3+2] циклоприсоединения с образованием циклогептенонов и циклопентанонов соответственно. Во время реакций циклоприсоединения [3+2] заместитель в алкене может удаляться с образованием циклопентенонов из алкенов в одном реакторе. [ 20 ]
(11)
Область применения [4+3]-циклоприсоединения широка. [ 1 ] — реакция может быть использована для образования циклогептенонов, а также мостиковых [ 21 ] или слитый [ 22 ] полициклические продукты. Восстановление может осуществляться в присутствии 4π-компонента. [ 23 ]
(12)
Синтетические приложения
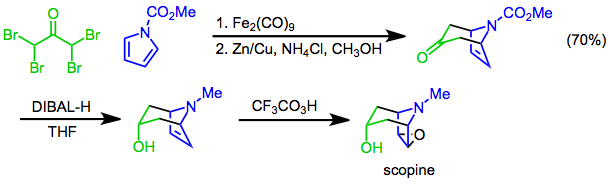
[ редактировать ][4+3]-циклоприсоединения пирролов могут быть использованы для установления бициклического скелета тропановых алкалоидов . Например, в синтезе скопина используется [4+3]-циклоприсоединение N в качестве ключевой стадии -метоксикарбонилпиррола и α,α,α',α'-тетрабромацетона. Диастереоселективное восстановление диизобутилалюминийгидридом (DIBAL-H) с последующим эпоксидированием . трифторперуксусной кислотой [ 24 ] дает цель.
(13)
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Ригби, Дж.; Пигге, C. Org. Реагировать. 1997 , 51 , 351.
- ^ Фрай, Дж.; О'Ди, JJ Org. хим. 1975 , 40 , 3625.
- ^ ЛеГофф, E J. Org. хим. 1964 , 29 , 2048.
- ^ Денис, М.; Жирар, К.; Кония, М. Синтез , 1972 , 549.
- ^ Хо, Л.; Ола, А. Синтез , 1976 , 807.
- ^ Перейти обратно: а б Альпер, Х.; https://doi.org/10.1103/PhysRevLett.10.000000, перекрестная ссылка Google Scholar, CAS 19. Keung, E.H.J. Org. хим. 1972 , 37 , 2566.
- ^ Гера, Э.; Перри, Х.; Шуа, S.J. Chem. Соц., хим. Общий. , 1973 , 858.
- ^ Грин, А.Э.; Депре, Ж.-П. Ж. Ам. хим. Соц. 1979 , 101 , 4003.
- ^ Скотт, Т.; Коттон, DJ Am. хим. Соц. 1973 , 95 , 2708.
- ^ Бингхэм, К.; Дьюар, С.; Ло, Х. Дж. Ам. хим. Соц. 1975 , 97 , 1302.
- ^ Дюбуа, Ж.-Э.; Фурнье, П.; Лион, К. Ч. Р. Акад. наук, сер. С 1974 , 279 , 965 (1974).
- ^ Булл, младший; Туинман, А. Тетраэдр Летт . 1973 , 4349.
- ^ Альпер Х.; Патти, LJ Org. хим. 1979 , 44 , 2568.
- ^ Дюбуа, Э.; Фурнье, П.; Лион, C ЧР акад. наук, сер. С 1974 , 279 , 965.
- ^ Maruoka, K.; Hashimoto, S.; Kitagawa, Y.; Yamamoto, H.; Nozaki, H J. Am. Chem. Soc. 1977 , 99 , 7705.
- ^ Ёсисато, Э.; Цуцуми, С. Дж. Ам. хим. Соц. 1968 , 90 , 4488.
- ^ Депре, Ж.-П.; Грин, AE J. Org. хим. 1980 , 45 , 2036.
- ^ Познер, Х.; Стерлинг, Дж. Дж. Ам. хим. Соц. 1973 , 95 , 3076.
- ^ Познер, Х.; Стерлинг, Дж.; Уиттен, Э.; Ленц, М.; Брунель, Дж. Дж. Ам. хим. Соц. 1975 , 97 , 107.
- ^ Хаякава, Ю.; Ёкояма, К.; Ноёри, Р.Дж.Ам. хим. Соц. 1978 , 100 , 1799.
- ^ Ямамото, Х.; Нозаки, H Soc. К .; Нойори, М.; Хаякава , J. , 220.
- ^ Хаякава, Ю.; Ёкояма, К.; Нойори, Р. Дж. Ам. хим. Соц. 1978 , 100 , 1799.
- ^ Хоффманн, Р.; Икбал, Н. Тетраэдр Летт . 1975 , 4487.
- ^ Хаякава, Ю.; Баба, Ю.; Макино, С.; Ноёри, RJ Am. хим. Соц. 1978 , 100 , 1786.