Диэтилалимуминий хлорид
| |
| Имена | |
|---|---|
| Имя IUPAC
Хлородиэтилулуман
| |
| Другие имена
Хлородиэтилалуминий
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 4123259 | |
| Chemspider | |
| Echa Infocard | 100.002.253 |
| ЕС номер |
|
PubChem CID
|
|
| Rtecs номер |
|
| НЕКОТОРЫЙ | |
| Номер | 3394 |
Comptox Dashboard ( EPA )
|
|
| Характеристики | |
| C 8 H 20 AL 2 CL 2 | |
| Молярная масса | 241.11 g·mol −1 |
| Появление | Бесцветная жидкость [ 1 ] |
| Плотность | 0,96 г/см 3 [ 1 ] |
| Точка плавления | −74 ° C (-101 ° F; 199 K) [ 1 ] |
| Точка кипения | 125-126 ° C (от 257 до 259 ° F; от 398 до 399 К) при 50 мм рт. |
| Реагирует [ 1 ] | |
| Давление паров | 3 мм рт.ст. (при 60 ° С) |
| Опасности | |
| GHS Маркировка : | |
 
| |
| Опасность | |
| H225 , H250 , H260 , H261 , H314 | |
| P210 , P222 , P223 , P231+P232 , P233 , P240 , P241 , P242 , P243 , P260 , P264 , P280 , P301+P330+P331 , P302+P334 , P303+P361+P353 , P30+P340+P30+P30+P340+P340+ , P340+P340 P334, стр. P338 , P310 , P321 , P335+P334 , P363 , P370+P378 , P402+P404 , P403+P235 , P405 , P422 , P501 | |
| NFPA 704 (Огненная бриллиант) | |
| точка возгорания | −18 ° C (0 ° F; 255 K) |
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |
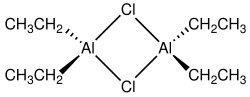
Хлорид диэтилалуминия , сокращенного дьяка, представляет собой органоалуминиевое соединение . Хотя это часто учитывается химическая формула (C 2 H 5 ) 2 Alcl, она существует как димер, [(C 2 H 5 ) 2 Alcl] 2 Это предшественник катализаторов Ziegler-Natta, используемых для производства полиолефинов . Соединение также является кислотой Льюиса , полезной в органическом синтезе . Соединение представляет собой бесцветное восковое твердое вещество, но обычно обрабатывается как раствор в углеводородных растворителях. Он очень реактивный, даже пирофорический . [ 2 ]
Структура и связь
[ редактировать ]Соединения эмпирической формулы Alr 2 Cl (r = алкил , арил ) обычно существуют в виде димеров с формулой (R 2 Al) 2 (μ-Cl) 2 . Мостчивые лиганды (обозначенные «μ-»)-это галогениды, а не органические заместители. Алюминий принимает тетраэдрическую геометрию. Каждый центр AL (III) следует правилу октета . [ 3 ] [ 4 ] Напротив, триэтилулиминие и триметилалиминиевый характеризуют мостичные алкильные группы, и эти соединения нарушают правило октета.
Производство
[ редактировать ]Хлорид диэтилалуминия может быть получен из сесвихлорида этилалуминия , (C 2 H 5 ) 3 Al 2 Cl 3 , по восстановлению натрием: [ 5 ]
- 2 (C 2 H 5 ) 3 Al 2 Cl 3 + 3 Na → 3 (C 2 H 5 ) 2 Alcl + Al + 3 NaCl
Он также получен из реакции триэтилулиминия с гидрохлорной кислотой:
- (C 2 H 5 ) 3 Al + HCl → (C 2 H 5 ) 2 Alcl + C 2 H 6
Также можно использовать реакции репортарирования:
- 2 (C 2 H 5 ) 3 Al + Alcl 3 → 3 (C 2 H 5 ) 2 Alcl
- (C 2 H 5 ) 3 Al 2 Cl 3 + (C 2 H 5 ) 3 Al → 3 (C 2 H 5 ) 2 Alcl
Использование
[ редактировать ]Хлорид диэтилалуминия и другие органоалуминиевые соединения используются в комбинации с соединениями переходных металлов в качестве катализаторов Ziegler -Natta для полимеризации различных алкенов. [ 6 ]
В качестве кислоты Льюиса хлорид диэтилалиминия также имеет использование в органическом синтезе. Например, он используется для катализации реакций Diels -Alder и ENE . Альтернативно, он может реагировать как нуклеофил или протоновый мусорщик. [ 2 ]
Безопасность
[ редактировать ]Хлорид диэтилалуминия является не только легковоспламеняющимся, но и пирофорическим.
Ссылки
[ редактировать ]- Ху, да; Цзян, HL; Wang, HH, «Приготовление высоковетвленного полиэтилена с акенафтендимииминовым хлоридом никеля/диэтилалиминовым хлоридным катализатором». Китайский журнал полимерной науки 2006, 24 (5), 483–488.
- Яо, YM; Ци, Гз; Шен, Q.; Ху, JY; Lin, YH, «Реакционная и структурная характеристика двухвалентного самарию арилоксида с диэтилалиминим хлоридом». Китайский научный бюллетень 2003, 48 (20), 2164–2167.
- ^ Jump up to: а беременный в дюймовый Джон Рамбл (18 июня 2018 г.). Справочник по химии и физике CRC (99 -е изд.). CRC Press. С. 4–40. ISBN 978-1138561632 .
- ^ Jump up to: а беременный Снайдер, Барри Б. (2001). «Диэтилалиминий хлорид». Энциклопедия реагентов для органического синтеза . doi : 10.1002/047084289x.rd165 . ISBN 0-471-93623-5 .
- ^ Брендхауген, Кристиан; Хааланд, Арне ; Новак, Дэвид п.; Østvold, Terje; Бьорсет, Альф ; Пауэлл, Д.Л. (1974). «Молекулярная структура диметилалимуминового димера хлорида, [(CH3) 2Alcl] 2 , переделфицированная с помощью дифференциации электронов газовой фазы» . Acta Chemica Scandinavica . 28a : 45–47. doi : 10.3891/acta.chem.scand.28a-0045 .
- ^ McMahon, C. Niamh; Фрэнсис, Джули А.; Баррон, Эндрю Р. (1997). «Молекулярная атрактура [(t bu ) 2 al (μ-cl)] 2». Журнал химической кристаллографии . 27 (3): 191–194. doi : 10.1007/bf02575988 . S2CID 195242291 .
- ^ Краузе, Майкл Дж.; Орланди, Фрэнк; Saurage, Alfred T.; Zietz, Joseph R. (2000), «Алюминиевые соединения, органические», Энциклопедия промышленной химии Ульмана VCH Verlag Gmbh & Co. Kgaa Wiley - , Вейнхейм, Германия : стр . , ISBN 978-3-527-30673-2
- ^ Fisch, AG (2000). «Катализаторы Циглер -Натта». Кирк-Отмер Энциклопедия химических технологий . Уайли. С. 1–22. doi : 10.1002/0471238961.2609050705030303.a01.pub2 . ISBN 978-0-471-48494-3 Полем S2CID 213111515 .
Внешние ссылки
[ редактировать ] СМИ, связанные с хлоридом диэтилалуминия в Wikimedia Commons
СМИ, связанные с хлоридом диэтилалуминия в Wikimedia Commons
