Циклопопропанон
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
Циклопопропанон | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
ПабХим CID
|
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| C3HC3H4O O | |
| Молярная масса | 56.06326 |
| Появление | бесцветный |
| Плотность | 0,867 г/мл при 25 °C |
| Температура плавления | -90 ° C (-130 ° F; 183 К) |
| Точка кипения | От 50 до 53 ° C (от 122 до 127 ° F; от 323 до 326 К) при 22 мм рт. ст. |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
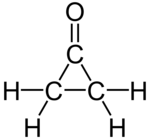
Циклоппропанон представляет собой органическое соединение с молекулярной формулой (CH 2 ) 2 CO, состоящее из циклопропанового углеродного каркаса с кетоновой функциональной группой . Исходное соединение лабильно и очень чувствительно даже к слабым нуклеофилам. Суррогаты циклопропанона включают кетали . [ 1 ]
Подготовка
[ редактировать ]Циклоппропанон получен реакцией кетена с диазометаном. [ 1 ] [ 2 ] в нереакционноспособном растворителе, таком как дихлорметан . [ 3 ] Эти растворы стабильны при температуре -78 ° C. В присутствии протонных реагентов, таких как карбоновые кислоты, первичные и вторичные амины и спирты, циклопропанон превращается в аддукты, которые часто можно выделить при комнатной температуре: [ 4 ] [ 5 ]
- (CH 2 ) 2 CO + XH → (CH 2 ) 2 C(X)(OH)
(XH = R 2 N-H, HO-H, RO-H)
Структура и связь
[ редактировать ]Атомы C 3 O компланарны. Как следует из микроволнового спектра , длина связи H 2 C-CH 2 , равная 157,5 пм , необычно длинна. Напротив, длины связей CC в циклопропане составляют 151 пм. Длина связи C=O 119 пм коротка по сравнению с длиной связи 123 пм в ацетоне . [ 1 ]
Значение ν C=O в инфракрасном спектре около 1815 см. −1 , как 70 см −1 выше, чем значения для типичного кетона.
Производные
[ редактировать ]Циклопопропаноны являются промежуточными продуктами перегруппировки Фаворского с циклическими кетонами, где образование карбоновой кислоты сопровождается сжатием кольца.
Циклопопропаноны реагируют как 1,3-диполи при циклоприсоединениях , например, с циклическими диенами, такими как фуран . [ 1 ] оксиаллильный промежуточный продукт или валентный таутомер структуры предполагается В качестве активного промежуточного соединения или даже бирадикальной (образующийся при разрыве связи C2-C3) (сравните с родственным триметиленметаном ).
Через это промежуточное соединение протекают и другие реакции циклопропанонов. Например, энантиочистый (+)- транс -2,3-ди-трет-бутилциклопропанон рацемизируется при нагревании до 80 °C. [ 6 ]
Оксиаллильный интермедиат также предложен при фотохимическом превращении 3,5-дигидро-4H-пиразол-4-она с вытеснением азота в индан : [ 7 ]
В этой реакции оксиаллильный промежуточный продукт A , находящийся в химическом равновесии с циклопропаноном B, атакует фенильное кольцо через его карбокатион, образуя временный 1,3-циклогексадиен C (со следами УФ-излучения, подобными изотолуолу ), с последующей рероматизацией. Разница в энергии между А и Б составляет от 5 до 7 ккал / моль (от 21 до 29 кДж /моль).
Коприн
[ редактировать ]Производное циклопропанона 1-аминоциклопропанол образуется в природе в результате гидролиза коприна . , токсина, содержащегося в некоторых грибах 1-Аминоциклопропанол является ингибитором фермента ацетальдегиддегидрогеназы . [ 8 ]
См. также
[ редактировать ]- Другие циклические кетоны: циклобутанон , циклопентанон , циклогексанон.
- Другие производные циклопропана: циклопропен , циклопропенон.
Ссылки
[ редактировать ]- ^ Jump up to: а б с д Вассерман, Гарри Х.; Бердал, Дональд Р.; Лу, Та-Юнг (1987). «Химия циклопропанонов». Химия функциональных групп PATAI: Циклопропильная группа . стр. 1455–1532. дои : 10.1002/0470023449.ch23 . ISBN 9780470023440 .
- ^ Турро, Николас Дж. (1969). «Циклопропаноны». Отчеты о химических исследованиях . 2 : 25–32. дои : 10.1021/ar50013a004 .
- ^ Де Кимпе, Норберт. «Циклопропанон». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rc302 .
- ^ Салаун, Дж.; Маргарита, Дж. (1985). «Циклопропанон-этил-полуацеталь из этил-3-хлорпропаноата». Органические синтезы . 63 : 147. дои : 10.15227/orgsyn.063.0147 .
- ^ Салаун, Жак (1983). «Циклопропаноновые полуацетали». Химические обзоры . 83 (6): 619–632. дои : 10.1021/cr00058a002 .
- ^ Грин, Фредерик Д.; Склов, Дэвид Б.; Пасос, Хосе Ф.; Кэмп, Рональд Л. (1970). «Термические реакции циклопропанона. Рацемизация и декарбонилирование транс-2,3-ди-трет-бутилциклопропанона». Журнал Американского химического общества . 92 (25): 7488. doi : 10.1021/ja00728a051 .
- ^ Моисеев Андрей Георгиевич; Абэ, Манабу; Данилов Евгений О.; Некерс, Дуглас К. (2007). «Первое прямое обнаружение 2,3-диметил-2,3-дифенилциклопропанона». Журнал органической химии . 72 (8): 2777–2784. дои : 10.1021/jo062259r . ПМИД 17362038 .
- ^ Уайзман, Джеффри С.; Абелес, Роберт Х. (май 2002 г.). «Механизм ингибирования альдегиддегидрогеназы гидратом циклопропанона и грибным токсином коприном». Биохимия . 18 (3): 427–435. дои : 10.1021/bi00570a006 . ПМИД 369602 .


