Снятие отпечатков пальцев сообщества
Снятие отпечатков пальцев сообщества — это набор методов молекулярной биологии которые можно использовать для быстрого описания разнообразия микробного , сообщества. Вместо того, чтобы напрямую идентифицировать или подсчитывать отдельные клетки в образце окружающей среды, эти методы показывают, сколько вариантов гена присутствует . В целом предполагается, что каждый вариант гена представляет собой отдельный тип микроба. Снятие отпечатков пальцев сообществ используется микробиологами, изучающими различные микробные системы (например, морские, пресноводные, почвенные и человеческие микробные сообщества) для измерения биоразнообразия или отслеживания изменений в структуре сообщества с течением времени. Этот метод анализирует образцы окружающей среды путем анализа геномной ДНК . Этот подход предлагает альтернативу культивированию микробов , что важно, поскольку большинство микробов невозможно культивировать в лаборатории. [ 1 ] Снятие отпечатков пальцев в сообществе не приводит к идентификации отдельных видов микробов; вместо этого он представляет общую картину микробного сообщества. Эти методы в настоящее время в значительной степени заменяются высокопроизводительным секвенированием, таким как целевой анализ микробиома (например, секвенирование 16s рРНК) и метагеномика .
Использовать
[ редактировать ]Анализ отпечатков пальцев начинается с образца окружающей среды (например, морской воды или почвы), из которого извлекается общая ДНК. (Общая ДНК содержит смесь генетического материала всех микробов, присутствующих в образце.) Затем в качестве мишени для анализа выбирается конкретный ген или участок ДНК, исходя из предположения, что каждый вид микробов будет иметь свой вариант гена (также называемый « филотип »). Для визуализации филотипов, присутствующих в образце, можно использовать различные методы (см. ниже). Поскольку цель снятия отпечатков пальцев сообщества состоит в том, чтобы получить общее представление о структуре сообщества, это особенно полезный метод для анализа данных временных рядов , собранных на местах. Например, можно изучить закономерности микробной последовательности в среде обитания или изучить реакцию микробного сообщества на возмущения окружающей среды, такие как выброс загрязняющего вещества. В зависимости от того, какая информация требуется, целью могут быть разные гены. Наиболее распространены малые субъединицы гены рибосомальной РНК (рРНК), такие как 16S рРНК . Эти гены часто используются в микробном филогенетическом анализе, поэтому существуют хорошо зарекомендовавшие себя методы их изучения. Другими генами, представляющими интерес, могут быть те, которые играют ключевую роль в различных метаболических процессах. [ 1 ]
Преимущества и недостатки
[ редактировать ]Преимущества коллективного снятия отпечатков пальцев заключаются в том, что его можно выполнить быстро и относительно дешево, а при анализе можно одновременно обрабатывать большое количество образцов. [ 2 ] [ 3 ] Эти свойства делают дактилоскопию сообществ особенно полезной для мониторинга изменений в микробных сообществах с течением времени. Кроме того, методы снятия отпечатков пальцев не требуют наличия априорных данных о последовательностях организмов в образце. Недостатком сбора отпечатков пальцев сообщества является то, что он дает в основном качественные, а не количественные данные. [ 4 ] При использовании качественных данных может быть сложно сравнивать закономерности, наблюдаемые в разных исследованиях или между разными исследователями. Кроме того, дактилоскопия сообщества не позволяет напрямую идентифицировать таксоны в образце окружающей среды, хотя данные, полученные с помощью определенных методов (например, DGGE ), могут быть проанализированы дополнительно, если есть желание идентифицировать. Некоторые авторы указывают на плохую воспроизводимость результатов некоторых методов дактилоскопии. [ 3 ] в то время как другие авторы критиковали неточность оценок численности и неспособность некоторых методов выявить присутствие редких таксонов. [ 5 ] Например, методом DGGE трудно обнаружить микробы, составляющие менее 0,5–1% бактериального сообщества. [ 6 ]
Техники
[ редактировать ]В этом разделе представлены три метода снятия отпечатков пальцев сообщества.
Полиморфизм длины терминального рестрикционного фрагмента (T-RFLP)
[ редактировать ]Полиморфизм длины терминального рестрикционного фрагмента (T-RFLP) - это метод, в котором используются флуоресцентно -меченные фрагменты ДНК для получения отпечатка пальца сообщества. [ 2 ] [ 7 ] В этом разделе представлено краткое объяснение T-RFLP в конкретном контексте снятия отпечатков пальцев в сообществе . Более подробное объяснение можно найти в статье T-RFLP .
Процедура
[ редактировать ]Чтобы выполнить T-RFLP (рис. 1), необходимо выбрать ген-мишень (например, ген 16S рРНК) для амплификации с помощью ПЦР . По крайней мере, один праймер , используемый в реакции ПЦР, флуоресцентно помечен на 5' -конце. После ПЦР-амплификации каждый скопированный сегмент ДНК несет флуоресцентную метку. Затем ферменты рестрикции используются для разрезания амплифицированной ДНК в определенных сайтах узнавания . В основе лежит предположение, что каждый микроб в образце будет иметь разную последовательность целевого гена, поэтому фермент рестрикции разрезает ДНК каждого микроба в разных местах. (Считается, что каждый отдельный сайт рестрикции представляет собой единую операционную таксономическую единицу [OTU]). Таким образом, фермент будет производить фрагмент одной длины для каждого типа микробов, присутствующих в образце. Результатом переваривания является набор рестрикционных фрагментов разной длины, каждый из которых флуоресцентно помечен на одном конце. Они известны как «концевые фрагменты», потому что они помечены на конце, к которому прикреплен праймер для ПЦР. (Немеченые концы в конечном анализе не учитываются.) Далее фрагменты разделяются по размеру либо через гель или капиллярный электрофорез . Лазерное обнаружение фиксирует размер и интенсивность флуоресценции концевых фрагментов. Стандарты ДНК известного размера и флуоресценции включаются в анализ в качестве эталонов. Установив минимальный порог флуоресценции, фоновый шум будет исключен. [ 4 ]
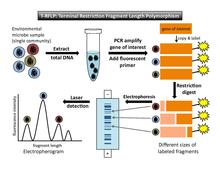
Вывод и интерпретация данных
[ редактировать ]Результатом этапа лазерного обнаружения является электрофореграмма , которая показывает серию пиков с длиной фрагмента по горизонтальной оси и интенсивностью флуоресценции по вертикальной оси (рис. 1). Второй вывод [ 4 ] представляет собой таблицу данных, в которой указано время миграции фрагментов, размер в парах оснований каждого пика, а также высота и площадь под каждым пиком.
Теоретическая основа T-RFLP предполагает, что пики в разных положениях вдоль горизонтальной оси представляют разные типы организмов (или OTU). Площадь под каждым пиком интенсивности флуоресценции является показателем относительной численности каждого филотипа в сообществе. Однако необходимо учитывать ряд предостережений. Различные типы организмов могут иметь общий сайт рестрикции в интересующем гене; в этом случае эти организмы не будут различаться по разным пикам на электрофорограмме. Более того, площадь под пиком представляет собой относительную численность, а не абсолютную численность, и существуют ошибки в измерении численности и ПЦР-амплификации. Например, организмы, которых мало в исходном образце общей ДНК, не будут достаточно амплифицированы, чтобы их можно было обнаружить в окончательном анализе. [ 7 ] Это приводит к недооценке разнообразия сообщества. Лю и др. [ 7 ] ссылаются на другие возможные факторы, которые могут исказить результаты, в том числе «различия в количестве копий генов между видами и предвзятости, возникающие во время лизиса клеток, экстракции ДНК и амплификации ПЦР» (стр. 4521). Для тех, кто ищет подробную техническую информацию, Марш [ 2 ] предоставляет каталог потенциальных ошибок, которые могут возникнуть на каждом этапе процесса T-RFLP.
Преимущества и недостатки
[ редактировать ]Основные преимущества T-RFLP заключаются в том, что он быстрый и может легко обрабатывать множество образцов. [ 2 ] Кроме того, визуальный вывод упрощает сравнение моделей структуры сообщества в разных выборках. Недостатком является широкий, качественный характер выходных данных, которые необходимо интерпретировать с учетом вышеизложенных предостережений. Кроме того, с помощью T-RFLP невозможна прямая идентификация микробов в образце.
Приложения
[ редактировать ]Дисаятануат и др. [ 8 ] использовали T-RFLP для оценки микробного сообщества кишечника, или микробиома, у двух видов медоносных пчел в Таиланде. Они обнаружили, что у этих двух видов существуют разные микробные сообщества и что микробиом меняется в течение жизни пчел.
Джу и др. [ 9 ] протестировали T-RFLP как метод мониторинга фитопланктона. Авторы собрали пробы окружающей среды из водоемов в виде временных рядов. После сравнения образцов с известными концевыми рестрикционными фрагментами (из базы данных, созданной на основе культур), они пришли к выводу, что T-RFLP можно эффективно использовать в качестве метода мониторинга изменений в сообществе фитопланктона. Однако оценки разнообразия и численности оказались менее точными, чем оценки, полученные с помощью других методов.
Денатурирующий градиентный гель-электрофорез (ДГГЭ)
[ редактировать ]Процедура
[ редактировать ]Денатурирующий градиентный гель-электрофорез (DGGE) — это метод снятия микробных отпечатков пальцев, который разделяет ампликоны примерно одинакового размера на основе свойств последовательности. [ 1 ] (рис. 2). Эти свойства определяют порог денатурации ДНК. В геле DGGE используется градиентный денатурант ДНК (смесь мочевины и формамида) или линейный температурный градиент. [ 10 ] Когда фрагмент достигает точки плавления (порог достаточного количества денатуранта), он перестает двигаться. Это связано с тем, что частично расплавленная двухцепочечная ДНК больше не может мигрировать через гель. [ 11 ] Зажим для GC (около 40 оснований с высоким содержанием GC) используется в качестве специального праймера для закрепления вместе ПЦР- фрагментов после их денатурации . [ 12 ]
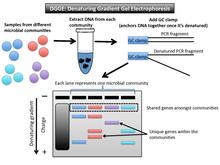
Вывод и интерпретация данных
[ редактировать ]Каждая полоса геля представляет собой одно микробное сообщество. Общие полосы в образцах имеют одинаковый размер и примерно одинаковое положение на геле. Варианты генов, которые не являются общими для образцов микробного сообщества, не совпадают по горизонтали с другими. Например, если интересующий ген представляет собой 16S рРНК, как это было при первом описании метода, фрагменты, амплифицированные с помощью ПЦР, будут находиться в одном и том же вертикальном положении, поскольку все они имеют примерно одинаковый размер. [ 13 ] Другой целевой ген может иметь большее изменение длины, но денатурирующий градиент использует второй элемент (точку плавления) для дальнейшего различия между образцами. Гель DGGE разделит гены одинакового размера на основе последовательности оснований.
Этот метод показывает, насколько микробные сообщества одинаковы или различны по таксономическому составу. Каждая полоса в разных местах геля представляет собой отдельный филотип (одну уникальную последовательность гена филогенетического маркера). [ 1 ] Для микробных сообществ этот метод позволяет профилировать множество отдельных последовательностей 16S рРНК. [ 14 ] Количество полос в разных горизонтальных положениях можно использовать для оценки уровня биоразнообразия в этом образце и вывода о филогенетической принадлежности. [ 10 ] Чтобы узнать больше о филогенетической принадлежности, можно было бы вырезать эти полосы из геля и затем секвенировать их.
Преимущества и недостатки
[ редактировать ]Использование денатурирующего профиля служит способом разделения фрагментов ДНК одинакового размера. Это полезно при оценке микробного разнообразия, поскольку размер гена 16S рРНК не сильно различается в зависимости от типа бактерий. Гель DGGE обеспечивает быстрый способ изучения биоразнообразия в микробном образце и не исключает возможности секвенирования интересующих полос. Этот метод не требует культивирования микробов в лаборатории и не требует каких-либо данных о последовательностях, необходимых для разработки зондов для методов гибридизации. [ 10 ] Основным недостатком является то, что это качественная оценка биоразнообразия, и необходимо секвенировать гены, чтобы сделать выводы о филогенетическом родстве. Еще одним недостатком является то, что зажим GC может меняться каждый раз при синтезе. Это приводит к возможности существования разных профилей DGGE для одной и той же последовательности 16S рРНК. [ 12 ]
Приложения
[ редактировать ]Стивен и др. [ 15 ] использовали DGGE для быстрого анализа протеобактерий в почве. Они получили первоначальную оценку микробного разнообразия в образцах окружающей среды, взятых из почвы, хранившейся в течение 36 лет при различных значениях pH. Они объединили методы DGGE и гибридизации, исследуя фрагменты ДНК, чтобы получить более подробную информацию о природных популяциях. В этом исследовании они изучали группу близкородственных типов бактерий, все из которых являются автотрофными β-протеобактериальными окислителями аммиака. Образцы 16S рДНК дали неоднозначно перекрывающиеся полосы при хранении в геле. Неоднозначные перекрывающиеся полосы были разделены с помощью радиомеченых зондов, специфичных для кластеров, что позволило получить информацию об относительной распространенности различных генотипов в образцах.
Уорд и др. [ 14 ] исследовали сообщества цианобактерий в горячих источниках Йеллоустоуна с помощью DGGE-анализа сегментов гена 16S рРНК аэробных хемоорганотрофных популяций. DGGE позволил им составить профиль сообщества и получить новое представление о разнообразии. Они охарактеризовали интересующие группы путем очистки и секвенирования и обнаружили множество ранее неизвестных линий.
(Автоматический) анализ рибосомальных межгенных спейсеров (ARISA)
[ редактировать ]Процедура
[ редактировать ](Автоматический) анализ рибосомальных межгенных спейсеров , или (A)RISA (рис. 3), использует тот факт, что прокариотическая ДНК кодирует два высококонсервативных гена: ген 16SrRNA и ген 23SrRNA. Они кодируют гены малых и больших субъединиц оперона рРНК. Между этими двумя генами существует внутренняя транскрибируемая спейсерная область (ITS). Поскольку он не кодирует белки, его нуклеотидная последовательность и длина сильно варьируются. Как только ДНК выделена из сообщества, ПЦР амплифицирует эту спейсерную область. Фрагменты можно вывести на гель (RISA), или флуоресцентные праймеры можно перевести в пики при большом количестве фрагментов различной длины на электрофореграмме (ARISA). [ 16 ] [ 17 ]
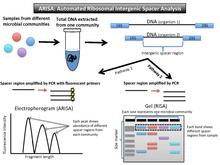
Вывод и интерпретация данных
[ редактировать ]Из-за переменных некодирующих областей выходные данные для RISA представляют собой гель с различными рисунками полос, а выходные данные для ARISA представляют собой электрофореграмму с разными пиками (аналогично T-RFLP).
Яркость флуоресцентно меченных праймеров коррелирует с тем, насколько распространен этот тип бактерий в сообществе. Рисунок полос на геле можно интерпретировать как профиль конкретного сообщества. Каждая полоса или пик ДНК указывает по крайней мере на одного представителя этого организма. [ 16 ] В RISA полосы на геле, не совпадающие по длине, представляют разные организмы в сообществе, поскольку они имеют разные спейсерные области между двумя высококонсервативными генами. На электрофореграмме показаны пики, соответствующие относительному содержанию этой спейсерной области в образце.
Преимущества и недостатки
[ редактировать ]ARISA может иметь более высокое разрешение при обнаружении микробного разнообразия по сравнению с T-RFLP . [ 18 ] Этот метод снятия отпечатков пальцев является быстрым и чувствительным методом оценки микробного разнообразия. Наблюдаемые неоднородности длины можно сравнить с базами данных на предмет совпадения с культивируемыми организмами. [ 16 ] Можно разработать олигонуклеотидные праймеры на уровне типа, чтобы ответить на вопросы, касающиеся филогенетических групп. [ 16 ] Одним из недостатков ARISA является тот факт, что один организм может вносить более чем один пик в профиль сообщества. Неродственные организмы также могут иметь одинаковую длину спейсеров, что приводит к недооценке разнообразия сообщества. Из-за этих предубеждений исследователи часто используют этот метод на нескольких выборках из каждого сообщества, чтобы получить среднюю оценку.
Приложения
[ редактировать ]Ранджард и др. [ 17 ] обсудить несколько примеров типов исследований, в которых можно использовать RISA. Они ссылаются на несколько исследований, в которых этот метод использовался для выявления бактериальных сообществ после таких нарушений, как лечение антибиотиками, ртутный стресс и вырубка лесов. Они также продемонстрировали успешное использование ARISA для характеристики грибковых сообществ, что является аспектом микробной экологии, который еще предстоит полностью изучить.
Шлосс и др. [ 19 ] провел исследование, изучающее переменные окружающей среды и связывающее их с изменениями в микробной экологии компостной кучи. Они использовали ARISA для описания структуры сообщества и изучения микробной преемственности на этапах процесса компостирования. Они взяли образцы ДНК и секвенировали ген 16S рРНК, чтобы идентифицировать членов сообщества на разных стадиях процесса. Затем они использовали ARISA, чтобы изучить изменения в масштабах сообщества, а затем сопоставили последовательность гена 16S рРНК с наиболее распространенными фрагментами ARISA, чтобы идентифицировать этих членов микробного сообщества.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Мэдиган, Монтана; Ж. М. Мартинко; П. В. Данлэп; Д. П. Кларк (2009). Брок Биология микроорганизмов (12-е изд.). Сан-Франциско, Калифорния: Pearson Education Inc.
- ^ Перейти обратно: а б с д Марш, ТЛ (2005). «Культурно-независимый анализ микробного сообщества с полиморфизмом длины концевых рестрикционных фрагментов». Экологическая микробиология . Методы энзимологии. Том. 397. С. 308–329. дои : 10.1016/s0076-6879(05)97018-3 . ISBN 9780121828028 . ПМИД 16260299 .
- ^ Перейти обратно: а б Грант, А.; Л.А. Огилви (2004). «Назовите этот микроб: быстрая идентификация таксонов, ответственных за отдельные фрагменты отпечатков пальцев структуры микробного сообщества». Заметки по молекулярной экологии . 4 (1): 133–136. дои : 10.1111/j.1471-8286.2004.00590.x .
- ^ Перейти обратно: а б с Осборн, AM; Еврорадио Мур; К. Н. Тиммис (2000). «Оценка анализа полиморфизма длины терминальных рестрикционных фрагментов (T-RFLP) для изучения структуры и динамики микробного сообщества». Экологическая микробиология . 2 (1): 39–50. Бибкод : 2000EnvMi...2...39O . дои : 10.1046/j.1462-2920.2000.00081.x . ПМИД 11243261 .
- ^ Бент, С.Дж.; Джей Ди Пирсон; Эл Джей Форни (2007). «Измерение видового богатства на основе отпечатков пальцев микробного сообщества: император без одежды» . Прикладная и экологическая микробиология . 73 (7): 2399–2401. Бибкод : 2007ApEnM..73.2399B . дои : 10.1128/aem.02383-06 . ПМЦ 1855686 . ПМИД 17403942 .
- ^ Кан, Дж.; К. Ван; Ф. Чен (2006). «Временные изменения и предел обнаружения сообщества бактериопланктона эстуария, проанализированные с помощью электрофореза в денатурирующем градиентном геле (DGGE)» . Водная микробная экология . 42 : 7–18. дои : 10.3354/ame042007 .
- ^ Перейти обратно: а б с Лю, В.-Т.; ТЛ Марш; Х. Ченг; Эл Джей Форни (1997). «Характеристика микробного разнообразия путем определения полиморфизма длины терминального рестрикционного фрагмента генов, кодирующих 16S рРНК» . Прикладная и экологическая микробиология . 63 (11): 4517–4522. Бибкод : 1997ApEnM..63.4516L . дои : 10.1128/АЕМ.63.11.4516-4522.1997 . ПМК 168770 . ПМИД 9361437 .
- ^ Дисаятануат, Т.; JPW Янг; Т. Хельгасон; П. Чантаваннакул (2012). «T-RFLP-анализ бактериальных сообществ в средней кишке медоносных пчел Apis mellifera и Apis cerana в Таиланде» . ФЭМС Микробиология Экология . 79 (2): 273–281. Бибкод : 2012FEMME..79..273D . дои : 10.1111/j.1574-6941.2011.01216.x . ПМИД 22092273 .
- ^ Джу, С.; С.-Р. Ли; С. Парк (2010). «Мониторинг структуры сообщества фитопланктона с использованием полиморфизма длины терминального рестрикционного фрагмента (T-RFLP)». Журнал микробиологических методов . 81 (1): 61–68. дои : 10.1016/j.mimet.2010.01.025 . ПМИД 20138925 .
- ^ Перейти обратно: а б с Мейзер, Г. (1999). «DGGE/TGGE - метод идентификации генов природных экосистем». Современное мнение в микробиологии . 2 (3): 317–322. дои : 10.1016/s1369-5274(99)80055-1 . ПМИД 10383868 .
- ^ Фишер, С.Г.; Л. С. Лерман (1983). «Фрагменты ДНК, различающиеся заменами одной пары оснований, разделяются при анализе денатурирующего электрофореза амплифицированных полимеразной цепной реакцией генов, кодирующих 16S рРНК» . ПНАС . 80 (6): 1579–1583. дои : 10.1073/pnas.80.6.1579 . ПМЦ 393645 . ПМИД 6220406 .
- ^ Перейти обратно: а б Реттедал, Э.А.; С. Клей; В. С. Брезель (2010). «Партии праймеров GC-clamp дают пулы ампликонов гена 16S рРНК с переменными зажимами GC, влияющими на профили денатурирующего градиентного гель-электрофореза» . Письма FEMS по микробиологии . 312 (1): 55–62. дои : 10.1111/j.1574-6968.2010.02097.x . ПМИД 20831594 .
- ^ Мейзер, Г.; ЕС Де Ваал; А. Г. Уиттерлинден (1993). «Профилирование сложных микробных популяций путем анализа денатурирующего градиентного гель-электрофореза генов, амплифицированных полимеразной цепной реакцией, кодирующих 16S рРНК» . Прикладная и экологическая микробиология . 59 (3): 695–700. Бибкод : 1993ApEnM..59..695M . дои : 10.1128/АЕМ.59.3.695-700.1993 . ПМК 202176 . ПМИД 7683183 .
- ^ Перейти обратно: а б Уорд, DM; Эм Джей Феррис; СК Нольд; ММ Бейтсон (1998). «Естественный взгляд на микробное биоразнообразие в сообществах цианобактериальных матов горячих источников» . Обзоры микробиологии и молекулярной биологии . 62 (4): 1353–1370. дои : 10.1128/MMBR.62.4.1353-1370.1998 . ПМК 98949 . ПМИД 9841675 .
- ^ Стивен, младший; Г.А. Ковальчук; МА. В. Брунс; А.Е. Маккейг; Си Джей Филлипс; ТМ Эмбли; Дж. И. Проссе (1998). «Анализ популяций протеобактерий-окислителей аммиака β-подгруппы в почве путем анализа денатурирующего градиентного гель-электрофореза и иерархического филогенетического зондирования» . Прикладная и экологическая микробиология . 64 (8): 2958–2965. Бибкод : 1998ApEnM..64.2958S . дои : 10.1128/АЕМ.64.8.2958-2965.1998 . ПМК 106799 . ПМИД 9687457 .
- ^ Перейти обратно: а б с д Фишер, ММ; Э. У. Триплетт (1999). «Автоматизированный подход к рибосомальному межгенному спейсерному анализу микробного разнообразия и его применение к пресноводным бактериальным сообществам» . Прикладная и экологическая микробиология . 65 (10): 4630–4636. Бибкод : 1999ApEnM..65.4630F . дои : 10.1128/АЕМ.65.10.4630-4636.1999 . ПМК 91617 . ПМИД 10508099 .
- ^ Перейти обратно: а б Ранджард, Л.; Ф. Поли; Ж.-К. Лата; К. Мугель; Ж. Тиулуза; С. Назарет (2001). «Характеристика бактериальных и грибных почвенных сообществ с помощью автоматического анализа рибосомальных межгенных спейсеров: биологическая и методологическая изменчивость» . Прикладная и экологическая микробиология . 67 (10): 4479–4487. Бибкод : 2001ApEnM..67.4479R . doi : 10.1128/aem.67.10.4479-4487.2001 . ПМК 93193 . ПМИД 11571146 .
- ^ Дановаро, Р.; ГМ Луна; А. Делл'Анно; Б. Пьетранджели (2006). «Сравнение двух методов снятия отпечатков пальцев, полиморфизма длины концевых рестрикционных фрагментов и автоматического анализа рибосомальных межгенных спейсеров для определения бактериального разнообразия в водной среде» . Прикладная и экологическая микробиология . 72 (9): 5982–5989. Бибкод : 2006ApEnM..72.5982D . дои : 10.1128/aem.01361-06 . ПМЦ 1563681 . ПМИД 16957219 .
- ^ Шлосс, PD; А.Г. Хэй; Д.Б. Уилсон; ЛП Уокер (2003). «Отслеживание временных изменений в отпечатках пальцев бактериального сообщества на начальных стадиях производства компостина» . ФЭМС Микробиология Экология . 46 (1): 1–9. Бибкод : 2003FEMME..46....1S . дои : 10.1016/s0168-6496(03)00153-3 . ПМИД 19719577 .