4-нитроанилин
| |||

| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
4-нитроанилин | |||
| Систематическое название ИЮПАК
4-нитробензенамин | |||
| Другие имена
п -Нитроанилин
1-амино-4-нитробензол п -Нитрофеламин | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| 508690 | |||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.002.555 | ||
| Номер ЕС |
| ||
| 27331 | |||
| КЕГГ | |||
ПабХим CID
|
|||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 1661 | ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 6 Н 6 Н 2 О 2 | |||
| Молярная масса | 138.12 g/mol | ||
| Появление | желтый или коричневый порошок | ||
| Запах | слабый, похожий на аммиак | ||
| Плотность | 1,437 г/мл, твердый | ||
| Температура плавления | От 146 до 149 ° C (от 295 до 300 ° F; от 419 до 422 К) (лит.) | ||
| Точка кипения | 332 ° С (630 ° F; 605 К) | ||
| 0,8 мг/мл при 18,5 °C (IPCS) | |||
| Давление пара | 0,00002 мм рт.ст. (20°С) [ 1 ] | ||
| -66.43·10 −6 см 3 /моль | |||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности
|
Токсичный | ||
| СГС Маркировка : | |||
 
| |||
| Предупреждение | |||
| Х301 , Х311 , Х331 , Х373 , Х412 | |||
| P260 , P261 , P264 , P270 , P271 , P273 , P280 , P301+P310 , P302+P352 , P304+P340 , P311 , P312 , P314 , P321 , P322 , P330 , P361 , P363 , П403+П233 , П405 , П501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 199 ° С (390 ° F; 472 К) | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза )
|
3249 мг/кг (крыса, перорально) 750 мг/кг (крыса, перорально) 450 мг/кг (морская свинка, перорально) 810 мг/кг (мыши, перорально) [ 2 ] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
ПЭЛ (допустимо)
|
TWA 6 mg/m3 (1 ppm) [skin] [ 1 ] | ||
РЕЛ (рекомендуется)
|
СВВ 3 мг/м 3 [кожа] [ 1 ] | ||
IDLH (Непосредственная опасность)
|
300 мг/м 3 [ 1 ] | ||
| Паспорт безопасности (SDS) | Джей Ти Бейкер | ||
| Родственные соединения | |||
Родственные соединения
|
2-нитроанилин , 3-нитроанилин | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
4-Нитроанилин , п-нитроанилин или 1-амино-4-нитробензол — органическое соединение с формулой C 6 H 6 N 2 O 2 . Желтое твердое вещество, это один из трех изомеров нитроанилина. Он является промежуточным продуктом в производстве красителей, антиоксидантов, фармацевтических препаратов, бензина, ингибиторов образования смол, лекарств для птиц, а также в качестве ингибитора коррозии. [ 3 ]
Синтез
[ редактировать ]4-Нитроанилин получают в промышленности путем аминирования 4-нитрохлорбензола : [ 3 ]
- ClC 6 H 4 NO 2 + 2 NH 3 → H 2 NC 6 H 4 NO 2 + NH 4 Cl
Ниже представлен лабораторный синтез 4-нитроанилина из анилина . Ключевым этапом в этой последовательности реакций является электрофильное ароматическое замещение -нитрогруппы для установки пара в аминогруппу. Аминогруппа легко протонируется и становится метадиректором. Следовательно, необходима защита ацетильной группы. После этой реакции необходимо провести разделение для удаления 2-нитроанилина, который также образуется в небольшом количестве в ходе реакции. [ 4 ]
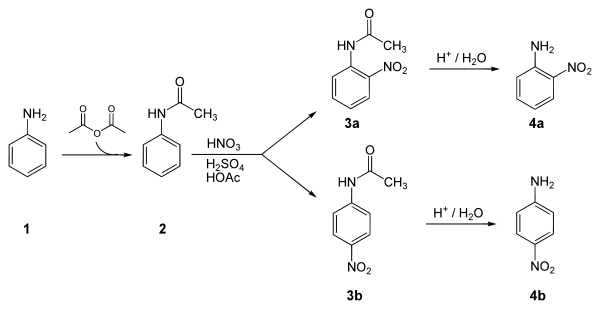
Приложения
[ редактировать ]4-Нитроанилин в основном используется в промышленности как предшественник п- фенилендиамина , важного компонента красителя. Восстановление осуществляют с использованием металлического железа и каталитического гидрирования. [ 3 ]
Это исходный материал для синтеза Para Red , первого азокрасителя : [ 5 ]

Лабораторное использование
[ редактировать ]Нитроанилин подвергается диазотированию , что открывает доступ к 1,4-динитробензолу. [ 6 ] и нитрофениларсоновая кислота. [ 7 ] С фосгеном он превращается в 4- нитрофенилизоцианат . [ 8 ] [ 9 ]
Демонстрация углеродной змеи
[ редактировать ]При нагревании с серной кислотой он обезвоживается и взрывоопасно полимеризуется в твердую пену. [ 10 ]
В демонстрации Carbon Snake вместо сахара можно использовать паранитроанилин, если эксперименту разрешено проводиться в обязательном вытяжном шкафу . [ 11 ] При использовании этого метода фаза реакции до появления черной змеи длится дольше, но после завершения черная змея сама очень быстро поднимается из контейнера. [ 12 ] Эта реакция может вызвать взрыв , если использовать слишком много серной кислоты. [ 13 ]
Токсичность
[ редактировать ]Соединение токсично при вдыхании, проглатывании и абсорбции, поэтому с ним следует обращаться осторожно. Его ЛД 50 у крыс составляет 750,0 мг/кг при пероральном введении. 4-Нитроанилин особенно вреден для всех водных организмов и может нанести долгосрочный ущерб окружающей среде, если его выбросить в качестве загрязнителя. [ 14 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д Карманный справочник NIOSH по химическим опасностям. «#0449» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «п-Нитроанилин» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Jump up to: а б с Бут, Джеральд (11 марта 2003 г.). «Нитросоединения ароматические» . В Вили-ВЧ (ред.). Энциклопедия промышленной химии Ульмана (1-е изд.). Уайли. дои : 10.1002/14356007.a17_411 . ISBN 978-3-527-30385-4 . ]
- ^ Мориг, младший; Моррилл, TC; Хаммонд, Китай; Некерс, округ Колумбия (1997). «Синтез 5: Синтез красителя Para Red из анилина» . Экспериментальная органическая химия . Нью-Йорк, штат Нью-Йорк: Фриман. стр. 456–467. Архивировано из оригинала 15 сентября 2020 г. Проверено 18 июля 2007 г.
- ^ Уильямсон, Кеннет Л. (2002). Макромасштабные и микромасштабные органические эксперименты, четвертое издание . Хоутон-Миффлин . ISBN 0-618-19702-8 .
- ^ Старки, Э.Б. (1939). «п-ДИНИТРОБЕНЗОЛ» . Органические синтезы . 19:40 . дои : 10.15227/orgsyn.019.0040 .
- ^ «п-НИТРОФЕНИЛАРЗОНОВАЯ КИСЛОТА» . Органические синтезы . 26 : 60. 1946. doi : 10.15227/orgsyn.026.0060 .
- ^ Шрайнер, РЛ; Хорн, Вашингтон; Кокс, RFB (1934). «п-НИТРОФЕНИЛИЗОЦИАНАТ» . Органические синтезы . 14:72 . дои : 10.15227/orgsyn.014.0072 .
- ^ «2,6-ДИИОД-п-НИТРОАНИЛИН» . Органические синтезы . 12:28 . 1932. doi : 10.15227/orgsyn.012.0028 .
- ^ Пошкус, А.С.; Паркер, Дж. А. (1970). «Исследования нитроанилин-сернокислотных составов: афрогенные пиростаты» . Журнал прикладной науки о полимерах . 14 (8): 2049–2064. дои : 10.1002/app.1970.070140813 .
- ^ Саммерлин, Ли Р.; Или, Джеймс Л. (1988). «Эксперимент 100: Дегидратация п-нитроанилина: Санке и Пафф». Химические демонстрации: Справочник для учителей, том 1 (2-е изд.). Американское химическое общество . п. 171. ИСБН 978-0-841-21481-1 .
- ^ «Углеродная змея: демонстрация способности обезвоживания концентрированной серной кислоты» . Community.acs.org . 06.06.2013 . Проверено 31 января 2022 г.
- ^ Изготовление углеродной змеи из п-нитроанилина , получено 31 января 2022 г.
- ^ «4-Нитроанилин» . Сент-Луис, Миссури: Сигма-Олдрич. 18 декабря 2020 г.


